Журнал «» №3-4 (65-66), 2019
Вернуться к номеру
Підвищення ефективності статинотерапії в пацієнтів дуже високого серцевого ризику із супутньою патологією шлунково-кишкового тракту (дослідження СТАЄР)
Авторы: Клекот О.О.(1), Галуган Л.І.(2)
(1) — Вінницький національний медичний університет ім. М.І. Пирогова, м. Вінниця, Україна
(2) — КНП «Вінницька міська клінічна лікарня № 3», м. Вінниця, Україна
Рубрики: Кардиология
Разделы: Клинические исследования
Версия для печати
Актуальність. Гіперхолестеринемія належить до модифікованих факторів ризику серцево-судинної патології. Застосування гіполіпідемічних препаратів із групи статинів, зокрема розувастатину, достовірно покращує прогноз і знижує ризик розвитку небезпечних ускладнень при ішемічній хворобі серця (ІХС). Існує велика кількість факторів, що можуть знижувати ефективність статинів, серед них — кислотозалежна патологія шлунково-кишкового тракту (ШКТ). Мета: визначити й порівняти ефективність різних солей розувастатину (розувастатин кальцію і розувастатин меглюміну) у пацієнтів дуже високого серцево-судинного ризику із хронічною ІХС і артеріальною гіпертензією (АГ), коморбідною з кислотозалежними захворюваннями ШКТ. Матеріали та методи. У дослідження СТАЄР включені 78 пацієнтів (середній вік 54,2 ± 4,7 року) з ІХС і АГ, коморбідною з кислотозалежною патологією ШКТ, які протягом 8 тижнів приймали базисну терапію й розувастатин кальцію в дозі 20 мг/добу. Усім пацієнтам проводилось дослідження ліпідного спектра крові й контролювали показники роботи нирок і печінки. Через 8 тижнів терапії розувастатин кальцію було замінено на розувастатин меглюміну в аналогічній дозі на такий же термін спостереження. Результати. Застосування розувастатину кальцію було ефективним у половини пацієнтів з ІХС і АГ (52,5 %), ще меншою (36,8 %) ефективність була за наявності в цих хворих кислотозалежних захворювань ШКТ. Найменш чутливими до терапії розувастатином кальцію виявились жінки, хворі з високим ступенем АГ, пацієнти з ожирінням і хворі, які приймали подвійну антитромбоцитарну терапію (ацетилсаліцилова кислота + клопідогрель). Після заміни розувастатину кальцію на розувастатин меглюміну в аналогічній дозі було відмічено суттєве зростання гіполіпідемічного ефекту в групі серцево-судинних захворювань, коморбідних із патологією ШКТ: рівень загального холестерину зменшився в 1,5 раза порівняно з показником при прийомі розувастатину кальцію, а рівень холестерину ліпопротеїдів низької щільності знизився в 1,7 раза (р < 0,05). Висновки. Гіполіпідемічний ефект розувастатину меглюміну достовірно перевищує такий при застосуванні розувастатину кальцію в 1,7 раза в пацієнтів із кислотозалежними захворюваннями ШКТ через ймовірно вищу стабільність і кращу розчинність препарату в кишечнику при кислих значеннях рН. Препарати, що містять меглюмінову сіль розувастатину, можуть бути препаратами вибору для комплексної довготривалої терапії пацієнтів з такою нозологією.
Актуальность. Гиперхолестеринемия относится к модифицированным факторам риска сердечно-сосудистой патологии. Применение гиполипидемических препаратов из группы статинов, в частности розувастатина, достоверно улучшает прогноз и снижает риск развития опасных осложнений при ишемической болезни сердца (ИБС). Существует множество факторов, которые могут снижать эффективность статинов, среди них — кислотозависимая патология желудочно-кишечного тракта (ЖКТ). Цель: определить и сравнить эффективность различных солей розувастатина (розувастатин кальция и розувастатин меглюмина) у пациентов очень высокого сердечно-сосудистого риска с хронической ИБС и артериальной гипертензией (АГ), коморбидной с кислотозависимыми заболеваниями ЖКТ. Материалы и методы. В исследование СТАЕР включены
78 пациентов (средний возраст 54,2 ± 4,7 года) с ИБС и АГ, коморбидной с кислотозависимой патологией ЖКТ, которые в течение 8 недель принимали базисную терапию и розувастатин кальция в дозе 20 мг/сут. Всем пациентам проводилось исследование липидного спектра крови и контролировались показатели работы почек и печени. Через 8 недель терапии розувастатин кальция был заменен на розувастатин меглюмина в аналогичной дозе на такой же срок наблюдения. Результаты. Применение розувастатина кальция было эффективным у половины пациентов с ИБС и АГ (52,5 %), еще меньшей (36,8 %) эффективность была при наличии при этих больных кислотозависимых заболеваний ЖКТ. Наименее чувствительными к терапии розувастатином кальция оказались женщины, больные с высокой степенью АГ, пациенты с ожирением и больные, получавшие двойную антитромбоцитарную терапию (ацетилсалициловая кислота + клопидогрель). После замены розувастатина кальция на розувастатин меглюмина в аналогичной дозе было отмечено значительное усиление гиполипидемического эффекта в группе сердечно-сосудистых заболеваний, коморбидных с патологией ЖКТ: уровень общего холестерина уменьшился в 1,5 раза по сравнению с показателем при приеме розувастатина кальция, а уровень холестерина липопротеидов низкой плотности снизился в 1,7 раза (р < 0,05). Выводы. Гиполипидемический эффект розувастатина меглюмина достоверно превышает таковой при применении розувастатина кальция в 1,7 раза у пациентов с кислотозависимыми заболеваниями ЖКТ из-за достоверно большей стабильности и лучшей растворимости препарата в кишечнике при кислых значениях рН. Препараты, содержащие меглюминовую соль розувастатина, могут быть препаратами выбора для комплексной длительной терапии пациентов с такой нозологией.
Background. Hypercholesterolemia is a modified risk factor for the development of cardiovascular diseases. The use of lipid-lowering agents from the group of statins, in particular rosuvastatin, significantly improves the prognosis and the risk of developing dangerous complications in coronary heart disease (CHD). There are a large number of factors that can reduce the effectiveness of statins, including acid-related gastrointestinal pathology. Objective: to determine and compare the efficacy of various rosuvastatin salts (rosuvastatin calcium and rosuvastatin meglumine) in patients with very high cardiovascular risk with chronic CHD and hypertension comorbid with acid-related gastrointestinal diseases. Materials and methods. The study СТАЄР included 78 patients (average age of 54.2 ± 4.7 years) with CHD and hypertension comorbid with acid-related gastrointestinal pathology, who received baseline therapy and rosuvastatin calcium at a dose of 20 mg/day for 8 weeks. Blood lipids, kidney and liver indicators were monitored in all patients. After 8 weeks of treatment, rosuvastatin calcium was replaced with rosuvastatin meglumine at a similar dose for the same term of observation. Results. The use of rosuvastatin calcium was effective in half of patients with CHD and hypertension (52.5 %), it was less (36.8 %) effective in the presence of acid-dependent gastrointestinal diseases in these patients. Women, patients with a high degree of hypertension, obese persons, and patients taking dual antiplatelet therapy (acetylsalicylic acid + clopidogrel) were the least sensitive to the treatment with rosuvastatin calcium. Following the replacement of rosuvastatin calcium with rosuvastatin meglumine at a similar dose, a significant increase in the hypolipidemic effect in cardiovascular diseases comorbid with gastrointestinal pathology was noted: the level of total cholesterol decreased by 1.5 times compared to this indicator when taking rosuvastatin calcium, and the level of low-density lipoprotein cholesterol reduced by 1.7 times (p < 0.05). Conclusions. The hypolipidemic effect of rosuvastatin meglumine is significantly higher than that of rosuvastatin calcium — by 1.7 times in patients with acid-related gastrointestinal diseases due to the allegedly higher stability and better solubility of the drug in the intestine with acidic pH values. Preparations containing rosuvastatin meglumine salt may be the drugs of choice for a comprehensive long-term treatment of patients with such a nosology.
ішемічна хвороба серця; кислотозалежні захворювання; дисліпідемії; холестерин; розувастатин кальцію; розувастатин меглюміну
ишемическая болезнь сердца; кислотозависимые заболевания; дислипидемии; холестерин; розувастатин кальция; розувастатин меглюмина
coronary heart disease; acid-related diseases; dyslipidemia; cholesterol; rosuvastatin calcium; rosuvastatin meglumine
Вступ
Атеросклеротичне ураження судин є основ–ним патогенетичним фактором розвитку ішемічної хвороби серця (ІХС) і цереброваскулярної патології. Проведення активної первинної й вторинної профілактики, направленої на корекцію гіперліпідемічних станів, забезпечує якісний контроль захворюваності на серцево–судинну патологію й зниження серцево–судинної смертності [1].
У сучасних умовах препаратами першої лінії для зниження рівня атерогенних фракцій ліпідів залишаються статини [2]. Значимість статинотерапії обґрунтована великою кількістю клінічних досліджень щодо їх гіполіпідемічної ефективності з високим рівнем доказовості [3, 4]. Дана група відзначається також цілою низкою позитивних плейотропних ефектів — покращення функції судинного ендотелію [5], зниження жорсткості судинної стінки [6], нормалізація показників системного запалення [7], порушення яких тісно корелює з прогресуванням атеросклерозу й погіршує прогноз перебігу захворювання. Одним з ефективних і безпечних статинів можна вважати розувастатин. Незважаючи на спільний для всіх статинів механізм основного фармакодинамічного ефекту (пригнічення активності ГМГ–КoA–редуктази гепатоцитів), розувастатин потужніше взаємодіє з активним центром ферменту–мішені, має високу стереоізомеричну відповідність молекули [8] і відзначається високою гепатоселективністю. Саме такі характеристики препарату зумовлюють низький ризик появи патології скелетних м’язів та інших позапечінкових небажаних ефектів.
Розувастатин має також певні фармакокінетичні відмінності. Препарат практично не метаболізується в печінці, що є важливим з огляду на часте застосування комбінованої терапії й високий ризик потенційної взаємодії на етапі біотрансформації. Для нього також характерний подвійний шлях елімінації — печінковий і нирковий, що створює додаткові альтернативи для його використання в пацієнтів з ізольованим ураженням органів виведення.
Однак, незважаючи на такий потужний арсенал гіполіпідемічних засобів і зростання поширеності застосування статинів у сучасній практиці, досягти цільових показників холестерину (ХС) ліпопротеїдів низької щільності (ЛПНЩ) у пацієнтів високого й дуже високого серцево–судинного ризику вдається менше ніж у половини хворих (від 32 до 55 % пацієнтів) у європейських країнах [9]. Причинами невисокої ефективності цих засобів, на думку різних вчених, можуть бути: недостатнє всмоктування статинів у ШКТ, супутні кислотозалежні захворювання (КЗЗ) ШКТ, неправильний підбір дози в результаті неефективного титрування, супутня неврологічна й ендокринна патологія, гендерні особливості фармакодинаміки й незадовільний комплаєнс щодо прийому препаратів [10]. Згідно з результатами останніх міжнародних досліджень, незалежними факторами ризику недосягнення цільових рівнів є: толерантність до статинів, ожиріння й надмірна вага, жіноча стать, високий артеріальний тиск, паління цигарок, наявність когнітивних порушень [9]. Не варто відкидати й певні фармакокінетичні особливості всмоктування препаратів у ШКТ як потенційний чинник низької біодоступності, а отже, і недостатньої ефективності статинів. Усі представники статинів є похідними слабких кислот, тому їх розчинність та абсорбція в ШКТ можуть залежати від цілої низки фізіологічних характеристик: рН шлункового соку, моторики ШКТ, наявності супутньої патології шлунка й кишечника, фізико–хімічних властивостей лікарського засобу й властивостей його стабілізуючих компонентів.
З погляду клінічної фармакології й клінічної фармації потенційно ефективним шляхом підвищення гіполіпідемічної активності статинів в умовах кислого рН може бути вдосконалення буферної ємності слабкої кислоти шляхом додавання олужнюючих протиіонів, що забезпечують покращення розчинності й максимальне ентеральне всмоктування. До затвердженого FDA переліку протиіонів, що можуть застосовуватись для кислотних активних фармацевтичних інгредієнтів, включені: лужні солі натрію, кальцію, цинку, калію, меглюмін, діетаноламін тощо [11]. Вибір правильного протиіону для лікарської речовини відіграє важливу роль у забезпеченні розчинності цієї сполуки. Протиіонами для розувастатину виробники лікарських засобів часто обирають сіль фосфату кальцію, тому більшість препаратів, представлених на фармацевтичному ринку України, — це кальцієві солі розувастатину (розуліп, розарт, клівас, мертеніл, роксера). Альтернативою розувастатину кальцію сьогодні може бути меглюмінова сіль розувастатину (Редистатин®) виробництва компанії Dr. Reddy’s.
Меглюмін — це похідне сорбітолу зі значенням рН 11–12, що використовується як високоякісний безпечний буферний агент і стабілізатор при виробництві лікарських засобів кислотної природи. Меглюмін, як функціональний ексципієнт із
pКа = 9,6, суттєво підвищує швидкість розчинення препарату в кишечнику. Крім того, сіль розувастатину з меглюміном забезпечує високу фармацевтичну стабільність молекули з високим ступенем безпеки обох компонентів. Меглюмін відповідає всім вимогам і стандартам якості протиіонів органічного походження, не чинить подразнюючого впливу на слизову оболонку шлунка й кишечника порівняно з іншими представниками цієї категорії фармацевтичних добавок і може успішно застосовуватись в умовах підвищеної кислотності шлунка.
Мета роботи: визначити порівняльну ефективність різних солей розувастатину (розувастатин кальцію та розувастатин меглюміну) в пацієнтів дуже високого серцево–судинного ризику з хронічною ІХС та артеріальною гіпертензією (АГ), коморбідною з кислотозалежними захворюваннями ШКТ.
Матеріали та методи
Дизайн дослідження
Проспективне рандомізоване дослідження СТАЄР включало вивчення й порівняння ефективності різних солей розувастатину (розувастатин кальцію і розувастатин меглюміну) в пацієнтів дуже високого серцевого ризику. Усі пацієнти були розподілені на дві репрезентативні вибірки за віком і статтю: група І — 40 пацієнтів з ІХС (стабільна стенокардія напруження І–ІІ функціонального класу (ФК)) + АГ без супутньої патології ШКТ; група ІІ — 38 пацієнтів з ІХС (стабільна стенокардія напруження І–ІІ ФК) + АГ, коморбідна з КЗЗ ШКТ.
У дослідження були включені пацієнти, які протягом останніх 8 тижнів безперервно приймали препарати розувастатину кальцію в дозі 20 мг/добу. Після оцінки біохімічних показників і параметрів ліпідограми розувастатин кальцію був замінений на іншу сіль розувастатину — меглюмінову (Редистатин®) в аналогічній дозі 20 мг/добу і на такий же період спостереження (8 тижнів) з подальшою оцінкою ліпідограми.
Окрім гіполіпідемічних препаратів, усі пацієнти отримували базисну терапію ІХС: ацетилсаліцилова кислота (АСК) 100 мг/добу і/або клопідогрель 75 мг/добу, бісопролол 5–10 мг/добу, раміприл 5–10 мг/добу, індапамід 2,5 мг/добу, лерканідипін 5–10 мг/добу, при хронічній серцевій недостатності (ХСН) пацієнти додатково приймали торасемід 5 мг/добу і спіронолактон 50 мг/до– бу, при ангінозних нападах — нітрогліцерин сублінгвально.
Популяція осіб, включених у дослідження
У дослідження СТАЄР включені 78 пацієнтів дуже високого серцево–судинного ризику обох статей (табл. 1). Середній вік пацієнтів — 54,2 ± 4,7 року. Критеріями включення в дослідження були наявність ІХС та АГ, їх коморбідність із КЗЗ верхніх відділів ШКТ (гастроезофагеальна рефлюксна хвороба (ГЕРХ), неускладнена пептична виразка, невиразкова диспепсія, гастропатія, зумовлена нестероїдними протизапальними препаратами (НПЗП–гастропатія)), відсутність цільових показників ліпідограми, добровільна інформована згода на участь у дослідженні. На час проведення дослідження прийом антисекреторних препаратів (зокрема, інгібіторів протонної помпи) не проводився.
У дослідження СТАЄР не включали пацієнтів, старших за 70 років, пацієнтів із гострим коронарним синдромом і стабільною стенокардією ІІІ–ІV ФК, алкоголізмом, цирозом печінки, гепатитами, тяжкою хронічною хворобою нирок (швидкість клубочкової фільтрації < 50 мл/хв).
Кінцеві точки дослідження
Первинними кінцевими точками дослідження СТАЄР було досягнення цільових рівнів загального холестерину (ЗХС) < 155 мг/дл (4,0 ммоль/л) і ЛПНЩ < 70 мг/дл (1,8 ммоль/л). Додатково оцінювались інші показники ліпідограми та їх динаміка: ліпопротеїди високої щільності (ЛПВЩ), тригліцериди (ТГ). Паралельно здійснювався моніторинг безпеки статинотерапії у вигляді контролю симптомів міопатії, визначення рівня печінкових трансаміназ, креатинфосфокінази й показників роботи нирок (креатинін, сечовина). Усі лабораторні дослідження виконувались в одній сертифікованій лабораторії з дотриманням загальноприйнятих правил забору крові та її транспортування. ЛПНЩ розраховувались за методикою Фрідвальда.
Статистичний аналіз
Статистичну обробку даних проводили з використанням програмних пакетів Statistica 10.0 і Excel 2007 з визначенням критерію Стьюдента. Достовірність частотних показників визначалась за методом Фішера.
Результати та обговорення
Ретроспективний аналіз ліпідограм пацієнтів на тлі застосування розувастатину кальцію протягом 8 тижнів продемонстрував достатньо високі рівні ЗХС і ХС ЛПНЩ (табл. 2), при чому пацієнти з коморбідною патологією ШКТ мали достовірно вищі значення: ЗХС — на 13,4 % більше, а ХС ЛПНЩ — на 38,8 % більше (р < 0,05) порівняно з пацієнтами без КЗЗ. Така різниця, ймовірно, може бути віддзеркаленням порушення процесів абсорбції розувастатину в кишечнику (табл. 2) в умовах підвищеного рН. Показники неатерогенного ХС ЛПВЩ в обох групах характеризувались невисокими значеннями (< 1,0 ммоль/л), а рівень ТГ не досягав нормативного.
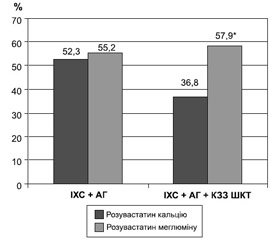
При оцінці ступеня досягнення цільових показників ліпідограми при застосуванні кальцієвої солі розувастатину (рис. 1) виявилось, що лише кожен другий (52,5 %) пацієнт у І клінічній групі й кожен третій (36,8 %) — у ІІ групі дослідження досяг цих значень. Отже, наявність КЗЗ ШКТ у пацієнтів дуже високого серцево–судинного ризику є предиктором недостатньої ефективності статинотерапії і може погано впливати на подальший перебіг і прогноз захворювання в цієї категорії пацієнтів.
Найбільш резистентними до терапії розувастатином кальцію виявились хворі з високим ступенем АГ, пацієнти з ожирінням, пацієнти жіночої статі й хворі, які приймали подвійну антитромбоцитарну терапію (АСК + клопідогрель) (рис. 2), причому в останній категорії максимальна частка хворих не досягла цільових рівнів ліпідограми в обох клінічних групах — 80 і 93,75 %. Прийом подвійної антитромбоцитарної терапії мав тісний кореляційний зв’язок (r = 0,16, р < 0,05) з високими значеннями ЗХС і ХС ЛПНЩ на тлі терапії розувастатином кальцію.
Структурний аналіз нозологічних одиниць поєднаної патології ШКТ виявив найнижчі показники досягнення цільових рівнів ліпідограми при застосуванні розувастатину кальцію в пацієнтів із верифікованою НПЗП–гастропатією і пептичною виразкою шлунка — 20 і 23,1 % відповідно (рис. 3). Серед пацієнтів з ІХС + АГ, коморбідною з ГЕРХ і невиразковою диспепсією, практично половина досягла нормативних значень ЛПНЩ (< 1,8 ммоль/л). Це доводить, що надмірна секреція соляної кислоти може негативно впливати на стабільність молекули розувастатину з кальцієм й змінювати його фармакокінетичні властивості.
Після включення в дослідження хворим обох груп розувастатину меглюміну в дозі, аналогічній щодо попередньому прийому розувастатину кальцію, з контролем ліпідограми через 8 тижнів було відмічено суттєве зростання гіполіпідемічного ефекту (табл. 2) в групі серцево–судинних захворювань, коморбідних із патологією ШКТ: рівень ЗХС зменшився в 1,5 раза порівняно з розувастатином кальцію, а показник ХС ЛПНЩ знизився
в 1,7 раза (р < 0,05). Результат досягнення цільових рівнів в групі достовірно зріс у 1,6 раза (табл. 2) порівняно з попередньою схемою фармакотерапії. Варто також зазначити, що відмічалась позитивна тенденція щодо зростання неатерогенних фракцій ліпідів і достовірне зниження рівня ТГ на 21,5 % саме в групі з патологією ШКТ. Щодо групи порівняння з виключно кардіальною патологією, то заміна розувастатину кальцію на розувастатин меглюміну привела до помірного покращення показників ліпідограми, зокрема, рівень ЗХС зменшився в 1,3 раза, не досягнувши цільового рівня < 4 ммоль/л, а динаміка ЛПНЩ, ЛПВЩ і ТГ теж була позитивною при невисокому ступені достовірності.
У групах пацієнтів із КЗЗ ШКТ відмічено зростання числа пацієнтів, яким вдалося досягти оптимальних значень ліпідного обміну (рис. 4), зокрема, у групі пацієнтів із пептичною виразкою 60 % хворих досягли бажаного рівня, що на 40 % більше (р < 0,05) порівняно з вихідним, пацієнти з НПЗП–гастропатією також достовірно покращили ліпідні показники на 30,7 % (р < 0,05). Невисокий приріст продемонстрували пацієнти з ГЕРХ і невиразковою диспепсією — +12,5 і +8,3 % відповідно щодо досягнення цільових значень.
Висновки
У пацієнтів дуже високого серцево–судинного ризику із супутніми КЗЗ ШКТ відмічалася недостатня ефективність кальцієвої солі розувастатину через можливі труднощі абсорбції лікарського засобу в просвіті кишечника в результаті нестабільності активних фармацевтичних інгредієнтів в умовах підвищеного рН. Найбільш низьку ефективність розувастатину кальцію відмічено в пацієнтів із НПЗП–гастропатією й пептичною виразкою шлунка. Супутній прийом подвійної антитромбоцитарної терапії також негативно впливав на результат статинотерапії, що підтверджує вплив тривалого застосування цих засобів на порушення абсорбції статинів в умовах підвищеної кислотної функції шлунка.
Застосування розувастатину у вигляді меглюмінової солі в пацієнтів дуже високого серцево–судинного ризику з патологією ШКТ дозволяє достовірно покращити корекцію рівня ЗХС і ХС ЛПНЩ до цільових значень у більшості хворих у середніх терапевтичних дозах, хоча міжнародні рекомендації нерідко передбачають використання достатньо високих доз розувастатину. Гіполіпідемічний ефект розувастатину меглюміну достовірно перевищує такий при застосуванні розувастатину кальцію в 1,7 раза в пацієнтів із КЗЗ ШКТ, тому розувастатин меглюміну може бути препаратом вибору для комплексної довготривалої терапії пацієнтів із такою нозологією.
Отже, індивідуальний підхід до вибору різних солей розувастатину з урахуванням кислотності ШКТ забезпечить високу ефективність у профілактиці й лікуванні серцево–судинних захворювань на тлі коморбідної патології.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
1. Шальнова С.А., Оганов Р.Г., Деев А.Д. и др. Сочетание ишемической болезни сердца с другими неинфекционными заболеваниями в популяции взрослого населения: ассоциации с возрастом и факторами риска. Кардиоваскулярная терапия и профилактика. 2015. 14(4). 44–45.
2. Сусеков А.В. Современные подходы в лечении дислипидемий: от научных дискуссий к конкретному больному. Медицинский совет. 2015. 12. 94–103.
3. LaRosa J.S., He J., Vupputuri S. Effect of statins on risk of coronary disease: a metaanalisis of randomized controlled trials. JAMA. 1999. 282(24). 2340–6.
4. Farmer J.A., Cotto A.M. Jr. The Heart Protection Study: expanding the boundaries for high–risk coronary disease prevention. Am. J. Cardiol. 2003. 92(1A). 3i–9i.
5. Киреева В.В., Кох Н.В., Лифшиц Г.И., Апарцин К.А. Дисфункция эндотелия как краеугольный камень сердечно–сосудистых событий: молекулярно– и фармакогенетические аспекты. Российский кардиологический журнал. 2014. 10(114). 64–8.
6. Драпкина О., Палаткина Л., Зятенкова Е. Плеотропные эффекты статинов. Влияние на жесткость. Врач. 2012. 9. 5–8.
7. Ray K.K., Cannon C.P. The Potential Relevance of the Multiple Lipid–Independent (Pleiotropic) Effects of Statins in the Management of Acute Coronary Syndromes. Journal of the American College of Cardiology. 2005. 46. 1425–1433.
8. Istvan E.S., Deisenhofer J. Structural mechanism for statin inhibition of HMG–CoA reductase. Science. 2001. 292(5519). 1160–4.
9. Danchin N., Almahmeed W., Khalid Al–Rasadi et al. Achievement of low–density lipoprotein cholesterol goals in 18 countries outside Western Europe: The International ChoLesterol management Practice Study (ICLPS). Eur. J. of Preventive Cardiology. 2018. 25(10). 1087–1094.
10. Kotseva K., Wood D., DeBacker G., EUROASPIRE Study Group. Cardiovascular prevention guidelines in dally practice: a comparison of EUROSPIRE I, II and III surveys in eight European countries. Lancet. 2009. 373. 929–40.
11. Paulekuhn G.S., Dressman G.B., Saal C. Trends in active pharmaceutical ingredient salt selection based on analysis of the orange book database. J. Med. Сhem. 2007. 50. 6665– 6672.

/79-1.jpg)
/80-1.jpg)
/80-2.jpg)
/81-1.jpg)