Журнал «Почки» Том 8, №3, 2019
Вернуться к номеру
Новые возможности восстановления функции и целостности уротелия при лечении острого и хронического цистита с использованием метилтиониния хлорида
Рубрики: Нефрология
Разделы: Справочник специалиста
Версия для печати
Инфекции нижних мочевыводящих путей и, в частности, острый цистит (ОЦ) остаются серьезной проблемой здравоохранения, затрагивающей физическое здоровье женщины и ее сексуальную жизнь. Эффективное лечение ОЦ остается междисциплинарной проблемой, а затраты ложатся на систему здравоохранения и пациентов.
Считается, что каждая женщина один раз в жизни переносит ОЦ. По данным МЗ Украины, у 25–50 % женщин, которые перенесли ОЦ, развивается его рецидив в течение года [1].
Большинство рецидивов возникают в первые 3 месяца после излечения предшествующего эпизода. Более 60 % случаев острого неосложненного цистита остается без должного лечения. В случае самопроизвольного излечения неосложненного цистита заболевание рецидивирует в течение года почти у половины женщин [2].
Ранее проблему хронического цистита связывали исключительно с ростом устойчивости уропатогенных штаммов E.coli (возбудитель в 85–95 % случаев) к антибактериальным препаратам, которые традиционно широко назначают при инфекциях мочевыводящих путей. Очень часто уровень резистентности к некоторым средствам антибактериальной терапии достигает 30–50 % [3].
При этом все больше внимания в последнее время исследователями уделяется роли уротелия в патогенезе хронизации цистита. Слизистая оболочка мочевого пузыря обладает бактериостатической активностью, особенно по отношению к кишечной палочке, благодаря выработке специфических мукополисахаридов и секреторного IgA, а неповрежденный уротелий обладает значительной фагоцитарной активностью [2]. Однако нарушение уродинамики, снижение неспецифической и специфической иммунной защиты, бесконтрольное использование антибиотиков приводят к образованию бактериальных пленок на слизистой мочевого пузыря [4], а также внутриклеточных бактериальных сообществ (intracellular bacterial communities), которые располагаются в эпителии под биопленкой. Последние являются важнейшей причиной рецидивов острого цистита и трудно поддаются антибактериальной терапии, так как для достижения эффекта требуется концентрация антибиотиков, в 1000–1500 раз превышающая эффективную для планктонной формы возбудителя [5].
Проблема хронической инфекции, рецидивов цистита и резистентности возбудителя требует новых решений. Одним из предложенных вариантов стала фотодинамическая терапия [6]. Изучались различные фотосенсибилизирующие агенты — от йодида калия до метиленового синего [7]. Веществом с наиболее активным проникновением в толщу уротелия, бактериальных пленок и внутриклеточные бактериальные сообщества был признан метилтиониния хлорид (МТХ) [8, 9]. Это производное фенотиазина относится к списку жизненно важных препаратов ВОЗ при лечении метгемоглобинемии благодаря мощнейшему восстановительному действию (способности отдавать электроны). Бактерицидное и уросептическое действие МТХ, как и возможность применения при малярии, были известны достаточно давно. Анализировался опыт применения метиленового синего при септическом шоке в «Медлайн» и Кокрановской базе данных. Данных для выявления влияния на прогноз было недостаточно, но было отмечено достоверное повышение системного артериального давления, снижение потребности в вазоконстрикторах [10].
Причиной активного изучения МТХ в урологии в XXI веке стали его восстановительные свойства, а также выдающаяся способность проникновения в глубокие слои эпителиальной ткани. В последнее время все активнее используется фотосенсибилизирующий потенциал метилтиониния в урологии при фотодинамической терапии с лазерным излучением для лечения онкологических заболеваний, когда отличия окрашивания здоровой и атипичной ткани позволяют лазерному излучению с филигранной точностью нейтрализовать опухолевые клетки.
Фотодинамическая терапия с применением МТХ позволяет убирать биопленки с Pseudomonas aeruginosa, что показано в исследовании [11].
МТХ оказывает прямое ингибирующее влияние на формирование и рост биопленок Candida albicans, что показано в исследовании 2018 г. Особенностью данного исследования стало подтверждение действия МТХ без дополнительного облучения лазером [12].
Одними из первых информацию о наличии бактерицидного действия МТХ без лазерного облучения опубликовали в 2001 г. исследователи из Миннесоты [13].
Бактерицидный эффект без наличия лазерного облучения в 2006 г. подтвердила исследовательская группа проф. Nikolaos S. Soukos из Массачусетса [14]. Выводы исследователя («Гидрофильные свойства МТХ, малый молекулярный вес и положительный заряд позволяют ему проникать через порин-протеиновые каналы внешней мембраны грамнегативных бактерий. МТХ взаимодействует преимущественно с отрицательно заряженными макромолекулами полисахаридов, образует димерные соединения, которые и применяются в процессе фотосенсибилизации») звучат чрезвычайно актуально для практических врачей-урологов, так как именно грамнегативная E.coli продолжает оставаться основной причиной цистита.
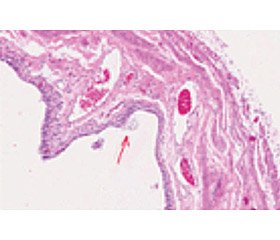
Упомянутая выше способность МТХ проникать в эпителий и уничтожать биопленки Candida albicans изучена проф. Ying-Ying Huang [7]. Эта работа опубликована в 2018 г. с выводами о том, что данная процедура лечения инфекций мочевыводящих путей без использования антибиотиков может иметь клиническое применение либо в качестве самостоятельной терапии, либо в качестве дополнения к антибиотикотерапии. На рис. 1 показаны внутриклеточные бактериальные ассоциации, а также повреждения уротелия. Таким образом, в экспериментальной модели цистита доказана способность МТХ разрушать бактериальные пленки и облегчать экстернализацию — устранять возбудителя, находящегося в глубоких слоях переходного эпителия мочевого пузыря.
Следует сказать о важности биопленок в патогенезе катетер-ассоциированных инфекций мочевыводящих путей. Катетеры в мочевом пузыре повреждают уротелий, увеличивая количество зон для связи с бактериальными адгезинами, повышается объем остаточной мочи за счет ее скопления ниже просвета катетера, биопленки формируются уже на 1–3-й день стояния катетера и в последующем достигают мочевого пузыря. Исходно биопленки состоят из монослоя микроорганизмов, но в дальнейшем они становятся полимикробными, особенно при длительной катетеризации. Сформированная биопленка защищает микроорганизмы от действия антибиотиков: бактерии в биопленке обычно выживают при содержании антимикробных агентов в концентрации, в 1000–1500 раз превышающей бактерицидную концентрацию для планктонных форм этих же микроорганизмов. Это объясняется: 1) присутствием защитного слоя экзополисахаридов, составляющего основу биопленки (микроорганизмы могут составлять 10–25 % биопленки, и 75–90 % таковой составляет матрикс из полисахаридов); 2) большой изменчивостью микроорганизмов внутри пленки (обмен генетическим материалом между микроорганизмами в пределах биопленки выше, чем у планктонных форм, поэтому гены антибактериальной резистентности и факторов вирулентности распространяются быстрее); 3) формированием внутри поверхностных клеток уротелия мочевого пузыря так называемых внутриклеточных бактериальных сообществ (intracellular bacterial communities), защищенных биопленкой. Они представляют проблему для клиницистов, так как выдерживают 3–10 дней антибиотикотерапии и заставляют искать средства для экстернализации (изгнания) возбудителей из толщи уротелия.
На мировом рынке уже присутствует несколько комбинированных средств для лечения острого цистита и профилактики его рецидивов с МТХ. Исследование одного из таких средств было опубликовано в 2008 г. [15] и продемонстрировало, что МТХ достоверно уменьшал частоту рецидивов цистита через 3 и 6 месяцев. В Украине МТХ доступен в составе комбинированного средства Пембина-Блю, в котором метилтиониний дополнен растительными экстрактами.
Исследования бактерицидной активности МТХ показали необходимость сравнительно невысокой концентрации МТХ в жидкости для прекращения роста как патогенных бактерий [16], так и грибов Candida albicans [17].
Такое уникальное сочетание трех свойств — глубоко проникать в эпителий, разрушать биопленку и демонстрировать бактерицидный эффект — заставляет обратить пристальное внимание на препараты с МТХ для лечения основных симптомов цистита: дизурии, боли при мочеиспускании — и снижения риска рецидивов.
1. Уніфікований клінічний протокол медичної допомоги. 2011.
2. Стрельцова О.С., Крупин В.Н. Хронический цистит: новое в диагностике и лечении. Лечащий врач. 2008. № 7.
3. Гурженко Ю.Н., Бойко А.И., Шамраев С.Н. и др. Исследование эффективности использования препарата Диурол в комплексном лечении больных хроническим циститом. Семейная медицина. 2015. № 1.
4. Берестенко С.В. Эффективность антисептика Декасан в комплексном лечении больных с обострением хронического цистита. Здоровье мужчины. 2012. № 2.
5. Tenke P., Koves B., Nagy K. et al. Biofilm and Urogenital Infections. Clinical Management of Complicated Urinary Tract Infection. 2011.
6. Cieplik F., Deng D., Crielaard W. et al. Antimicrobial photodynamic therapy — what we know and what we don’t. Critical Reviews in Microbiology. 2018. Vol. 44. Issue 5.
7. Huang Y.-Y., Wintner A., Seed P.C. et al. Antimicrobial photodynamic therapy mediated by methylene blue and potassium iodide to treat urinary tract infection in a female rat model. Sci Rep. 2018 May 8. 8 (1). 7257.
8. Rineh A., Bremner J.B., Hamblin M.R. et al. Attaching NorA efflux pump inhibitors to methylene blue enhances antimicrobial photodynamic inactivation of Escherichia coli and Acinetobacter baumannii in vitro and in vivo. Bioorg. Med. Chem. Lett. 2018 Sep 1. 28 (16). 2736-2740.
9. Monteiro J.S., de Oliveira S.C., Pires Santos G.M. et al. Effectiveness of antimicrobial photodynamic therapy (AmPDT) on Staphylococcus aureus using phenothiazine compound with red laser. Lasers Med. Sci. 2017 Jan. 32 (1). 29-34.
10. Kwok E.S., Howes D. Use of methylene blue in sepsis: a systematic review. J. Intensive Care Med. 2006 Nov-Dec. 21 (6). 359-63.
11. Wainwright M., Phoenix D.A., Nickson P.B, Morton G. The Use of New Methylene Blue in Pseudomonas aeruginosa Biofilm Destruction. Biofouling. 2002. 18 (4). 247-249.
12. Rahul P., Moiz А., Venkata S., Shrayanee D. Nonphotodynamic Roles of Methylene Blue: Display of Distinct Antimycobacterial and Anticandidal Mode of Actions. Journal of Pathogens. 2018. 13.
13. Usacheva M.N. Comparison of the Methylene Blue and Toluidine Blue. Lasers in Surgery and Medicine. 2001. 29 (2).
165-73.
14. Soukos N.S., Chen P.S., Morris J.T. et al. Photodynamic Therapy for Endodontic Disinfection. J. Endod. 2006 Oct. 32 (10). 979-84.
15. Geller M., Gama C.R.B., Guimarães O.R., Varella R.B. Recurrent urinary tract infections: Evaluation of the prophylactic efficacy of urinary antiseptics methenamine and methylthioninium chloride. Revista Brasileira de Medicina. 2008 Nov. 65. 367-371.
16. Shatti Z.A., Authman S.H. Effect of methylene blue on the growth of bacteria isolated from patients with Atopic Dermatitis. 2015.
17. Ansari M.A., Zeeshan F., Saif H. Antifungal Action of Methylene Blue Involves Mitochondrial Dysfunction and Disruption of Redox and Membrane Homeostasis in C. albicans. The Open Microbiology Journal. 2016. 10. 12-22.

/39-1.jpg)
/39-2.jpg)