Резюме
Актуальність. Спонтанне відновлення неврологічних функцій після інсульту пояснюється феноменом діашизу й пов’язане з реорганізацією в моторних та премоторних ділянках кори головного мозку. Однак на сьогодні опубліковано недостатньо проспективних когортних досліджень, у яких наведено та проаналізовано клініко-нейровізуалізаційні характеристики перехресно-мозочкового діашизу в пацієнтів iз гострим ішемічним інсультом. Мета дослідження: визначення особливостей клінічних проявів перехресно-мозочкового діашизу в пацієнтів iз гострим ішемічним інсультом та підвищення ефективності його діагностики шляхом зіставлення отриманих даних з результатами магнітно-резонансної томографії. Матеріали та методи. Ми провели проспективне госпітальне когортне дослідження пацієнтiв iз гострим ішемічним інсультом (n = 124), які були госпіталізовані у відділення цереброваскулярних захворювань Олександрівської клінічної лікарні м. Київа протягом перших 24 годин з моменту розвитку інсульту. Усі пацієнти пройшли комплексне клініко-неврологічне, лабораторне, ультразвукове і нейровізуалізаційне обстеження. Результати. Серед 124 хворих iз гострим ішемічним інсультом перехресно-мозочковий діашиз був діагностований у 5 (4,03 %) пацієнтів. Ми проаналізували патофізіологічні, анатомічні та клініко-нейровізуалізаційні особливості перехресно-мозочкового діашиза в пацієнтів iз гострим ішемічним інсультом. Висновки. Семіотика гострого інсульту визначається не тільки первинним інфарктом мозочку, а й діашизом, що обумовлює більш серйозний неврологічний дефіцит. Перехресно-мозочковий діашиз асоціюється не тільки з характерними симптомами ураження мозочку, але й парезом кінцівок, порушеннями чутливості та вищих функцій мозку.
Актуальность. Спонтанное восстановление неврологических функций после инсульта объясняется феноменом диашиза и связано с реорганизацией в моторных и премоторных участках коры головного мозга. Однако в настоящее время опубликовано недостаточно проспективных когортных исследований, в которых представлены и проанализированы клинико-нейровизуализационные характеристики перекрестно-мозжечкового диашиза у пациентов с острым ишемическим инсультом. Цель исследования: определение особенностей клинических проявлений перекрестно-мозжечкового диашиза у пациентов с острым ишемическим инсультом и повышение эффективности его диагностики путем сопоставления полученных данных с результатами магнитно-резонансной томографии. Материалы и методы. Мы провели проспективное госпитальное когортное исследование пациентов с острым ишемическим инсультом (n = 124), госпитализированных в отделение цереброваскулярных заболеваний Александровской клинической больницы г. Киева в течение первых 24 часов после развития инсульта. Все пациенты прошли комплексное клинико-неврологическое, лабораторное, ультразвуковое и нейровизуализационное обследование. Результаты. Среди 124 больных с острым ишемическим инсультом перекрестно-мозжечковый диашиз был диагностирован у 5 (4,03 %) пациентов. Мы проанализировали патофизиологические, анатомические и клинико-нейровизуализационные особенности перекрестно-мозжечкового диашиза у пациентов с острым ишемическим инсультом. Выводы. Семиотика острого инсульта определяется не только первичным инфарктом мозжечка, но и диашизом, что обусловливает более серьезный неврологический дефицит. Перекрестно-мозжечковый диашиз ассоциируется не только с характерными симптомами поражения мозжечка, но и с парезом конечностей, нарушениями чувствительности и высших функций мозга.
Background. Stroke represents a high-risk condition for long-term disability and death. The role of diaschisis in the severity of acute neurological deficit and spontaneous stroke recovery is significant. However, currently there are not enough published prospective, hospital-based, cohort studies that report and analyze clinical characteristics of crossed cerebellar diaschisis in acute stroke patients. Moreover, modern stroke treatment may change clinical representation of diaschisis. The purpose of this study is to determine the features of the clinical manifestations of crossed cerebellar diaschisis after acute cerebral stroke and to improve the efficiency of its diagnosis by comparing the obtained data with the results of the magnetic resonance imaging findings. Materials and methods. We prospectively recruited 124 acute stroke patients, who were admitted to a single department of the academic tertiary care hospital in Kyiv, Ukraine. The primary outcome was the combined incidence of stroke and diaschisis. In the secondary analyses, we studied pathophysiological, anatomical, and clinical features specific to crossed cerebellar diaschisis in a cohort of acute stroke patients with diaschisis. Results. Among 124 selected acute stroke patients admitted to the department, 42 (33.9 %) persons were diagnosed with different forms of diaschisis: cerebrospinal (n = 22), commissural (n = 4), crossed cerebellar (n = 5), crossed cerebellar-hemispheric (n = 6), crossed and ponto-cerebellar diaschisis (n = 5). We have conducted a detailed pathophysiological and clinical analysis of crossed cerebellar diaschisis in acute ischemic stroke patients, described clinical manifestations of crossed cerebellar diaschisis. Utilizing the von Monakow theory of diaschisis, we found a scientific explanation for the pathophysiology of clinical manifestations of that remote form of diaschisis. Conclusions. results of this study showed that cerebellar infarction is associated not only with typical symptoms of cerebellar lesion, but also with paresis, disturbances of sensitivity, and higher mental functions. Further study of the issues addressed in this article will help to improve the diagnosis and management of patients with acute cerebellar stroke.
Introduction
Stroke is the second leading global cause of death behind heart disease, accounting for 11.8 % of total deaths worldwide [1–5]. Each year, about 795,000 people experience a new or recurrent stroke [6–9]. Approximately 610,000 of these are first-time attacks, and 185,000 are recurrent attacks [10–15]. In 2013, worldwide prevalence of stroke was 25.7 million, with 10.3 million people having a first stroke [16–22].
For decades, the concept of diaschisis coined by von Monakow in 1914 to describe the neurophysiological changes that occur distant to a focal brain lesion was placed at the center of the understanding of brain function [23–29]. Until the late 1970s, this concept triggered widespread clinical interest to describe symptoms and signs which primary stroke lesion could not fully explain [30]. However, after the first imaging studies that only partially confirmed the clinical significance of diaschisis, the concept of diaschisis became neglected and subsequently disappeared from mainstream research in clinical neuroscience [31].
The development of new imaging techniques allows a clear visualization and deeper understanding of structural and functional connectivity between brain areas which are distant to the primary lesion. These techniques have consequently revitalized the concept of diaschisis. Presently, one of the most promising techniques is neuromodulation utilizing transcranial magnetic stimulation. Once this last technique becomes successful, the concept of diaschisis will regain all the clinical respectability that was unobtainable during decades of research.
Remote diaschisis focusing on specific networks seems to relate more consistently to the clinical findings, especially after stroke in the motor and attentional networks. Norma–lization of remote connectivity changes in these networks is associated with better recovery [26]. Therefore, neurophysiological changes distant to the lesion should be the target of therapeutic strategies, and specific clinical characteristics of diaschisis should be well understood and promptly recognized by clinicians.
The purpose was to conduct a prospective hospital-based cohort study in acute stroke patients in order to analyze clinical features of all forms of distant diaschisis in modern treatment.
Materials and methods
The materials and methods of this study have been reported in detail previously [32, 33]. We have conducted a prospective, hospital-based, cohort study of patients with newly diagnosed acute ischemic stroke (n = 124) who were admitted to the department of cerebrovascular diseases of the University hospital (Oleksandrivska Clinical Hospital, Kyiv, Ukraine) within the first 24 hours after the stroke occurred. All cases were reviewed by at least two board-certified neurologists trained in cerebrovascular diseases.
All participants underwent standardized examination to obtain: clinical history, 12-lead electrocardiogram, blood testing (blood chemistry, thyroid, renal, and hepatic function, complete blood count, serum glucose, coagulation studies), carotid Doppler ultrasound (carotid duplex (Multigon 500M, USA) or carotid triplex (Aloka SSD-4000, Japan)), computed tomography of the head (Toshiba Activion 16 Multislice CT system, Nasu, Japan) and 1.5T brain magnetic resonance imaging (MRI), magnetic resonance angiography (Vantage MRI System, Japan) within 24–72 hours after the onset of symptoms and in dyna–mics during the period of maximum severity of symptoms. A chest radiograph was done if pulmonary disease or heart failure was suspected.
Stroke was defined according to criteria of the World Health Organization, American Heart Association/American Stroke Association guidelines for adult stroke and was confirmed by neuroimaging [34, 35]. The etiology of stroke was classified according to the TOAST (trial of ORG 10172 in acute stroke treatment) criteria [36]. The National Institutes of Health Stroke Scale, modified Rankin scale, Barthel index were used in all participants based on the data available upon admission and in their respective medical records. Secondary stroke prevention was prescribed according to the American Heart Association/American Stroke Association and the European Stroke Organisation guidelines, immediately after the stroke diagnosis was made [36–44].
Parametric and non-parametric univariate analyses were performed with χ2, Fisher’s exact, Mann-Whitney U, and Student t tests, as appropriate. The log-rank test was used for univariate comparisons of event-free survival between groups. A two-sided p < 0.05 was considered significant for all analyses. All statistical analyses were performed using IBM SPSS Statistics Version 22 (IBM, Armonk, NY).
Results and discussion
In total, 124 patients aged 28 to 84 years with acute ischemic stroke were screened. The localization of primary stroke lesion confirmed by neuroimaging was as follows: cerebral hemispheres (n = 68), brainstem (n = 11), cerebellum (n = 45).
Among the 124 patients, 42 persons (22 men and 20 women) were diagnosed with remote diaschisis. These 42 patients had a mean age of 60.8 ± 12.5 years (from 32 to 84 years). The localization of primary brain lesion in the study group was as follows: brain hemisphere (n = 31), pons Varolii (n = 5), cerebellar hemisphere (n = 6).
Based on the localization of primary brain lesion and considering secondary dysfunction of brain neighboring structures, we have analyzed and described clinical manifestations and characteristics of the following forms of remote diaschisis: cerebrospinal (n = 22), commissural (n = 4), crossed cerebellar (n = 5), crossed cerebellar-hemispheric (n = 6), and ponto-cerebellar diaschisis (n = 5). Clinical features of cerebrospinal and commissural diaschisis were analyzed in detail in our previous publications [33]. This article deals with the analysis of clinical manifestation and course of crossed cerebellar diaschisis.
Crossed cerebellar diaschisis was detected in 5 patients. It arose with an acute hemispheric territorial infarction. The localization of the primary stroke lesion was as follows: cortex of frontoparietal lobe (n = 4), inner capsule and basal ganglia (n = 1). The clinical manifestation of stroke was determined not only by the localization of primary stroke lesion and its size, but also by the MRI-proved ischemic focus (diaschisis) in the contralateral cerebellar hemisphere.
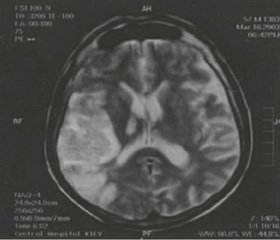
Synchronous or sequential diaschisis (acute ischemic injury of structures that are anatomically and functionally connected, but remote to the primary brain lesion) caused more severe neurological deficit compared to that expected from the primary brain lesion. Clinically, patients were diagnosed with hemiparesis and hemihypesthesia on the side opposite to the primary brain lesion. Diaschisis was manifested clinically with the symptoms of hemiataxia in these patients. For illustration, we present a clinical case of patient E., who has developed regional ischemic stroke with hemorrhagic transformation (Fig. 1).
/7-1.jpg)
Neurological deficit in crossed cerebellar diaschisis composed a syndrome of motor and ataxic hemiparesis — hemiparesis-hemiataxia. The main mechanism of its occurrence is damage at the level of the first corticopontine neuron of the cortico-cerebellar path, which causes the dissociation of its parts and dissolution. This results in deactivation of the afferent impulses from the brain lesion in the cerebral hemisphere to the cross-pontine-cerebellar path in the pons. Because of this deactivation, the function of the pathway returns to the phylogenetically lower level (Fig. 2).
/7-2.jpg)
Damage of the corticopontine neuron (i.e., ischemic damage (diaschisis)) at the level of different parts of the cerebral cortex (mainly, in frontal or parietal lobe of brain hemisphere) led to the deactivation of afferent impulses to the cross-pontine-cerebellar pathway in the pons. This deactivation causes a decrease in blood flow and metabolic depression in cerebellar hemisphere opposite to the stroke brain lesion (i.e., opposite to the brain hemisphere with the primary damage). Contralateral hypoperfusion in the cere-bellum was detected in 58 % of patients with hemispheric stroke [26].
Conclusions
Isolated cerebellar infarctions often cause crossed cerebellar-hemispheric diaschisis in the contralateral cortex of the frontal or frontoparietal lobe of the brain accompanied by structural and morphological findings on MRI in 87.5 % of observations. Neurologists should know that cerebellar stroke can manifest not only in typical symptoms of cerebellar dysfunction (dizziness, disorders of static and coordination, dysmetria, intentional tremor, nystagmus, dysarthria), but also in the remote symptoms such as paresis of limbs, impaired sensitivity and mental functions caused by a cross-hemispheric diaschisis.
Conflicts of interests. Authors declare no conflicts of interests that might be construed to influence the results or interpretation of their manuscript.
Author contributions
S.M. Vinychuk — study concept and design, interpretation of data, data acquisition; O.Ye. Fartushna — article concept and design, literature overview, data acquisition, interpretation of data, and drafting the article.
Список литературы
1. Feigin V.L. Global and regional burden of stroke during 1990–2010: findings from the Global Burden of Disease Study 2010 / V.L. Feigin, M.H. Forouzanfar, R. Krishnamurthi [et al.] // The Lancet. — 2014. — Vol. 383(9913). — P. 245-254.
2. Mackay J. The atlas of heart disease and stroke / J. Mackay, G.A. Mensah. — Geneva: World Health Organization and Center for Disease Control and Рrevention, 2004. — 112 p.
3. Benjamin E.J. On behalf of the American Heart Association Council on Epidemiology and Prevention Statistics Committee and Stroke Statistics Subcommittee. Heart disease and stroke statistics — 2018 update: a report from the American Heart Association / E.J. Benjamin, S.S. Virani, C.W. Callaway [et al.] // Circulation. — 2018. — Vol. 137(12). — P. e67-e492.
4. Thrift A.G. Global stroke statistics / A.G. Thrift, T. Thayabaranathan, G. Howard [et al.] // International Journal of Stroke. — 2017. — № 12(1). — P. 13-32.
5. Віничук С.М. Гострий ішемічний інсульт / С.М. Віничук, М.М. Прокопів. — К.: Наукова думка, 2006. — 286 с.
6. World Stroke Organization. Facts and Figures about Stroke. — Режим доступу: http://www.world-stroke.org/component/content/article/16-forpatients/84-facts-and-figures-about-stroke
7. Snow S.J. Stroke and t-PA — triggering new paradigms of care / S.J. Snow // The New England Journal of Medicine. — 2016. — № 374(9). — Р. 809.
8. Евтушенко С.К. Новые факторы риска развития инсульта у лиц молодого возраста / С.К. Евтушенко, Д.А. Филимонов, И.С. Евтушенко // Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуск. — 2015. — Т. 115, № 12. — С. 3-12.
9. Фартушна О.Є. Виявлення та усунення васкулярних чинників ризику — важливий напрямок первинної профілактики транзиторних ішемічних атак та/чи інсульту / О.Є. Фартушна, С.М. Віничук // Український медичний часопис. — 2015. — № 1(105). — С. 23-27.
10. Benjamin E.J. Оn behalf of the American Heart Association Statistics Committee and Stroke Statistics Subcommittee. Heart dise-ase and stroke statistics — 2017 update: a report from the American Heart Association / E.J. Benjamin, M.J. Blaha, S.E. Chiuve [et al.] // Circulation. — 2017. — № 135. — Р. 229-445.
11. Feigin V.L. Global burden of stroke / V.L. Feigin, B. Nor–rving, G.A. Mensah // Circulation Research. — 2017. — № 120(3). — Р. 439-448.
12. Wilkins E. European cardiovascular disease statistics 2017 / Е. Wilkins, L. Wilson, K. Wickramasinghe [et al.]. — Brussels: European Heart Network, 2017. — 188 p.
13. Lees R. Vascular cognitive impairment/vascular dementia. The pattern of cognitive impairment in stroke survivors with carotid stenosis / R. Lees, F. McGrane, O. Fartushna, N.M. Broomfield, T.J. Quinn, K. Dani, K. Forbes, J. Dawson // International Journal of Stroke. — 2014. — № 9. — P. 323-324.
14. Віничук С.М. Рання реабілітація після гострих ішемічних порушень мозкового кровообігу / С.М. Віничук, О.Є. Фартушна // Міжнародний неврологічний журнал. — 2016. — № 8(86). — С. 34-39.
15. Фартушна О.Є. Актуальність проблеми цереброваскулярних захворювань, транзиторних ішемічних атак та вдосконалення їх діагностики в системі охорони здоров’я в Україні / О.Є. Фартушна, М.М. Прокопів // Проблеми військової охорони праці: Зб. наук. праць Української військово-медичної академії / За ред. проф. В.Я. Білого. — К.: УВМА, 2007. — Вип. 19. — С. 335-342.
16. GBD 2016 Causes of Death Collaborators. Global, regio–nal, and national age-sex specific mortality for 264 causes of death, 1980–2016: a systematic analysis for the Global Burden of Disease Study 2016 // The Lancet. — 2017. — № 390(10100). — Р. 1151-1210.
17. Wang H. Global, regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death, 1980–2015: a systematic analysis for the Global Burden of Disease Study 2015 / H. Wang, M. Naghavi, C. Allen [et al.] // The Lancet. — 2016. — № 388(10053). — P. 1459-1544.
18. Fartushna O.Y. Emergency therapeutic approach as a secon–dary prevention of an acute ischemic stroke in patients with TIA / Fartushna O.Y. // XX World Neurological Congress, 12–17.11.2011. — Marrakesh, Morocco, 2011. — P. 167.
19. Фартушна О.Є. Транзиторні ішемічні атаки / О.Є. Фартушна, С.М. Віничук. — К.: ВД «Авіцена», 2014. — 216 с.
20. Фартушна О.Є. Модифікація поведінкових чинників ризику як складова первинної профілактики транзиторних ішемічних атак та/чи інсульту / О.Є. Фартушна, С.М. Віничук // Український медичний часопис. — 2014. — № 6(104) — XІ/XІІ. — С. 42-44.
21. Фартушна О.Є. Епідеміологія транзиторних ішемічних атак в структурі гострих порушень мозкового кровообігу в Україні та інших країнах / О.Є. Фартушна, С.М. Віничук // Міжнародний неврологічний журнал. — 2017. — № 5(91). — С. 105-111.
22. Фартушна О.Є. Патогенетичні підтипи транзиторних ішемічних атак: особливості неврологічної клініки, гемодинаміки та лікування [Текст]: Дис... канд. мед. наук: 14.01.15 / Фартушна Олена Євгенівна; Нац. мед. ун-т ім. О.О. Богомольця. — К., 2012. — 217 арк.: рис., табл. — Бібліогр.: арк. 187-217.
23. Jagella C. 100 Jahre Neurologie an der Universität Zürich 1894 bis 1994 — Constantin von Monakow (1853 bis 1930) / C. Jagella, H. Isler, K. Hess // Schweizer Archiv fur Neurologie und Psychiatrie. — 1994. — Vol. 145 (suppl. 1). — P. 1-61.
24. Seitz R.J. The role of diaschisis in stroke recovery / R.J. Seitz, N.P. Azari, U. Knorr [et al.] // Stroke. — 1999 Sep. — № 30(9). — P. 1844-50.
25. Monakow von C. Die Lokalisation im Grosshirm und der Ablau der Function dürch korticale Herde / Monakow von C. — Wiesbaden: J.F. Bergmann, 1914. — 1033 s.
26. Виничук С.М. Диашиз при мозговом инсульте. — К.: ОЖИВА, 2017. — 64 c.
27. Vinychuk S.M. Diaschisis: brief historical review / S.M. Vinychuk, O.Ye. Fartushna // International Neurological Journal. — 2018. — № 4(98). — С. 11-16.
28. Віничук С.М. Історія Київської неврологічної школи / С.М. Віничук, О.Є. Фартушна. — К.: Едванс-Прінт, 2015. — 55 с.
29. Carrera E. Diaschisis: past, present, future / E. Carrera, G. Tononi // Brain. — 1911. — Vol. 137(9). — P. 2408-2422.
30. Engelhardt E. Shock, diaschisis and von Monakow / E. Engelhardt, M.M. Gomes // Arq. Neuropsiquiatr. — 2013. — Vol. 71. — P. 487-489.
31. Finger S. The von Monakow concept of diaschisis: origins and perspectives / S. Finger, P.J. Koehler, C. Jagella // Archiv Neurologie. — 2004. — Vol. 61. — P. 283-288.
32. Виничук С.М. Диашиз и его роль в развитии рефлекторно-двигательных расстройств при мозговом инсульте // Український медичний часопис. — 2013. — № 2. — С. 143-147.
33. Vinychuk S.M. Cerebrospinal and commissural diaschisis in acute stroke patients: case analysis / S.M. Vinychuk, O.Ye. Fartushna // International Neurological Journal. — 2018. — № 5(99).
34. Kernan W.N. Guidelines for the prevention of stroke in patients with stroke and transient ischemic attack: a guideline for healthcare professionals from the American Heart Association/American Stroke Association / W.N. Kernan, B. Ovbiagele, H.R. Black [et al.] // Stroke. — 2014. — № 45. — Р. 2160-2236.
35. Aho K. Cerebrovascular disease in the community: results of a WHO collaborative study / K. Aho, P. Harmsen, S. Ha-tano [et al.] // Bull. World Health Organ. — 1980. — № 58. — P. 113-130.
36. Adams H.P. Classification of subtype of acute ischemic stroke. Definitions for use in a multicenter clinical trial. TOAST. Trial of Org 10172 in Acute Stroke Treatment / H.P. Adams, B. H. Bendixen, L.J. Kappelle [et al.] // Stroke. — 1993. — № 24. — P. 35-41.
37. Sacco R.L. Guidelines for prevention of stroke in patients with ischemic stroke or transient ischemic attack: a statement for healthcare professionals from the American Heart Association/American Stroke Association Council on Stroke: co-sponsored by the Council on Cardiovascular Radiology and Intervention: the American Academy of Neurology affirms the value of this guideline / R.L. Sacco, R. Adams, G. Albers [et al.] // Stroke. — 2006. — № 37. — P. 577- 617.
38. Ringleb P. European Stroke Organisation 2008 guidelines for managing acute cerebral infarction or transient ischemic attack. Part 1 / P. Ringleb, P.D. Schellinger, W. Hacke [et al.] // Der Nervenarzt. — 2008. — № 79. — P. 936-957.
39. Fartushnaya E.E. Reducing the risk of recurrent ischemic stroke, after transient ischaemic attack along with neuroproteсtivе and antiaggregant therapy / E.E. Fartushnaya, S.M. Vinichuk // XIV International Congress of Rehabilitation Medicine and Immunorehabilitation, 16–21.10. 2009: Abstract. — Tel-Aviv, Israel, 2009. — Р. 67.
40. Fartushna O.Ye. Brain injury in patients with acute TIA: clinical features in different TIA subtypes / O.Ye. Fartushna, S.M. Vinychuk // International Neurological Journal. — 2017. — № 3(89). — P. 13-18.
41. Віничук С.М. Аторвастатин та його роль у профілактиці та лікуванні ішемічних порушень мозкового кровообігу / С.М. Віничук, О.Є. Фартушна // Здоров’я України. — 2015. — № 9. — С. 3.
42. Фартушна О.Є. Використання оптимальної дози препарату Торвакард — важливий напрямок зниження ризику розвитку повторних транзиторних ішемічних атак та/чи інсульту / О.Є. Фартушна, С.М. Віничук // Семейная медицина. — 2015. — № 3. — С. 223-227.
43. Віничук С.М. Диференційоване лікування транзиторних ішемічних атак — ефективний спосіб профілактики повторних гострих церебральних подій / С.М. Віничук, О.Є. Фартушна // Міжнародний неврологічний журнал. — 2014. — № 6. — С. 87-92. — Режим доступу: http://nbuv.gov.ua/UJRN/Mnzh_2014_6_15
44. Віничук С.М. Освітні програми профілактики транзиторних ішемічних атак та/чи інсульту / С.М. Віничук, О.Є. Фартушна // Укр. мед. часопис. — 2014. — № 5. — С. 49-51.

/7-1.jpg)
/7-2.jpg)