Резюме
Актуальність. Частота травми периферійних нервів становить 0,3–0,5 на 10 000 населення, 60–75 % з яких супроводжуються інвалідизацією хворого. Найперспективнішим шляхом вирішення проблеми відновлення периферичних нервів є тканинна інженерія з використанням біополімерів і стовбурових клітин, зокрема мультипотентних стовбурових клітин-похідних нервового гребеня (МСК-ПНГ). Мета: дослідити відновлення функції сідничного нерва з використанням засобів тканинної інженерії після його повного перетину в експерименті. Матеріали та методи. Сформовано 4 експериментальні групи: група 1 — перетин сідничного нерва (невротомія) та негайна автонейропластика (n = 14); група 2 — невротомія та негайна пластика колагеновою трубкою, заповненою фібриновим гелем (n = 15); група 3 — невротомія та негайна пластика колагеновою трубкою, заповненою фібриновим гелем з вмістом МСК-ПНГ (n = 16); група 4 — несправжньооперовані тварини (n = 7). Результати. У групах 1 і 3 спостерігали динаміку SFI, що характеризувалася двофазністю. Перша фаза включала практично лінійне зростання показника від значення у –70 на 7-му добу спостереження до –35 станом на кінець 4-го тижня спостереження. Друга фаза тривала протягом 6–7-го та 5–7-го тижня у групі 1 та 3 відповідно і характеризувалася відсутністю змін показника. Для групи 2 характерним була наявність фази відсутності приросту показника протягом 2-го тижня спостереження. У подальшому, протягом 3–4-го тижня виявляли вірогідне збільшення показника (р < 0,01; W-критерій Уїлкоксона), стабілізацію (протягом 5–6-го тижня), вірогідне збільшення показника протягом 7-го тижня (р = 0,036 порівняно зі значенням станом на 5-й тиждень спостереження; W-критерій Уїлкоксона). Протягом усього періоду спостереження між значеннями SFI груп 1 та 3 вірогідних відмінностей не виявлено (р > 0,05; U-тест Манна — Уїтні). Статистично значущі відмінності (р < 0,05; U-тест Манна — Уїтні) між показниками групи 1 та 2, а також групи 2 та 3 на користь груп 1 і 3 відповідно виявляли починаючи з 14-ї доби й до кінця експерименту. При порівнянні з результатами тестування тварин групи 4 показники груп 1, 2 і 3 виявилися вірогідно (р < 0,05; U-тест Манна — Уїтні) меншими протягом усього періоду експерименту. Висновки. Пластика дефекту периферичного нерва трубчатим імплантатом NeuraGenTM, заповненим фібриновим гелем із вмістом стовбурових клітин-похідних нервового гребеня, з точки зору відновлення стану м’язово-суглобового апарату паретичної кінцівки еквівалентне класичній автонейропластиці. Тривалість періоду регенераційного росту волокон травмованого нерва до моменту ініціації відновлення функції паретичної кінцівки суттєво залежить від тканинного оточення у зоні травматичного дефекту. Тривалість активного відновлення функції паретичної кінцівки за відтвореного варіанту травми обмежена першим місяцем, не залежить від специфіки тканинних процесів у зоні пластики дефекту нерва.
Актуальность. Частота травмы периферических нервов составляет 0,3–0,5 на 10 000 населения, 60–75 % из которых сопровождаются инвалидизацией больного. Наиболее перспективным путем решения проблемы восстановления периферических нервов является тканевая инженерия с использованием биополимеров и стволовых клеток, в частности мультипотентных стволовых клеток-производных нервного гребня (МСК-ПНГ). Цель: исследовать восстановление функции седалищного нерва с использованием средств тканевой инженерии после его полного пересечения в эксперименте. Материалы и методы. Сформированы 4 экспериментальные группы: группа 1 — пересечение седалищного нерва (невротомия) и немедленная аутонейропластика (n = 14); группа 2 — невротомия и немедленная пластика коллагеновой трубкой, заполненной фибриновым гелем (n = 15); группа 3 — невротомия и немедленная пластика коллагеновой трубкой, заполненной фибриновым гелем с содержанием МСК-ПНГ (n = 16); группа 4 — ложнооперированные животные (n = 7). Результаты. В группах 1 и 3 динамика SFI характеризировалась двуфазностью. Первая фаза включала практически линейное нарастание значения от –70 на 7-е сутки наблюдения до –35 состоянием на конец 4-й недели наблюдения. Вторая фаза длилась в течение 6–7-й и 5–7-й недель в группе 1 и 3 соответственно и характеризовалась отсутствием изменений значения SFI. Для группы 2 характерным было наличие фазы отсутствия прироста показателя в течение 2-й недели наблюдения. В дальнейшем, в течение 3–4-й недель наблюдали достоверное увеличение показателя (р < 0,01; W-критерий Уилкоксона), стабилизацию (на протяжении 5–6-й недели), достоверное увеличение показателя в течение 7-й недели (р = 0,036 по сравнению со значением на 5-ю неделю наблюдения; W-критерий Уилкоксона). На протяжении всего периода наблюдения между значениями SFI групп 1 и 3 достоверных различий не выявлено (р > 0,05; U-тест Манна — Уитни). Статистически значимые различия (р < 0,05; U-тест Манна — Уитни) между показателями групп 1 и 2, а также групп 2 и 3 в пользу групп 1 и 3 соответственно наблюдали начиная с 14-х суток и до конца эксперимента. При сравнении с результатами тестирования животных группы 4 показатели групп 1, 2 и 3 оказались достоверно (р < 0,05; U-тест Манна — Уитни) меньше на протяжении всего периода эксперимента. Выводы. Пластика дефекта периферического нерва трубчатым имплантатом NeuraGenTM, заполненным фибриновим гелем с наличием стволовых клеток-производных нервного гребня, с точки зрения восстановления состояния мышечно-суставного аппарата паретичной конечности эквивалентна классической аутонейропластике. Длительность периода регенерационного роста волокон травмированного нерва до момента инициации восстановления функции паретичной конечности существенно зависит от тканевого окружения в зоне травматического дефекта. Длительность активного восстановления функции паретичной конечности в данном варианте травмы ограничена первым месяцем, не зависит от специфики тканевых процессов в зоне пластики дефекта нерва.
Background. The incidence of peripheral nerve injuries is 0.3–0.5 per 10,000 in general population, 60–75 % of them are accompanied by invalidisation of the patient. The most promising way to solve the problem of restoring peripheral nerves is tissue engineering using biopolymers and stem cells, in particular neural crest derived multipotent stem cells. The aim of the study was to investigate the function of the sciatic nerve with the use of tissue engineering after its complete intersection in the experiment. Materials and methods. Four experimental groups were formed: group 1 — sciatic nerve transection (neurotomy) and immediate autoneuroplasty (n = 14); group 2 — neurotomy and immediate plasty with collagen tube filled with fibrin gel (n = 15); group 3 — neurotomy and immediate plasty with collagen tube filled with fibrin gel containing neural crest derived multipotent stem cells (n = 16); group 4 — sham operated animals (n = 7). Results. In groups 1 and 3, the dynamics of sciatic functional index (SFI) was characterized by two phases. The first phase included a practically linear increase in values, from –70 on day 7 of observation to –35 by the end of week 4. The second phase lasted for weeks 6–7 and 5–7 in groups 1 and 3, respectively, and was characterized by a lack of changes in the value of SFI. In group 2, there was a phase of absence of increment of the indicator during week 2 of observation. Subsequently, during week 3–4, there was a significant increase in the indicator (p < 0.01; Wilcoxon test); stabilization (during weeks 5–6); a significant increase in the index during week 7 (p = 0.036 in comparison with the value on week 5 of observation; Wilcoxon test). During the entire observation period, no significant differences were found between SFI values for groups 1 and 3 (p > 0.05, Mann-Whitney U test). Statistically significant differences (p < 0.05; Mann-Whitney U test) between groups 1 and 2, as well as groups 2 and 3, in favor of groups 1 and 3, respectively, ranged starting from day 14 and to the end of experiment. Compared with the results of testing animals in group 4, the indicators of groups 1, 2, and 3 turned out to be significantly (p < 0.05; Mann-Whitney U test) less during the whole period of the experiment. Conclusions. Plasty of the peripheral nerve defect by a NeuraGenTM tubular implant filled with fibrin gel containing multipotent neural crest derived stem cells, in terms of restoring the muscular-articular apparatus of the paretic limb, is equivalent to classical autoneuroplasty. The duration of the period of regenerative growth of the traumatic nerve fibers until the initiation of the restoration of paretic limb function substantially depends on the tissue environment in the area of the traumatic defect. The duration of active restoration of the function of the paretic limb in this type of the trauma is limited to the first month, not dependent on the specificity of tissue processes in the area of nerve defect plasty.
Вступ
Частота травми периферичних нервів становить 0,3–0,5 на 10 000 населення [1]. В Україні щорічно реєструють 2,5–3 тис. випадків травми периферичних нервів, з яких 60–75 % супроводжуються інвалідизацією хворого [2]. Середній вік пацієнтів (18–44 роки) та значна тривалість життя після отримання травми обумовлюють значну соціально-економічну важність проблеми відновлення функції травмованого нерва [3]. Незважаючи на значний технологічний прогрес, створення умов для інтенсивного росту перетнутих нервових волокон через зону травми нерва залишається актуальною проблемою. Одним із перспективних напрямків її вирішення є залучення методу тканинної інженерії [4, 5, 11].
Регенерацію травмованого нерва активно вивчають в умовах експерименту [7, 10]. За даними метааналізу 1500 наукових публікацій із цієї проблематики у межах бази даних PubMed, у 90 % випадків дослідження здійснено на моделі травми сідничного нерва щура [6–9], що обумовлено доступністю біологічного матеріалу, простотою відтворення, наявністю засобів кількісної оцінки функції нерва [6].
Важливим питанням тканинної інженерії є пошук доступного джерела автологічних стовбурових клітин, як перспективних кандидатів розглядають мультипотентні стовбурові клітини-похідні нервового гребеня (МСК-ПНГ), що містяться у бульбарному регіоні волосяного фолікула, мають здатність до нейрогенного диференціювання [12–14]. Нервовий гребінь — тимчасова структура, що утворюється під час нейруляції і дає початок широкому спектру клітин нейтрального та мезенхімного фенотипу [15]. У ряді досліджень встановлено позитивний вплив МСК-ПНГ на регенерацію травмованого сідничного нерва [15, 16].
Травма сідничного нерва супроводжується периферичним парезом м’язів стопи й зміною її просторової конфігурації; аналіз геометричних особливостей відбитка паретичної стопи щура є основою оцінки функції сідничного нерва [7]. У даній роботі наведено результати відновного нейроінженерного лікування травми сідничного нерва зрілого щура за участю МСК-ПНГ із застосуванням методу оцінки відбитка паретичної стопи.
Мета: дослідити відновлення функції сідничного нерва з використанням засобів тканинної інженерії після його повного перетину в експерименті.
Матеріали та методи
Дослідження виконано на 52 білих безпородних щурах-самцях (250 ± 25 г, 5–6 міс.), утримуваних у стандартних умовах віварію ДУ «Інститут нейрохірургії ім. акад. А.П. Ромоданова НАМН України» з дотриманням чинних норм біоетики (директива Ради ЄС 86/609/ЕЕС «Про наближення законів, підзаконних та адміністративних положень держав-членів про захист тварин, які використовуються для експериментальних та інших наукових цілей» (1986), Європейська конвенція про захист хребетних тварин, які використовуються для експериментальних та наукових цілей (1986), Закон України № 3447-IV «Про захист тварин від жорстокого поводження» (2006)). Протокол дослідження схвалено комітетом з біоетики ДУ «Інститут нейрохірургії ім. акад. А.П. Ромоданова НАМН України».
/13-1.jpg)
Сформовано 4 експериментальні групи: група 1 — перетин сідничного нерва (невротомія) та негайна автонейропластика (n = 14); група 2 — невротомія та негайна пластика колагеновою трубкою, заповненою фібриновим гелем (n = 15); група 3 — невротомія та негайна пластика колагеновою трубкою, заповненою фібриновим гелем з вмістом МСК-ПНГ (n = 16); група 4 — несправжньооперовані тварини (n = 7).
Мультипотентні стовбурові клітини-похідні нервового гребеня виділені методом експлантатів за Sieber-Blum et al. [14] з регіону bulge волосяного фолікула вібрис безпорідних дорослих щурів-самців (n = 3) віварію ДУ «Інститут нейрохірургії ім. акад. А.П. Ромоданова НАМН України» на базі ДУ «Інститут генетичної та регенеративної медицини НАМН України».
Капсулу фолікула розрізали вздовж, фолікул пересікали поперечно вище та нижче потовщення, яке виділяли з капсули та поміщали в чашку Петрі, вкриту колагеном. Після прикріплення протягом однієї години експлантати заливали середовищем росту: αMEM (Sigma, США) з додаванням 5% фетальної телячої сироватки (Sigma, США), 5 нг/мл основного фактора фібробластів (Sigma, США), 10 нг/мл епідермального фактора росту (Sigma, США), 1% розчину вітамінів MEM (Sigma, США), 1% поживної добавки ITS (Gibco, США), 2 мМ глутаміну, 100 од/мл пеніциліну, 100 мкг/мл стрептоміцину, 2,5 мкг/мл амфотерицину В. Культивування проводили в мультигазовому інкубаторі CB 210 (BINDER, Німеччина) при температурі 37 °С у газовій суміші, що мала наступний склад: 90 % N2, 5 % O2 и 5 % СО2. Перший пасаж проводили на десяту добу в культуральний флакон 25 см2. Наступні пересіви клітин здійснювали при досягненні культурою субконфлуентного стану. Засівна концентрація при пересівах становила 1000 клітин/см2. Пасажування проводили за допомогою 0,05% розчину трипсину в 0,53 мМ розчині Na2EDTA (Sigma, США). В експерименті використовували клітини 3–5 пасажів.
Тканинно-інженерний провідник для пластики дефекту периферичного нерва засівали МСК-ПНГ за двоетапною технікою. На першому етапі проводили засів 200 тисяч МСК-ПНГ на внутрішню поверхню колагенового провідника NeuraGenТМ довжиною 1,2 см. Для цього закривали один кінець трубки, вносили суспензію клітин у поживному середовищі та закривали другий кінець. Для рівномірного розподілу клітин провідник поміщали у роллерну установку CellNest Roller D2 (SINO-BIOTOP, Китай), яка знаходилась у мультигазовому інкубаторі, та культивували протягом 24 годин із швидкістю 20 обертів в 1 хвилину. На другому етапі на наступну добу засівали ще 800 тисяч МСК-ПНГ у порожнину провідника шляхом полімеризації фібринового гелю, що був виготовлений із крові щурів. Для виготовлення фібринового гелю від щурів збирали кров: 1) у центрифужні пробірки без антикоагулянту для виготовлення сироватки, що містить тромбін; 2) у центрифужні пробірки з антикоагулянтом ACD-A (Haemonetics, США) у співвідношенні 9 : 1 для отримання збагаченої тромбоцитами плазми (ЗТП). Кров без антикоагулянту інкубували у термостаті при 37 °С протягом години для її згортання. Потім центрифугували 20 хв при 4 °С та 2300 g, відбирали супернатант (сироватка, що містить тромбін) та заморожували при –80 °С до використання. Кров з антикоагулянтом обробляли центрифугуванням в два етапи: 1) 10 хв при 4 °С та 800 g (седиментація еритроцитів і мононуклеарів крові, отримання плазми крові); 2) 20 хв при 4 °С і 2300 g для седиментації тромбоцитів та отримання збагаченої тромбоцитами плазми. Потім ЗТП піддавалась двом циклам заморожування — відтаювання і центрифугувалася 20 хв при 4 °С та 2300 g. Супернатант (кріолізат ЗТП) відбирався та зберігався при –80 °С до використання. Для формування фібринового гелю клітини ресуспендували у 900 мкл кріолізату ЗТП, додавали 100 мкл сироватки з активованим тромбіном (суміш 750 мкл сироватки з тромбіном з 250 мкл 10% розчину СаСl2) і заповнювали цим розчином порожнину закритого з одного боку колагенового провідника, закривали другий кінець провідника та інкубували 20 хв у мультигазовому інкубаторі при 37 °С до полімеризації фібринового гелю. Потім засіяний клітинами провідник поміщали у живильне середовище та культивували протягом 24 годин до використання.
Хірургічне втручання виконували за загального знеболення тварини (внутрішньоочеревинне введення розчину ксилазину 15 мг/кг та кетаміну 70 мг/кг маси). З лінійного розрізу шкіри по латеральній поверхні стегна виділяли й мобілізували сідничний нерв на відстані 20 ± 1 мм від його виходу з порожнини малого тазу, висікали фрагмент довжиною 10 ± 2 мм. У групі 1 фрагмент повертали на 180° і фіксували між куксами нерва 3–6 епіневральними швами за допомогою атравматичної голки із монофіламентною поліамідною ниткою 10/0. У групі 2 кінці нерва фіксували до трубчатого колагенового імплантата, заповненого фібриновим гелем, за допомогою 4 епіневральних швів. У групі 3 кінці нерва аналогічним чином фіксували до трубчатого імплантата, заповненого фібриновим гелем з МСК-ПНГ у кількості 1 × 106 клітин. У групі 4 перетин мобілізованого нерва не виконували. У всіх групах рану закривали пошаровими швами, профілактику інфекційно-запальних ускладнень здійснювали за допомогою введення розчинів біциліну-5 (1 млн ОД на 1 кг маси тіла) та дексаметазону (6 мг/кг маси). Після вказаних маніпуляцій тварин протягом 2–4 годин утримували в приміщенні з підвищеною температурою повітря (30 °C), у подальшому — у звичних умовах віварію.
Для отримання відбитків стоп щурів використовували спеціально розроблену конструкцію [23] у вигляді тунелю для односпрямованого руху тварини (висота — 10 см, ширина — 12 см, довжина — 120 см) з плоским дном, встеленим паперовим носієм, із заслінкою на початку та облаштованим виходом у клітку — у кінці. Тварину із змоченими розчином фукорцину підошвами задніх лап поміщали у тунель, закривали заслінку; після самовільного переміщення тварини у клітку паперовий носій із відбитками стоп висушували і залучали до аналізу. Визначали наступні показники: print length (PL) — відстань від п’яткового відбитка до відбитка кінця третього пальця стопи, toe spread (TS) — відстань між відбитками кінців 1-го та до 5-го пальців, intermediate toe spred (ITS) — відстань між відбитками кінців 2-го та 4-го пальця. Показники обраховували для експериментальної (E) та інтактної (N) кінцівок.
Функціональний індекс сідничного нерва (Sciatic Functional Index — SFI) визначали за допомогою формули Bain-Mackinnon-Hunter [7, 9]:
Показник розраховували для всіх тварин, визначали середнє значення та середньоквадратичне відхилення. Нульове значення SFI відповідає інтактній кінцівці, значення у –100 балів — стану плегії за повної відсутності функції сідничного нерва.
Вірогідність різниці показника між групами на кожному з термінів спостереження оцінювали за допомогою U-тесту Манна — Уїтні. Вірогідність щотижневого приросту значення SFI у кожній з експериментальних груп оцінювали за допомогою W-критерію Уїлкоксона. У всіх випадках припущення щодо статистичної значущості отриманого результату вважали вірним, якщо ймовірність нульової гіпотези була меншою, ніж 0,05 (р < 0,05).
Результати та обговорення
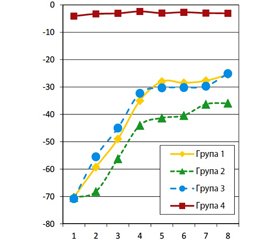
У групах 1 і 3 спостерігали схожу динаміку SFI, яка характеризувалася двофазністю (рис. 5). Перша фаза включала практично лінійне зростання показника від значення у –70 на 7-му добу спостереження до –35 станом на кінець 4-го тижня спостереження. У групі 1 статистично значуще щотижневе збільшення показника реєстрували протягом 2–5-го тижня (р < 0,03; W-критерій Уїлкоксона), у групі 3 — протягом 2–4-го тижня. Друга фаза тривала протягом 6–7-го та 5–7-го тижня у групі 1 та 3 відповідно і характеризувалася відсутністю змін показника. Третю фазу спостерігали протягом 8-го тижня: збільшення показника групи 3 протягом цього періоду виявилося статистично значущим (р = 0,01; W-критерій Уїлкоксона), показник групи 1 станом на кінець 8-го тижня вірогідно (р = 0,046; W-критерій Уїлкоксона) переважав значення, отримані наприкінці 6-го тижня.
/14-2.jpg)
Динаміка SFI у групі 2 суттєво відрізнялася від описаної для груп 1 і 3. Характерним була наявність фази відсутності приросту показника протягом 2-го тижня спостереження. У подальшому, протягом 3–4-го тижня виявляли вірогідне збільшення показника (р < 0,01; W-критерій Уїлкоксона), стабілізацію (протягом 5–6-го тижня), вірогідне збільшення показника протягом 7-го тижня (р = 0,036 порівняно зі значенням станом на 5-й тиждень спостереження; W-критерій Уїлкоксона). Протягом 8-го тижня вірогідних змін показника не виявляли, однак спостерігали зникнення значущості різниці із показником 5-го тижня.
Отже, як і у групах 1 та 3, у випадку імплантації колагенової трубки, заповненої фібриновим гелем (група 2), приріст SFI відбувається двоетапно, його тривалість, а також тривалість проміжної фази плато вкорочена, результативність менша. Отримані дані свідчать, що менший кінцевий результат відновного процесу у цій групі обумовлений відсутністю позитивної динаміки протягом 2-го тижня спостере–ження.
Протягом усього періоду спостереження між значеннями SFI груп 1 та 3 вірогідних відмінностей не виявлено (р > 0,05; U-тест Манна — Уїтні). Статистично значущі відмінності (р < 0,05; U-тест Манна — Уїтні) між показниками групи 1 та 2, а також групи 2 та 3 на користь груп 1 та 3 відповідно виявляли починаючи з 14-ї доби й до кінця експерименту. Порівняно з результатами тестування тварин групи 4 показники груп 1, 2 і 3 виявилися значущо (р < 0,05; U-тест Манна — Уїтні) меншими протягом усього періоду експерименту.
У нашому та інших [17] дослідженнях значний позитивний результат відновного процесу, пов’язаний з реінервацією регенеруючими аксонами м’язів, відмічали уже станом на 14-ту добу.
Лінійна динаміка значення SFI, виявлена нами у групах 1, 2 і 3, може відображати динаміку кількості нервових волокон, що реінервують м’язи паретичної кінцівки. Лінійне збільшення кількості таких волокон можливе за умови нерівномірності їх росту з існуванням сукупного фронту росту — розташування конусів росту окремих волокон у товщі нерва — нахиленого під певним кутом до осі нерва. За таких умов, враховуючи сталу швидкість росту, однак нерівномірну ініціацію цього процесу серед регенеруючих волокон, першими досягають м’яза авангардні конуси росту, у подальшому збільшення кількості волокон, що досягли цілі, зростатиме зі сталою швидкістю, лінійно. У рамках такої моделі зменшення швидкості росту волокон з часом може компенсуватися пластичними перебудовами на рівні центральної нервової системи, а також галузінням аксонів, що досягли цілі, у товщі м’яза. У такій моделі регенераційна пауза протягом перших 2 тижнів у групі 2 свідчить про суттєво нижчу швидкість росту авангардних волокон, ніж у групах 1 і 3; після доростання авангардних волокон до цілі швидкість росту у групі 2 стає аналогічною групам 1 і 3. Отже, у групах 1 і 3 існують більш сприятливі умови для направленого росту аксонів, і якщо у випадку автонейропластики (група 1) такі умови слід пов’язувати з тунельованою структурою сполучно–тканинного каркаса автоімплантата, частково заповненого клітинами шваннівської глії, то у випадку імплантації трубчатого резервуару МСК-ПНГ високу швидкість росту авангардних волокон можна пояснити швидкою векторизацією порожнини матриксу за участю сполучнотканинних та шваннівських нащадків імплантованих стовбурових клітин, стимулюючим впливом цих клітин на ріст аксональних конусів у бік дистальної культі нерва.
У зв’язку з отриманими даними відмітимо, що після перетину нерва деякі аксони проксимального кінця формують колби росту вже протягом першої доби [18], через 24 год після травми поодинокі волокна досягають ділянки травми, вростають у неї протягом 2–3-ї доби; швидкість росту аксонів становить 0,25 мм/добу, з моменту досягнення дистальної культі — збільшується до 1,0–8,5 мм/добу. За умов достатньої васкуляризації цей показник становить 3–4 мм/добу, в умовах слабкої васкуляризації — 2–3 мм/добу.
Іншою цікавою рисою регенераційного процесу, виявленою нами, є завершення його активної фази до 5-го тижня спостереження, що є додатковою причиною низької результативності відновного процесу у групі 2. Пояснення, на нашу думку, слід пов’язувати з особливістю молекулярних механізмів регенераційного росту аксонів рухових нейронів, їх центральних ланок, а також у явищі денерваційної атрофії м’яза: незважаючи на пластичність м’язової тканини, період результативної його регенерації обмежений [19–22].
Висновки
1. Пластика дефекту периферичного нерва трубчатим імплантатом NeuraGenTM, заповненим фібриновим середовищем із вмістом стовбурових клітин-похідних нервового гребеня, з точки зору відновлення стану м’язово-суглобового апарату паретичної кінцівки еквівалентна класичній автонейропластиці.
2. Тривалість періоду регенераційного росту волокон травмованого нерва до моменту ініціації відновлення функції паретичної кінцівки суттєво залежить від тканинного оточення у зоні травматичного дефекту.
3. Тривалість активного відновлення функції паретичної кінцівки за відтвореного варіанту травми обмежена першим місяцем, не залежить від специфіки тканинних процесів у зоні пластики дефекту нерва.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Інформація про вклад у роботу кожного автора
Концепція і дизайн дослідження — В. Цимбалюк, Т. Петрів.
Моделювання травми, автонейропластика, імплантація колагенового матриксу, у тому числі з МСК-ПНГ — Т. Петрів.
Отримання та культивування МСК-ПНГ, створення тканинно-інженерних конструктів — Р. Васильєв.
Визначення функціонального індексу сідничного нерва, первинна обробка даних — Т. Петрів, В. Молотковець, М. Татарчук.
Статистична обробка даних — Н. Драгунцова.
Інтерпретація отриманих результатів — В. Цимбалюк, Т. Петрів, В. Медведєв.
Написання тексту та редагування — В. Цимбалюк, Т. Петрів, В. Медведєв.
Список литературы
1. Torres R. Epidemiology of Traumatic Peripheral Nerve Injuries Evaluated by Electrodiagnostic Studies in a Tertiary Care Hospital Clinic / Torres R., Miranda G. // Boletin de la Asociacion Medica de Puerto Rico. — 2015. — Vol. 3, № 107. — P. 79-84.
2. Відновне хірургічне лікування наслідків ушкодження довгих гілок плечового сплетення з використанням тривалої електростимуляції / Ю.П. Зозуля, І.Б. Третяк, Ю.В. Цимбалюк, М.А. Сапон // Український нейрохірургічний журнал. — 2013. — № 2. — С. 19-22.
3. Rasulić L. et al. The epidemiology of forearm nerve injuries — a retrospective study // Acta Clin. Croat. — 2015. — Vol. 54, № 1. — Р. 19-24.
4. Battiston et al. Peripheral Nerve Defects: Overviews of Practice in Europe // Hand Clinics. — 2017. — Vol. 33, № 3. — P. 545-550.
5. Safa B. Autograft Substitutes: Conduits and Processed Nerve Allografts / Safa B., Buncke G. // Hand Clinics. — 2016. — Vol. 32, № 2. — P. 127-140.
6. Kappos Е.А. et al. Validity and reliability of the CatWalk system as a static and dynamic gait analysis tool for the assessment ofc functional nerve recovery in small animal models // Brain Behav. — 2017. — Vol. 7, № 7. — Р. e00723, eCollection 2017.
7. Sarikcioglu L. Walking track analysis: an assessment method for functional recovery after sciatic nerve injury in the rat / L. Sarikcioglu, B.M. Demirel, A. Utuk // Folia Morphol. — 2009. — Vol. 68, № 1. — P. 1-7.
8. Jonsson S. et al. Effect of Delayed Peripheral Nerve Repair on Nerve Regeneration, Schwann Cell Function and Target Muscle Recovery // PLoS ONE. — 2013. — Vol. 8, № 2. —Р. e56484. Epub 2013 Feb 7.
9. Цимбалюк В.І., Третяк І.Б., Гацький О.О., Вернигородський С.В. Гістоморфометрична оцінка ефективності комбінованої пластики сідничного нерва при його великому дефекті у щурів в експерименті // Український нейрохірургічний журнал. — 2012. — № 3. — С. 48-51.
10. Lemke A. et al. A novel experimental rat model of peripheral nerve scarring: reliably mimicking post-surgical complications and recurring adhesions // Disease Models & Mechanisms. — 2017. — Vol. 10, № 8. — P. 1015-1025. Epub 2017 May 26.
11. Sullivan, R., Dailey, T., Duncan, K., Abel, N., Borlongan C.V. Peripheral nerve injury: Stem cell therapy and peripheral nerve transfer // International journal of molecular sciences. — 2016. — Vol. 17, № 12. — Р. E2101.
12. Vasyliev R.G. et al. Effects of Neural Crest-Derived Multipotent Stem Cells on Regeneration of an Injured Peripheral Nerve in Mice // Neurophysiology. — 2015. — T. 47, № 1. — Р. 80-83.
13. Amoh Y. et al. Nestin-positive hair follicle pluripotent stem cells can promote regeneration of impinged peripheral nerve injury // J. Dermatol. — 2012. — Vol. 39. — P. 33-38.
14. Sieber-Blum M., Grim M., Hu Y., Szeder V. Pluripotent neural crest stem cells in the adult hair follicle // Dev. Dyn. — 2004. — Vol. 231, № 2. — P. 258-269.
15. Najafzadeh N., Esmaeilzade B., Dastan Imcheh M. Hair follicle stem cells: In vitro and in vivo neural differentiation // World J. Stem. Cells. — 2015. — Vol. 7, № 5. — P. 866-872.
16. Neil G. Fairbairn, Amanda M. Meppelink, Joanna Ng-Glazier, Mark A. Randolph, Jonathan M. Winograd. Augmenting peripheral nerve regeneration using stem cells: A review of current opinion // World J. Stem. Cells. — 2015. — Vol. 7, № 1. — P. 11-26.
17. Jung Y., Ng J.H., Keating C.P., Senthil-Kumar P., Zhao J., Randolph M.A., Winograd J.M., Evans C.L. Comprehensive evaluation of peripheral nerve regeneration in the acute healing phase using tissue clearing and optical microscopy in a rodent model // PLoS One. — 2014. — Vol. 9, № 4. — Р. e94054. eCollection 2014.
18. Antoniadis G. Nerve regeneration / Haastert-Talini, K., Assmus, H., Antoniadis, G. // Modern concepts of peripheral nerve repair. — Springer International Publishing, 2017. — Р. 8-10.
19. Washabaugh C.H., Ontell M.P., Kant J.A. et al. Effect of chronic denervation and denervation-reinnervation on cytoplasmic creatine kinase transcript accumulation // Journal of Neuro–biology. — 2001. — Vol. 47, № 3. — P. 194-206.
20. Lapalombella et al. Persistence of regenerative myogenesis in spite of down-regulation of activity-dependent genes in long-term denervated rat muscle // Neurology Research. — 2008. — Vol. 30, № 2. — P. 197-206.
21. Artioli G.G. et al. Embryonic stem cells improve skeletal muscle recovery after extreme atrophy in mice // Muscle Nerve. — 2015. — Vol. 51, № 3. — P. 346-352.
22. Rochkind S., Shainberg A. Muscle response to complete peripheral nerve injury: changes of acetylcholine receptor and creatine kinase activity over time // Journal of Reconstructive Microsurgery. — 2017. — Vol. 33, № 5. — P. 352-357.
23. Патент України на корисну модель № 118156, МПК: G09B 23/28. «Спосіб визначення функціонального індексу сідничного нерва у щурів» / Цимбалюк Віталій Іванович (UA); Молотковець Віталій Юрійович (UA); Петрів Тарас Ігорович (UA); Медведєв Володимир Вікторович (UA); Лузан Борис Миколайович (UA). — Заявка № u201701183; Заявл. 09.02.2017;

/13-1.jpg)
/15-1.jpg)
/14-1.jpg)
/14-2.jpg)