Концентрический склероз Бало (КСБ) — редкое демиелинизирующее заболевание, которое характеризуется появлением в качестве специфического патоморфологического субстрата концентрических очагов демиелинизации по типу колец на спиле дерева или срезе луковицы с чередующимися слоями ремиелинизации и демиелинизации. КСБ входит в рубрику МКБ-10 «Другие демиелинизирующие заболевания центральной нервной системы» и шифруется как G37.5. Впервые концентрические элементы в очагах демиелинизации были упомянуты Отто Марбургом в 1906 г. В 1927 г. венгерский патоморфолог Josef Balo описал клинический случай и результаты патологоанатомического исследования, в ходе которого были выявлены концентрические очаги с чередованием миелинизированных и демиелинизированных волокон [4, 5]. Он же впервые предположил, что описанная им патология является редким вариантом рассеянного склероза. Первоначально это заболевание называли периаксиальным лейкоэнцефалитом, однако в последующем оно получило настоящий
эпонимический термин. На взаимосвязь между рассеянным склерозом и КСБ указывают исследования большинства авторов. Так, J.H. Korte, E.P. Bom, L.D. Vos, T.J. Breuer (1994) при проведении магнитно-–резонансной томографии (МРТ) головного мозга в динамике у 7 пациентов с этой патологией наблюдали появление новых очагов демиелинизации, характерных для обоих заболеваний [8].
В отличие от рассеянного склероза патоморфологически КСБ отличается образованием преимущественно в белом веществе лобных долей обширных очагов демиелинизации, отдельные из которых окружены характерными кольцами, состоящими из зон полного или частичного повреждения миелина. Данные чередующиеся кольца сохранного миелина или ремиелинизации и при его утрате (демиелинизации) могут локализоваться в полушариях головного мозга, мозжечке, стволе, спинном мозге, перекресте зрительных волокон. Микроскопически выявляются выраженная дегенерация олигодендроцитов, которая сопровождается их апоптозом, и мелкоклеточные васкулиты [9].
О причине и патогенезе формирования этих патогномоничных для КСБ колец врачи и ученые дискутировали с момента их описания. За вековой период изучения этой патологии в литературе изложены различные теории его патогенеза: концентрической ремиелинизации, дистальной олигодендроцитопатии, коллоидная, теория астроцитопатии. Самой ранней была теория концентрической ремиелинизации. Предположение о неравномерно происходящей ремиелинизации было опровергнуто в ходе динамического наблюдения за развитием очагов при проведении МРТ головного мозга и по результатам гистологических исследований. Атипичные формы демиелинизации соответствуют одному из морфологических вариантов демиелинизации при рассеянном склерозе, описанных C. Luchinetti и соавторами в 2012 г. КСБ соответствует третьему варианту — варианту дистальной олигодендроцитопатии, при котором выявляются апоптоз олигодендроцитов и снижение экспрессии миелинассоциированного гликопротеина, отсутствие циклической нуклеотидной фосфодиэстеразы в миелине. При наличии очагов демиелинизации третьего типа было выдвинуто предположение о «гистотоксической» ишемии, причиной которой является поражение митохондрий, похожее на их повреждение при действии цианидов. Однако данная теория не объясняет существования нескольких вариантов течения одного морфологического варианта демиелинизирующего процесса в центральной нервной системе.
В 1896 г. немецкий химик Р. Лизеганг обнаружил периодическое осаждение соединений в гелевых средах, напоминающее годичные кольца на спиле дерева. Позже эти концентрические структуры были названы именем Лизеганга. Структуры Лизеганга обычно получают при диффузии одного из исходных веществ через гель, содержащий другое вещество, способное с первым образовывать нерастворимый осадок. Возможный физический механизм, объясняющий образование структур Лизеганга, был впервые предложен В. Оствальдом в 1897 г. Теория рассматривается биохимиками как возможное объяснение формирования в ткани мозга очагов, характерных для концентрического склероза Бало, однако предположения о реагентах, участвующих в данном процессе, пока носят самый общий характер. Между тем стоит отметить, что в природе подобный процесс встречается весьма часто: годовые кольца деревьев, кольца в структуре некоторых минералов, круги грибниц — все это примеры колец Лизеганга. Вероятно, что кольца при КСБ являются одним из таких примеров.
Открытие того факта, что в очагах при КСБ не экспрессируется один из мембранных водных каналов астроцитов — аквапорин-4, послужило основанием для построения теории о первоначальной роли астроцитов в развитии данной формы демиелинизации [1]. В исследованиях, проводимых C. Stadelman с соавторами (2005), на основании результатов аутопсии 14 пациентов с КСБ обнаружено, что все свежие концентрические кольца сопровождаются паттерном демиелинизации, который аналогичен повреждению тканей гипоксического типа в связи с высоким уровнем синтетазы оксида азота в макрофагах и микроглии [7]. По краям активных очагов и в кольцах авторами был обнаружен разрушенный миелин, протеины которого (фактор 1-альфа и тепловой шоковый протеин-70) вырабатываются олигодендроцитами и в меньшей степени — астроцитами и макрофагами. Исходя из нейропротективных эффектов данных протеинов, авторы предположили, что образование колец отражает ограничение дальнейшего разрушения миелина при этом заболевании [2].
Существует гипотеза (Moore G.R., Neumann P.E., Suzuki K., Lijtmaer H.N. et al., 1985), согласно которой выявлено, что очаг демиелинизации при КСБ начинает развиваться из центральной сердцевины, где находится венула, а затем демиелинизирующая активность распространяется в окружающее вещество мозга из этого участка. Несмотря на то, что инициирующее болезнь триггерное событие неизвестно, показано, что из сердцевины центробежно распространяются лимфоциты и воспалительные факторы. Полярность демиелинизированных слоев свидетельствует о том, что демиелинизирующая активность периодически реактивируется, а затем угасает, так как мигрирует из центра на периферию, запускаясь вновь, когда прибывает новая порция активирующих веществ. К возможным модуляторам иммунной активности относят многие цитокины, о некоторых из них известно, что их концентрации в крови больных периодически то повышаются, то понижаются. В то же время гипотеза не объясняет, почему концентрические очаги не встречаются столь же часто при классическом рассеянном склерозе, очаги демиелинизации при котором также локализуются преимущественно вокруг венул.
К патофизиологическим механизмам формирования слоистых очагов при КСБ некоторые исследователи относят взаимодействие между гистотоксической гипоксией из-за избытка продукции промежуточных продуктов оксида азота и свободных радикалов, угнетающих функцию митохондрий, и последующей защитой ткани в результате экспрессии молекул предуготованности ткани — HIF1, hsp70 (Stadelmann C., Ludwin S., Tabira T. et al., 2005).
Немецкими исследователями (Helmut Barz, Ulrich Barz, Almut Schreiber, 2016) была выдвинута следующая гипотеза патогенеза и морфогенеза КСБ. В ней говорится, что в тканях с эластичными свойствами отек вызывает повышение тканевого давления и, следовательно, уменьшение кровотока. Предположительно повышенное тканевое давление вследствие местного и/или рецидивирующего отека может быть причиной неполного некроза (например, очаги демиелинизации) или, редко, полного некроза в головном мозге. Вновь образующиеся очаги демиелинизации иногда демонстрируют небольшие полосы ткани с нормально проявляющимися миелиновыми оболочками. Эти полосы располагаются в непосредственной близости от предыдущих поражений. Тонкие миелинизированные полосы являются результатом «защищенной зоны» по краю предыдущих демиелинизированных поражений. Авторы объясняют эту защищенную зону двумя аргументами. Во-первых, резорбтивная грануляционная ткань старых очагов относительно богата капиллярами. Эти капилляры могут действовать как резервуар энергии, который может питать не только очаг, но и узкую прилегающую полосу миелиновой ткани за счет диффузии, даже если капиллярный кровоток в этой полосе снижен из-за повышенного тканевого давления нового развивающегося поражения по соседству. Во-вторых, еще один защитный механизм может действовать одновременно: более старые или склерозированные повреждения и небольшие прилегающие к ним полосы миелиновой ткани могут набухать меньше в случаях отека, чем в нормальной ткани. Рубцевание старых поражений обусловлено пролиферацией волокнообразующих астроцитов. В зоне с повышенным тканевым давлением капилляры менее подвержены компрессии в склерозированных поражениях, чем в областях нормального серого и белого вещества. Кроме того, прилегающая полоса миелиновой ткани, расположенная ближе к краю затвердевшего очага, лучше защищена от набухания и компрессии, чем более удаленная ткань. Теоретически эта зона защиты сравнима с кровеносными сосудами, которые защищены в гаверсовых каналах или костномозговой полости костей. Наличие обоих защитных механизмов по краям демиелинизированных поражений дает основание предположению о гипоксической причине формирования очагов демиелинизации при КСБ и рассеянном склерозе [3].
Таким образом, из приведенной выше информации можно сделать выводы, что повышенное из-за отека тканевое давление может быть причиной демиелинизирующих повреждений в головном мозге. Увеличенная резорбтивная васкуляризация предыдущих поражений позволяет получать питание рядом расположенным небольшим участкам ткани путем диффузии. Кроме того, склерозирование глиальных волокон старых очагов способствует циркуляции крови в очагах поражения и на их границах в случаях повышенного тканевого давления.
Истинная частота КСБ неизвестна, однако считается, что эта патология относится к редким заболеваниям нервной системы с несколько большей распространенностью в странах Азии. Женщины и мужчины заболевают одинаково часто, при этом большинство случаев заболевания приходится на возраст 20–50 лет. В литературе отмечается взаимосвязь развития КСБ с перенесенными инфекциями и/или стрессовыми ситуациями [10]. Исследователями описаны различные варианты течения КСБ — от бессимптомного, спонтанно регрессирующего до фульминантного, резистентного к иммуносупрессивной терапии [8, 9]. Заболевание может быть как монофазным, подобно острому рассеянному энцефаломиелиту, так и очередным обострением хронического демиелинизирующего заболевания [1]. Симптоматика чаще всего развивается подостро, в течение нескольких дней или недель.
Клинические проявления КСБ обычно представлены выраженной очаговой (пирамидные, мозжечковые симптомы, ретробульбарный неврит, когнитивные нарушения) неврологической симптоматикой в сочетании с общемозговой (головная боль, эпилептический синдром), часто с когнитивным дефицитом. Описаны случаи КСБ, начинающиеся с гемианопсии и изолированной амнестической афазии [6], а также единичные наблюдения бессимптомного течения концентрического склероза Бало, выявленные при аутопсии. Несмотря на изначально большую зону поражения, общемозговые симптомы, как правило, появляются на поздних стадиях заболевания. В цереброспинальной жидкости при КСБ могут выявляться небольшой лимфоцитарный плеоцитоз, нормальный уровень белка, облигатные для рассеянного склероза олигоклональные IgG отмечаются у 10 % больных (Weinshen–ker B.G., Miller D., 1999).
До тех пор пока в диагностику не было внедрено МРТ-исследование, диагноз КСБ устанавливался только по результатам аутопсии. В настоящее время данный вариант демиелинизации диагностируется по специфической картине МРТ и монофазному течению заболевания, однако четких критериев до сих пор не разработано. По данным МРТ, этот диагноз впервые был установлен в 1989 г. [1]. К типичным нейровизуализационным признакам этой патологии при MPT относят концентрические кольца, напоминающие завитки или спил дерева, на Т2- и Т1-взвешенных изображениях с чередованием структур измененного и неизмененного в соответствующем режиме MP-сигнала. Важным моментом является наличие незначительной выраженности масс-эффекта при достаточно большом объеме поражения и особенностей локализации очагов, присущих демиелинизации. Внутривенное контрастирование (при проведении МРТ) позволяет оценить активность процесса. В настоящее время КСБ обсуждается как диагноз при выявлении на МРТ двух и более концентрических участков демиелинизации, накапливающих контрастное вещество по одному кольцу и более или его части. Максимально часто встречается локализация концентрических очагов в белом веществе лобных и теменных долей полушарий большого мозга, однако описаны случаи поражения мозжечка, ствола головного мозга и спинного мозга. Исключить поражения головного мозга другой этиологии также позволяют комплексные данные MP-спектроскопии и СКТ-перфузионного исследования. Также необходимо отметить роль позитронно-эмиссионной томографии, позволяющей достоверно судить о неопухолевой природе выявляемых на МРТ изменений.
При лечении КСБ отмечаются данные лишь IV класса доказательности. Основными методами выбора терапии этой патологии являются: пульс-терапия глюкокортикостероидными препаратами, высокообъемный плазмаферез или цитостатики (митоксантрон). Нет четких показаний к применению какого-то одного из указанных методов, однако обычно придерживаются эскалирования в порядке: пульс-терапия, плазмаферез, цитостатики, прибегая сразу к плазмаферезу или цитостатической терапии в наиболее тяжелых случаях. Описание благоприятных исходов связано с постановкой диагноза и началом агрессивной терапии уже на самых ранних стадиях заболевания. Продемонстрирован один случай КСБ у пациента с рассеянным склерозом на фоне терапии интерфероном-бета-1α [1].
Первоначально считалось, что в отличие от классического рассеянного склероза течение КСБ неуклонно прогрессирует и заканчивается летально через несколько месяцев или лет, то есть эта патология имеет плохой прогноз. Большинство описанных в литературе случаев КСБ обычно протекало по типу синдрома острой демиелинизации с монофазным быстро прогрессирующим течением и летальным исходом в течение нескольких недель или месяцев. Однако в последние годы появились описания случаев с большей продолжительностью жизни больных или спонтанной ремиссией заболевания. Показаны также единичные случаи бессимптомного течения КСБ, выявленные на вскрытии [9].
В связи с тем, что в русскоязычной литературе достаточно мало работ, посвященных описанию прижизненной диагностики КСБ, диагноз которого подтвержден в последующем на секции, мы приводим собственное наблюдение.
Пациент Н., 52 года, строитель, направлен в нейрохирургическое отделение 5-й клинической больницы г. Минска с диагнозом «опухоль левой теменной доли». При поступлении предъявлял жалобы на затруднение речи, асимметрию лица, снижение памяти, периодическую головную боль, которые появились около 2 недель до поступления. Неделей позже появилась нарастающая слабость в правой руке. Семейный анамнез не отягощен. Хронические заболевания на момент обращения отрицал. В анамнезе из перенесенных заболеваний: менингит в возрасте до 30 лет (медицинские документы не сохранились), редко — простудные.
Неврологический статус при поступлении: в сознании, ориентирован, адекватен. Снижена память. Черепные нервы без патологии. Зрачки d = s, прямая и содружественная реакция зрачков на свет живая. Лицо симметрично. Язык по средней линии. Фонация и глотание сохранены. Глубокие рефлексы оживлены, D ≥ S. Парезов конечностей нет. Поверхностная, глубокая чувствительность сохранена. В позе Ромберга устойчив. Координаторные пробы выполняет удовлетворительно с двух сторон. Менингеальных симптомов нет. Нарушения функции тазовых органов нет.
При проведении клинических обследований: общий анализ мочи, биохимический анализ крови, электрокардиограмма, общий и биохимический анализ ликвора без значимых особенностей; маркеры аутоиммунных системных заболеваний, онкомаркеры отрицательны. Полимеразная цепная реакция ликвора на инфекционные возбудители отрицательная. Ультразвуковое исследование органов брюшной полости: диффузные изменения печени, поджелудочной железы. Гепатомегалия. Хронический холецистит. Нейроофтальмологическое исследование: на глазном дне умеренно и равномерно сужены артерии сетчатки.
МРТ головного мозга: в левой височно-теменной области очаги, гиперинтенсивные на Т2-взвешенном изображении, различного диаметра — от 3 до 33 мм, неоднородной структуры. Кроме этого, в белом веществе полушарий головного мозга определяются перивентрикулярно мелкие гиперинтенсивные на Т2-взвешенном изображении очаги. Срединные структуры не смещены. Базальные цистерны, желудочки мозга, кортикальные борозды умеренно расширены. МР-признаки демиелинизирующего процесса неяcной этиологии.
Пациенту было проведено лечение дексаметазоном, метотрексатом, после чего он с некоторой положительной динамикой был выписан на амбулаторный этап. Диагноз при выписке сформулирован как демиелинизирующее заболевание центральной нервной системы (объемный процесс?), левой височно-теменной области головного мозга с правосторонней пирамидной недостаточностью. Рекомендован повторный курс стационарного лечения через 2 недели с проведением МРТ-контроля с контрастированием.
За 2 недели пребывания на амбулаторном этапе лечения состояние пациента ухудшилось. В клинической картине появились умеренный парез правой руки, слабость в ноге и легкая моторная афазия. Неврологический статус при повторной госпитализации: в сознании, ориентирован, речевой контакт затруднен из-за моторной афазии. Зрачки d = s. Реакция зрачков на свет сохранена. Движение глазных яблок в полном объеме. Лицо симметрично. Фонация и глотание сохранены. Язык по средней линии. Рефлексы орального автоматизма отрицательны. Глубокие рефлексы высокие, D > S. Умеренный парез правой руки, плегия в кисти, пирамидная недостаточность в правой ноге. Чувствительность не изменена. В позе Ромберга устойчив. Менингеальных симптомов нет. Симптом Бабинского справа.
КТ головного мозга с контрастным усилением (омнискан): после в/в усиления в левой теменной доле выявляются 3 очага патологического накопления контрастного вещества (17,5 мм) диаметрами 22, 18 и 10 мм с кольцом вокруг крупного очага. Срединные структуры не смещены. Желудочки не компримированы. Незначительно расширены борозды правого конвекса, сглажены борозды левого конвекса. Заключение: КТ-картина объемного процесса левой теменной доли (возможно, метастаз). Кисты в обеих височных долях.
МРТ головного мозга: при контрольном исследовании отмечается отрицательная динамика: размеры образования значительно увеличились. В остальном МР-картина прежняя. Заключение: МР-признаки демиелинизирующего процесса (псевдотуморозная форма). Нельзя исключить новообразования на этом фоне.
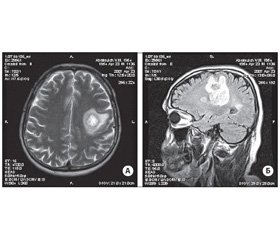
МРТ головного мозга с контрастированием (омнискан): в левой заднелобно-височно-теменной области выявляются гиперинтенсивные очаги на Т2-взвешенном изображении различного диаметра — от 3 до 37 мм, неоднородной структуры, часть из которых окружена кольцами (рис. 1). Кроме этого, в белом веществе полушарий головного мозга перивентрикулярно определяются мелкие гиперинтенсивные на Т2-взвешенных изображениях очаги. Срединные структуры не смещены. Базальные цистерны, желудочки мозга, кортикальные борозды умеренно расширены. Вышеуказанные очаги накапливают контраст по периферии. По сравнению с предыдущим исследованием часть очагов значительно увеличилась, а некоторые несколько уменьшились в размерах. Заключение: МР-признаки демиелинизирующего процесса.
/27-1.jpg )
За 2 недели лечения в стационаре продолжалась отрицательная динамика. Усугубились афатические нарушения, жалобы пациент не формулировал, увеличилась выраженность пареза в правой руке. Объективно: в сознании, ориентирован, адекватен. Умеренно выражена моторная, легкая сенсорная афазия. Центральная недостаточность 7,12 п. ЧН справа. Глубокие рефлексы высокие, D > S, зоны расширены. Выраженный парез правой руки (до 1 балла). Легкий парез в правой ноге. Чувствительные нарушения достоверно проверить невозможно из-за афатических нарушений. Менингеальных знаков нет. Симптом Бабинского справа. Проведено лечение солумедролом (пульс-терапия) и метотрексатом внутрь.
Эффекта не было, усугубились афазия и правосторонний гемипарез. В связи с нарастанием отека головного мозга, застойным флеботромбозом сосудов нижних конечностей, тромбоэмболией легочной артерии в основной ствол пациент умер. Заключительный клинический диагноз: концентрический склероз Бало с тотальной афазией, выраженным парезом правой руки, плегией кисти, легким парезом правой ноги.
При патологоанатомическом исследовании головного мозга макроскопически выявлены концентрически чередующиеся светлые и темные полосы в белом веществе левой заднелобно-височно-теменной области, а также волнообразные и спиралевидные структуры. Перивентрикулярно обнаружены очаги серого и серо-розового цвета различных размеров, округлой и овальной формы, мягкой консистенции, с относительно четкими границами. При микроскопическом исследовании в светлых полосах выявлена разрушенная миелиновая ткань с сохраненными осевыми цилиндрами. Пролиферация клеток макроглии была более выражена в центре повреждений, чем по периферии. В очагах обнаружены периваскулярные воспалительные лимфоплазмоцитарные инфильтраты.
Представленный нами собственный клинический пример отражает все сложности диагностики и лечения КСБ. Такими особенностями являются вероятность высокой устойчивости к иммуносупрессивной терапии и необходимость начинать лечение сразу после выявления такого рода очагов и эскалация терапии вплоть до цитостатической терапии. Необходимо помнить о рисках, сопряженных с применением глюкокортикостероидов в высоких дозах, проведением плазмафереза, поскольку сочетание нескольких факторов риска гиперкоагуляции приводит к периферическим артериальным и венозным тромбозам. Предполагаем, что современные методы нейровизуализации позволяют заподозрить и начать терапию как можно раньше, одновременно мониторируя динамику процесса. Несмотря на общий неблагоприятный прогноз КСБ в ряде случаев, ранняя агрессивная иммуносупрессивная терапия позволяет предотвратить летальный исход в результате данного заболевания и уменьшить вероятность инвалидизации пациента.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.

/27-1.jpg )