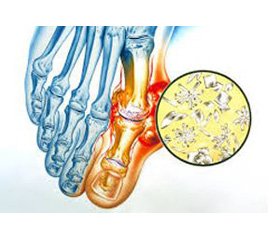
Подагра — це системне метаболічне тофусне захворювання, що розвивається через запалення у місці відкладення кристалів моноурату натрію в осіб із гіперурикемією, обумовленою зовнішньосередовищними та/або генетичними чинниками [1]. Вторинна подагра розвивається за наявності певного попереднього захворювання або ж патогенного чинника, тобто виявляється як синдром чи ускладнення будь-якого іншого патологічного процесу [8]. Як відомо, основним патогенетичним чинником вторинної подагри є підвищена продукція сечової кислоти ендогенного характеру, що часто спостерігається при мієло- та лімфопроліферативних процесах, гемолітичній анемії, еритремії, поширеній формі псоріазу, вроджених ціанотичних вадах серця, а також під час хіміотерапії при солідних пухлинах внаслідок масивної загибелі ракових клітин [8]. Подагричний артрит у таких випадках характеризується тривким тяжким перебігом, поліартикулярним ураженням, нерідко рецидивуючими артритами, атиповим дебютом артриту (не з типового ураження І плеснофалангового суглоба ступні), надвисоким рівнем сечової кислоти, низькою ефективністю уратознижуючої терапії. Вторинна подагра також може розвиватися як побічна дія або при зловживанні деякими лікарськими препаратами (насамперед при нераціональному використанні тіазидних діуретиків), що порушують функціонування ниркових канальців (дисбаланс шляхів тубулярної секреції/реабсорбції (екскреції) сечової кислоти) і зменшують об’єм циркулюючої крові. Незважаючи на чіткі діагностичні критерії подагри, встановлення правильного діагнозу викликає певні труднощі та втрату часу, необхідного для дієвого лікування [4].
Наводимо клінічний випадок діагностики множинної мієломи та швидкопрогресуючої ниркової недостатності у пацієнта, що надійшов у клініку з тяжким подагричним артритом.
Пацієнт І., 78 років, мешканець м. Києва, пенсіонер, звернувся 16 червня 2017 року в нашу клініку через виникнення гострого артриту дрібних суглобів правої кисті, правого променево-зап’ясткового суглоба, лівого колінного суглоба та І плеснофалангового суглоба правої ступні. Пацієнт вказує, що даний напад артриту виник уперше. Близько тижня потому з’явився різкий сильний біль у І плесно-фаланговому суглобі правої ступні з набряком і почервонінням навколосуглобових тканин. Пізніше з’явилися виражений набряк, почервоніння, сильний біль у суглобах правої кисті. Прийом нестероїдних протизапальних препаратів (диклофенак 100 мг/день) тільки незначно знімав больовий синдром. Поширення процесу на нові суглоби (поява болів та припухання колінного суглоба) спонукало пацієнта звернутися до медичного закладу. Пацієнт скаржиться також на підвищення температури тіла до 38 °С у перші дні розвитку артриту, згодом — на рівні 37,3 °С, виражену загальну слабкість, неможливість пересування внаслідок больового синдрому, біль голови, болі в хребті та грудній клітці. До цього епізоду артриту пацієнт почував себе цілком здоровим.
При огляді: пацієнт адекватного харчування, нормостенічної будови тіла. Вимушене положення в ліжку через сильний біль у суглобах. Температура — 37,4 °С. Шкірні покриви бліді, висипань немає. Периферичні лімфовузли доступні пальпації, не збільшені, безболісні. Щитоподібна залоза при пальпації без особливостей. Аускультативно в легенях вислуховується везикулярне дихання на всьому протязі, хрипів немає, екскурсія легенів знижена через біль у грудній клітці. Межі серця не розширені. Серцеві тони ритмічні, звучні, незначний акцент ІІ тону на аорті. ЧСС — 84/хв, АТ — 140/90 мм рт.ст. Живіт бере участь в акті дихання, при пальпації м’який, безболісний. Печінка пальпується по краю реберної дуги, безболісна. Селезінка пальпаторно не досягається. Відрізки кишечника при пальпації без особливостей. Постукування по поперековій ділянці викликає біль, що пов’язаний із болем у хребті та ребрах. Сечовипускання вільне, без дизуричних явищ, однак пацієнт відзначає зменшення об’єму добової сечі за останній тиждень до 600–800 мл.
Опорно-руховий апарат. Відзначається артрит дрібних суглобів кистей ділянки п’ястка, зап’ястка, променево-зап’ясткового суглоба справа з вираженим набряком, локальним підвищенням температури, напруженням шкіри над ураженими суглобами (шкіра блищить, натягнута внаслідок набряку), із багряно-червоним забарвленням над цими ділянками, різким болем при торканні до суглобів, при найменших рухах і навіть при коливанні повітря над ураженими суглобами. Лівий колінний суглоб також значно набряклий, шкіра на дотик гаряча, з ділянками почервоніння, активні рухи практично відсутні через біль; пальпація суглоба викликає сильний біль. Спостерігається поліартикулярне ураження суглобів правої ступні: артрит І плеснофалангового суглоба та дрібних суглобів склепіння стопи, лівого та меншою мірою правого гомілковостопного суглобів. Суглоби припухлі, характерна зміна кольору шкіри над ураженими суглобами — багряно-червона, виражений больовий синдром. Периферичні тофуси відсутні. При пальпації грудної клітки та хребта відзначається локальна болючість вертебральних і паравертеральних точок у грудному та поперековому відділах хребта, болючість по ходу ребер.
Виражений гострий артрит із залученням типових суглобів (насамперед І плеснофалангового суглоба стопи, суглобів склепіння стопи), асиметричність уражень, значна вираженість запалення, типове яскраве забарвлення шкіри дозволило запідо–зрити подагричний генез суглобового синдрому. Проведена рентгенографія ступней у прямій проекції не виявила будь-яких специфічних симптомів, субкортикальні кісти без ерозій були відсутніми. Незважаючи на типову клінічну картину артриту, проведено пункцію колінного суглоба. При поляризаційній мікроскопії синовіальної рідини візуалізовані кристали мононатрієвого урату у великій кількості. Отже, діагноз гострого подагричного артриту було підтверджено.
При лабораторному обстеженні пацієнта виявлено синдром вираженої запальної реакції, нормо–хромну анемію, гіперурикемією та значне порушення функції нирок.
Загальний аналіз крові: еритроцити — 3,4 • 1012/л, гемоглобін — 102 г/л, лейкоцити — 9,8 • 109/л, тромбоцити — 218 • 109/л, гематокрит — 32 %, паличкоядерні нейтрофіли — 7 %, сегментоядерні нейтрофіли — 77 %, лімфоцити — 12 %, моноцити — 4 %, швидкість осідання еритроцитів (ШОЕ) — 58 мм/год.
У подальших аналізах крові спостерігалося наростання ШОЕ до 67 мм/год та зниження гемоглобіну до 93 г/л.
У біохімічному аналізі крові: загальний білок — 78 г/л, креатинін — 572 мкмоль/л, сечовина — 39,9 ммоль/л, сечова кислота — 638 мкмоль/л (при повторних визначеннях зафіксовано коливання рівнів сечової кислоти: від 636 до 712 мкмоль/л), калій — 6,3 ммоль/л, натрій — 137 ммоль/л, магній — 0,71 ммоль/л, неорганічний фосфор — 3,83 ммоль/л, загальний кальцій — 2,22 ммоль/л, лактатдегідрогеназа — 300,6 од/л. Інші біохімічні показники без патологічних відхилень.
Загальний аналіз сечі — 150 мл, колір жовтий, каламутна, відносна щільність — 1,009 г/мл, рН слабо кисла, білок — 1,3 г/л, глюкоза не виявлена, змінені еритроцити — 4–5 у п/з, лейкоцити — 6–7 у п/з, епітелій — плоский і перехідний у помірній кількості.
Швидкість клубочкової фільтрації за CKD-EPI — 8 мл/хв. Кількість білка в добовій сечі — 1,8 г.
Анамнестично було з’ясовано, що в листопаді 2016 р. (6 міс. тому) пацієнт проходив лікування в отоларингологічному відділенні з приводу риносинуситу, при цьому в лабораторних аналізах не було виявлено жодних відхилень: загальний білок — 61 г/л, креатинін — 82 мкмоль/л, сечовина — 7,8 ммоль/л, глюкоза — 5,0 ммоль/л. Визначення сечової кислоти не проводилося. Клінічних ознак подагри не було. У загальному аналізі сечі відзначалася незначна протеїнурія — 0,09 г/л.
З огляду на гострий подагричний артрит, що вперше виник, його тривкий поліартикулярний характер, швидке втягнення у процес нових суглобів, відсутність тофусів, високі значення рівня сечової кислоти під час гострого нападу, що перевищують 600 мкмоль/л (10 мг/дл), швидкий розвиток ниркової недостатності (упродовж 6 міс.) аж до термінальної стадії було висловлено припущення про вторинний характер подагри. Коло диференціальної діагностики звузилося до пошуку онкологічної та гематологічної патології. Зважаючи на біль у ребрах, грудній клітці загалом і в хребті, було проведено дообстеження для виключення множинної мієломи. Болі в хребті та ребрах турбували пацієнта впродовж останнього року, але були курабельними, не знижували якості життя; пацієнт пов’язував їх із остеохондрозом, спеціального обстеження не проводилося.
У добовій сечі не було виявлено білка Бенс-Джонса, у повторних біохімічних аналізах жодного разу не було зафіксовано високих рівнів загального білка, однак спостерігалася протеїнурія та швидкопрогресуюче ураження нирок.
Дослідження трубчастих кісток, у тому числі ребер, і хребта дозволили виявити типові ураження для множинної мієломи. На серії МР-томограм грудного та попереково-крижового відділів хребта визначається дифузна неоднорідна дрібновогнищева зміна МР-сигналу від усіх хребців на рівні обстеження, ребер, кісток таза, вогнищева зміна структури тіла L2 (гіперінтенсивний МР-сигнал на Т2-ЗЗ, Т1-ЗЗ), коміркової структури, розмірами 2,8 × 2,5 см.
Сонографія нирок: права нирка — 96 × 65 мм, ліва — 107 × 68 мм. В обох нирках визначаються кісти, у правій нирці субкапсулярно у верхньому відділі візуалізується кіста діаметром 11 мм, у середньому відділі — інтрапаренхіматозна кіста діаметром 7,7 мм; у лівій нирці — дві субкапсулярні кісти розмірами 12 та 18 мм, парапельвікальна кіста діаметром 14 мм.
Проведено стернальну пункцію кісткового мозку (від 27.06.2017 р.), виявлено значно підвищену кількість плазматичних клітин — 21,1 (норма 0,1–1,8). Після отримання результатів мієлограми був встановлений попередній діагноз множинної мієломи, проведено дослідження на М-градієнт і цитохімічне дослідження кісткового мозку та периферичної крові. При електрофорезі білків крові виявлено надвисокий рівень М-градієнта — 30,42 %. Цитохімічне дослідження кісткового мозку і периферичної крові, що проведено у відділенні онкогематології Інституту експериментальної патології, онкології та радіобіології ім. Р.Є. Кавецького НАН України, підтвердило діагноз множинної мієломи: у мазках периферичної крові спостерігається анемія, тромбоцити — 316 • 109/л, лейкоцити — 11 • 109/л, ШОЕ — 46 мм/год. У лейкограмі переважають плазматичні клітини та сегментоядерні нейтрофіли. У кістковому мозку звертає увагу наявність вогнищевих інфільтратів із плазматичних клітин. Проведені цитохімічні реакції на мієлопероксидазу та кислу фосфатазу підтвердили діагноз множинної мієломи.
Множинна мієлома — парапротеїнемічний гемобластоз, являє собою перманентно прогресуючу пухлину, що характеризується інфільтрацією кісткового мозку плазматичними клітинами, наявністю моноклонального імуноглобуліну в сироватці крові та сечі, а також супроводжується остеолітичним ураженнями кісток [3]. Множинна мієлома приблизно у 30 % випадків дебютує з ураження нирок [6]. Мієломна нефропатія (cast nephropathy) зумовлена нефротоксичністю легких ланцюгів імуноглобулінів, гіперкальціємією, гіперурикемією та відкладенням аномального парапротеїну. Клінічно мієломна нефропатія виявляється тривкою, ізольованою, значною протеїнурією з поступовим переходом у хронічну ниркову недостатність [6]. Однак у 9–25 % випадків мієломна нефропатія розпочинається з тяжкої ниркової недостатності, що вимагає застосування методів замісної ниркової терапії [7].
Як свідчать аналізи клінічних випадків, представлені eHealthMe на підставі звітів FDA (Food and Drug Administration) [2], подагра зустрічається серед пацієнтів із множинною мієломою, особливо у чоловіків віком понад 60 років. Так, у когорті 362 пацієнтів із множинною мієломою та проявами подагри було 69,47 % чоловіків і 30,53 % жінок. У віковому аспекті переважали пацієнти віком понад 60 років — 77,02 %, віком 50–59 років — 14,89 %. Серед топ-симптомів найперші позиції посідав біль (32,6 %), розлади настрою (29,28 %), біль у суглобах (26,8 %) та біль у грудній клітці (26,8 %).
Наведений клінічний випадок викликає інтерес тим, що множинна мієлома клінічно дебютувала з гострого подагричного артриту, що замаскував клінічні прояви швидкопрогресуючого ураження нирок та болів у кістках. У доступній науковій літературі ми знайшли тільки один опис подібного випадку [5]. Гострий подагричний артрит характеризувався певною атиповістю клінічного перебігу (поліартикулярний характер ураження при першому нападі подагри, втягнення суглобів верхніх кінцівок, відсутність периферичних і кісткових тофусів на фоні високих показників сечової кислоти, тривкий характер нападу та відсутність клінічного ефекту при застосуванні нестероїдних протизапальних препаратів), а також перебіг на фоні високих показників сечової кислоти в сироватці крові (максимальне значення — 712 мкмоль/л), що відразу наштовхнуло нас на думку про вторинний характер подагри. Власне перебіг мієломної хвороби характеризувався тяжким ураженням нирок і швидким формуванням ниркової недостатності, що розвинулася у пацієнта впродовж останніх 6 місяців. Значне порушення функції нирок зумовило також порушення пуринового обміну, стійку гіперурикемію та розвиток гострого подагричного артриту. Водночас дегідратація (спекотний період, лихоманка), прийом нестероїдних протизапальних препаратів (застосування диклофенаку через подагричний артрит) сприяли подальшому погіршенню функції нирок, розвитку гострої ниркової недостатності на фоні мієломної нефропатії.
Отже, у пацієнта верифіковано діагноз множинної мієломи із швикопрогресуючою нирковою недостатністю, що дебютувала як гострий подагричний артрит. У даний час розпочата специфічна терапія пацієнта згідно з чинними протоколами.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Коментар спеціаліста
Синяченко О.В.,
доктор медичних наук, професор, член-кореспондент НАМН України,
Донецький національний медичний університет, м. Лиман, Україна
Цікавий рідкісний випадок двох відносно поширених хвороб
(коментар до статті О.В. Гудим і співавт. «Гострий подагричний артрит і швидкопрогресуюча ниркова недостатність як маніфестація множинної мієломи: опис клінічного випадку»)
Подагра (від грецького ποδός «нога» і ἄγρα «пастка», «жертва») є «найдавнішим захворюванням суглобів», яке відзначено ще у Біблії, а в Талмуді згадувалося як «tzinit» (подагра) разом з «tzemirtha» (уролітіаз). Певні знання про подагру мали ще лікарі Стародавнього Єгипту, які називали її «хворобою королів», оскільки від неї у той час традиційно страждали люди, що мали високий соціальний статус. Термін «подагра» («капкан», «полювання», «здобич», «сильце») застосовувався Гіппократом (~460–370 до р.Х.) для позначення гострого запалення великого пальця ступні. До періоду Ренесансу в Європі фактично всі захворювання суглобів іменували «подагрою» (англійське gout, німецьке Gicht, французьке goutte, іспанське gota та італійське gotta, що походили від латинської gutta — «крапля»). Гален (~129–201) у II столітті описав «подагричні шишки» (тофуси), а Парацельс (1493–1541) першим звернув увагу на чіткий зв’язок подагри з патологією нирок, зокрема з сечокам’яною хворобою, відзначав наявність при цьому захворюванні «солей у порожнині суглобів» (!), що зараз є доведеним фактом, і це питання вже давно не обговорюється.
У 1947 році H.L. Jaffe [6] вказав на множинну мієлому як одну з причин порушень пуринового обміну з високим рівнем у крові сечової кислоти і частоти розвитку подагри, на що за два роки також звернув увагу D. Adlersberg [1]. У 1957 році J.R. Martin і L. Johnson [8] вже подали дані, згідно з якими гіпер–урикемію виявлено у 84 % від числа хворих на множинну мієлому (плазмоцитому). Цікаво, що в 1954 році D. Bronsky і A. Bernstein [4] описали при мієломній хворобі артрит, який трактували як «псевдоподагричний».
Наприкінці 70-х — на початку 80-х років ХХ століття стали окремо виділяти онкогематологічні захворювання (в тому числі множинну мієлому) як причини гіперурикемії та вторинної подагри [3, 9]. Нами також вивчався подагричний артрит, обумовлений плазматичними дискразіями, а в 1986 році описана вторинна подагра внаслідок макроглобулінемії Вальденстрьома [Тер. арх. — 58(7). — 135-7].
Безперечно, ми обговорюємо цікаве клінічне спостереження співробітників Київської лікарні «Феофанія», що відрізняється чималими особливостями перебігу вторинної подагри на фоні множинної мієломи і, на нашу думку, матиме у майбутньому певну значущість для лікарів нефрологів, ревматологів, гематологів. Головне, що авторами чітко доведено поєднану патологію у вигляді гострого подагричного артриту з наявністю гіперурикемії та кристалів мононатрієвого урату в синовіальній рідині й мієломної хвороби з високим рівнем плазматичних клітин у кістковому мозку і М-градієнта глобулінів у протеїнограмі крові. При цьому заслуговує на увагу незвичний характер суглобового та ниркового синдромів.
Особливістю ураження суглобів був поліартикулярний характер артриту із залученням у патологічний процес вже в маніфестному дебюті подагри зчленувань кистей, що на відміну від жінок зовсім не притаманно чоловікам. З 12 типових проявів подагричного артриту у хворого мали місце максимум запалення суглобів вже в перший день хвороби, наявність однобічних (асиметричних) ознак гиперемії шкіри та набрякання I плеснефалангового суглоба на фоні гіперурикемії.
Привертає до себе особливу увагу і швидкопрогресуюче ураження нирок. Безумовно, праві автори, що фоном для такого характеру перебігу нефропатії була латентна передіснуюча ниркова патологія, обумовлена мієломною хворобою. Уролітіазний тип подагричної нефропатії в процесі обстеження був виключений, а можливий подагричний гломерулонефрит не відповідав темпам прогресування нефропатії. Викладене давало підставу говорити про можливість гострого уратного обструктивного канальцієвого генезу ниркової патології (при добовому діурезі до 800 мл) із розвитком подагричного тубулоінтерстиціального нефриту.
Навряд можна було б передбачити таку «ниркову пожежу», скажімо, за півроку до госпіталізації пацієнта в клініку за відсутності значної гіперурикемії. Але даний випадок вимагає у подальшому обов’язкового обстеження хворих на можливу множинну мієлому з болем у кістках і з наявністю навіть невираженої протеїнурії, незважаючи на відсутність анемії та гіперпротеїнемії, а у разі діагностування плазмоцитоми, окрім іншого, доцільно виконувати динамічне дослідження параметрів урикемії й добової урикурії (урикозурії). Слід зазначити, що при вторинній подагрі, обумовленій злоякісними пухлинами легенів, шлунка, підшлункової залози і геніталій, ми спостерігали дещо несподіваний факт: у сироватці крові на фоні гіперурикемії та незміненого ниркового кліренсу сечової кислоти виявлялася висока активність таких ферментів пуринового метаболізму, як ксантиноксидаза й аденозиндезаміназа, при нормальних значеннях ксантиндезамінази. Ці дані в перспективі можна використовувати при обстеженні хворих на множинну мієлому з гіпер–урикемією.
Аналогічні клінічні випадки у майбутньому вимагатимуть невідкладного діалізного лікування, можливо, з гемосорбцією, а з огляду на основне захворювання подальша трансплантація нирки практично недоцільна. А що робити зі значною гіперурикемією? Урикодепресанти з групи інгібіторів ксантиноксидази (аналоги алопуринолу) теоретично можна використовувати лише в низьких дозах, які в такої категорії хворих, скоріше за все, будуть не ефективні та вельми токсичні, а всі без винятку урикозуричні засоби — протипоказані. Перспективним може бути лікування гіперурикемії у разі ниркової недостатності інгібітором ксантиноксиредуктази фебуксостатом (аденуриком), який бере участь в акселерації пуринів, піримідинів, птерину й альдегідних субстратів, а найголовнішим є факт незначної негативної дії цього урикодепресивного препарату на функцію нирок [5, 7, 10].