Актуальність
Сьогодні транзиторні ішемічні атаки (ТІА), як і мозкові інсульти (МІ), належать до невідкладних станів [1]. Захворюваність на ТІА коливається від 37 до 110 випадків на 100 тис. населення [2]. Так, у країнах Західної Європи захворюваність на ТІА становить 50 на 100 тис. населення (для порівняння: захворюваність на інсульт у цих же країнах — 200 на 100 тис. населення). Кожен рік 50 000 американців переносять ТІА, і в кожного третього хворого на інсульт у цій країні вони передують розвитку МІ. У середньому 2,3 % популяції населення щорічно захворюють на ТІА [3]. В Україні у 2015 році вперше захворіли на ТІА 36 583 жителі країни, що становить 104 випадки на 100 тис. населення. Слід відмітити, що майже 70 % з цієї кількості становили люди працездатного віку [4].
Головною відмінністю ТІА від ішемічного інсульту є короткостроковість розладів церебрального кровотоку та повна оборотність симптомів, що виникали. Однак ТІА значно підвищує ймовірність церебрального інсульту. Так, протягом 2 днів після ТІА ризик його розвитку становить від 2 до 4,1 %, протягом 7 днів — від 3,9 до 6,5 %, протягом 1 року — 12–20 %, а протягом 5 років — 10–12 % [5, 6]. Ризик розвитку МІ після ТІА прямо корелює з віком та частотою ТІА.
У даний час поняття ТІА переглядається провідними ангіоневрологами світу. Хронологія еволюції поглядів на поняття ТІА була такою. З 60-х років минулого століття й до початку 2000 року в усьому світі ТІА розглядалася як короткочасний епізод неврологічної дисфункції, викликаний фокальною церебральною або ретинальною ішемією, з клінічними симптомами, що тривають не більше ніж 24 години. У міру впровадження в клінічну практику нейровізуалізаційних методів обстеження, особливо в режимі дифузійно-зважених зображень, ставало ясно, що причиною багатьох ішемічних подій тривалістю до 24 годин є інфаркт мозку. За даними окремих дослідників, приблизно в третини пацієнтів, які традиційно належали до групи ТІА, при проведенні методів нейровізуалізації (магнітно-резонансної томографії (МТР)) у режимі дифузійно-зважених зображень виявлялися ознаки «свіжого» мозкового інфаркту. Ці знахідки підкреслювали невідповідність між класичним визначенням і патогенетичною концепцією ТІА (ішемія, що викликає симптоми, але не інфаркт!). Враховуючи це, група фахівців із цереброваскулярної патології у 2002 р. запропонувала нове, патогенетично обґрунтоване визначення: «ТІА — це короткочасний епізод неврологічної дисфункції, викликаної фокальною ішемією головного або спинного мозку або ішемією сітківки, при якому симптоми зберігаються зазвичай менше від 1 години й відсутні підтвердження при ней–ровізуалізації наявності гострого інфаркту».
Це нове визначення ТІА було схвалене багатьма експертами, одержало широке розповсюдження в клінічній практиці й використовувалося в низці масштабних клінічних досліджень. Однак не всі провідні ангіоневрологи світу й практичні лікарі були згодні з такою інтерпретацією. Верифікація діагнозу ТІА передбачала в екстреному порядку проведення нейровізуалізації, доступність та якість якої значно різняться не тільки в різних країнах, але й у різних регіонах однієї країни. Провідні експерти в галузі судинної патології головного мозку, обговоривши всі аргументи за і проти такого визначення ТІА, дійшли висновку про виключення часового (протягом однієї години) порогу й рекомендують нове визначення: ТІА —це минущий епізод неврологічної дисфункції, викликаної фокальною ішемією головного або спинного мозку або ішемією сітківки, без ознак гострого інфаркту мозку при проведенні ней–ровізуалізації [7]. Отже, в основу визначення поняття ТІА були покладені не часові, а морфологічні критерії.
ТІА розвивається при різних захворюваннях, що супроводжуються порушенням прохідності екстра- або інтракраніальних судин [8]. Найбільш часто вони спостерігаються при атеросклерозі, артеріальній гіпертензії (АГ), цукровому діабеті (ЦД), захворюваннях серця. Більш рідкісними етіологічними факторами є васкуліти, системні судинні захворювання. Певне значення мають вроджені аномалії будови судинного русла: коарктація аорти, гіпо- або аплазія церебральних артерій, патологічна звивистість судин. Останнім часом відзначається збільшення частоти ТІА, обумовлених екстравазальною компресією хребетних артерій патологічно зміненими шийними хребцями.
Як і ішемічні інсульти, ТІА може мати декілька механізмів розвитку: атеротромботичний, кардіоемболічний, лакунарний, криптогенний. ТІА можуть бути провісником усіх типів інсульту, але найчастіше передує розвитку атеротромботичного інсульту — у 25–50 % випадків. 11–30 % кардіоемболічних інсультів розвиваються на тлі попередніх ТІА. ТІА можуть відзначатися в 11–14 % хворих із лакунарними інсультами. У 9–11 % хворих з геморагічним інсультом ТІА передує розвитку катастрофи [9].
У пацієнтів, які перенесли ТІА, факторами підвищеного ризику інсульту є літній вік, артеріальна гіпертензія, цукровий діабет, ознаки значного атеросклеротичного стенозу артерій, превалювання в симптоматиці односторонньої слабкості, тривалість симптомів понад 10 хвилин (і особливо понад 1 годину). При цьому можуть використовуватися шкала ABCD 7-денного ризику (більше поширена в Європі) або Каліфорнійська модель оцінки 90-денного ризику (прийнята в США), хоча в цілому вони схожі [10, 11].
Існують також критерії, згідно з якими можна приблизно визначити, ризик якої цереброваскулярної події (повторної ТІА або інсульту) у даного пацієнта вище. Так, ризик розвитку інсульту протягом 90 діб після епізоду ТІА значно превалює над ризиком рецидиву ТІА у хворих із тривалістю симптомів понад 10 хвилин, при супутньому цукровому діабеті, меншою мірою — при односторонній слабкості, порушеннях мовлення. Ризик рецидиву ТІА перевищує ризик розвитку інсульту у випадку множинних ТІА в анамнезі, а також при появі сенсорних порушень. В осіб літнього віку (старше від 60 років) без інших ускладнюючих факторів ризик рецидиву ТІА та інсульту приблизно однаковий.
Де й коли повинні обстежуватись та лікуватись хворі з ТІА? У рекомендаціях Європейської інсультної організації, виданих ще в 2008 році, вказувалось на те, що хворі з підозрою на ТІА повинні бути госпіталізовані без зволікання в клініку для хворих з ТІА або відділення для лікування інсультів, у яких можливе проведення діагностичних процедур та надання екстреної допомоги [1]. Але з часом така жорстка тактика не виправдалась. На сьогодні єдиної точки зору відносно того, де і коли обстежувати хворого з ТІА — у стаціонарі чи амбулаторно, немає. Більшість спеціалістів вважає, що це залежить від 2 факторів — часу від початку захворювання та характеру неврологічної симптоматики [7]. В останніх рекомендаціях NICE [7], надрукованих у 2016 році, є такі роз’яснення. Хворі з ТІА у вигляді односторонніх парезів (обличчя, рука і/або нога) або порушень мовлення, які звернулись за допомогою протягом 48 годин від початку захворювання, вважаються категорією найбільш високого ризику інсульту (рівень В). Ці хворі підлягають негайній госпіталізації у відділення гострих порушень мозкового кровообігу (рівень С). Таким пацієнтам необхідне проведення ургентної нейровізуалізації (комп’ютерна томографія (КТ) або магнітно-резонансна томографія), ультразвукового дослідження судин голови та шиї, електрокардіографії (ЕКГ) (рівень В).
Пацієнти з ТІА у вигляді транзиторної або постійної симптоматики (гемігіпестезії, монокулярної сліпоти, геміанопсії, дисметрії), але без односторонніх парезів або порушень мовлення, які звернулись протягом 48 годин від початку захворювання, вважаються категорією високого ризику інсульту (рівень С). Ці хворі повинні бути направлені в день огляду до відділення гострого порушення мозкового кровообігу (рівень В). Таким хворим необхідне проведення нейровізуалізації (КТ або МРТ), ультразвукового дослідження судин голови та шиї, ЕКГ (рівень В). Пацієнти з ТІА у вигляді односторонніх парезів (обличчя, рука або нога) або порушень мовлення, які звернулися в період між 48 годинами і 2 тижнями від початку захворювання, вважаються категорією підвищеного ризику МІ (рівень В). Ці хворі повинні пройти комплексне клінічне обстеження у фахівців з ангіоневрології якомога швидше (але не пізніше від 24 годин із моменту звернення (рівень С)). Пацієнти з ТІА давністю понад 2 тижні від початку захворювання належать до хворих низького ризику інсульту й не вимагають проведення ургентних заходів (рівень С). Ці хворі повинні бути оглянуті фахівцем з ангіоневрології протягом 1 місяця з моменту звернення (рівень С). Пацієнти з атиповим порушенням чутливості (плямисте оніміння або поколювання) також не вимагають проведення ургентних заходів. Вони повинні бути оглянуті неврологом для визначення подальшої тактики лікування (рівень С).
Лікування хворих із ТІА включає негайне призначення аспірину (300 мг на добу) або клопідогрелю (300 мг на добу) з подальшим зниженням дози цих препаратів до 75–100 мг на добу у хворих із атеротромботичним, криптогенним та лакунарним підтипами ТІА [7]. Ефективною може бути комбінація аспірину з клопідогрелем, які можна застосовувати не довше від 90 днів (IIb, B). Рекомендоване призначення статинів (аторвастатин 20–40 мг на добу) [7].
Пацієнти з ТІА потребують динамічного спостереження з метою запобігання МІ.
Хворим із ТІА рекомендоване проведення заходів вторинної профілактики МІ [12]. Вони включають корекцію факторів судинного ризику (АГ, ЦД, паління, зловживання алкоголем тощо).
Хворим із фібриляцією передсердь показане призначення через 1 день після початку захворювання варфарину або нових пероральних антикоагулянтів (ривароксабан, дабігатран, апіксабан).
Пацієнтам із стенозами внутрішньої сонної артерії > 70 % показане проведення каротидної ендартеректомії протягом 7 днів від початку симптомів. Хворим із стенозами < 50 % не показане хірургічне лікування, їм необхідне проведення медикаментозного лікування (антигіпертензивна терапія, статини, дезагреганти) [12].
Отже, терапія ТІА має на меті купірування ішемічного процесу й швидке відновлення кровопостачання й метаболізму ішемізованої церебральної ділянки.
У хворих із ТІА, як показали проведені дослідження, спостерігаються когнітивні порушення різного ступеня вираженості, для корекції яких застосовують різні нейропротектори й метаболіти: цитиколін, церебролізин, енцефабол, семакс, актовегін, кортексин, пірацетам та інші.
До такої групи препаратів належать препарати Тіоцетам та Тіоцетам форте (корпорація «Артеріум»). Тіоцетам форте є таблетованою формою препарату Тіоцетам.
Тіоцетам/Тіоцетам форте — цереброактивний засіб, що має комплексний нейрометаболічний вплив. Тіоцетам/Тіоцетам форте — оригінальна комбінація тіотриазоліну та пірацетаму. Ефект його обумовлений взаємно потенційованою дією тіотриазоліну та пірацетаму, які знаходяться в структурі препарату в співвідношенні 1 : 4. Механізм дії препарату Тіоцетам/Тіоцетам форте обумовлений фармакологічними ефектами пірацетаму, а тіотриазолін, що має виражений антиоксидантний ефект, стабілізує клітинні мембрани в умовах ішемії й протидіє патологічному апоптозу. Подібний механізм дії забезпечує нейропротекторний ефект Тіотриазоліну, підтверджений результатами доклінічних досліджень.
Тіоцетам/Тіоцетам форте посилює метаболізм глюкози в реакціях аеробного та анаеробного окислення, нормалізує біоенергетичні процеси, підвищує рівень аденозинтрифосфату, стабілізує метаболізм у тканинах мозку. Тіоцетам/Тіоцетам форте гальмує утворення активних форм кисню, реактивує антиоксидантну систему ферментів, особливо супероксиддисмутазу, уповільнює вільнорадикальні процеси в тканинах мозку при ішемії, покращує реологічні властивості крові за рахунок активації фібринолітичної системи, стабілізує та зменшує зони некрозу й ішемії, підвищує концентрацію гамма-аміномасляної кислоти (ГАМК) в ішемізованих тканинах та підвищує інтенсивність роботи метаболічного ГАМК-шунта.
Такі властивості препарату сприяють покращенню інтегративної та когнітивної діяльності мозку, процесу навчання, підвищують показники коротко- й довгострокової пам’яті. Як показали проведені дослідження, Тіоцетам/Тіоцетам форте пом’якшує наслідки стресу (почуття тривоги, фобії, депресії, порушення сну), зменшує відставання у фізичному й розумовому розвитку недоношених дітей.
Ефективність препарату Тіоцетам/Тіоцетам форте щодо швидкого відновлення порушених унаслідок ТІА функцій досліджена недостатньо, що послужило мотивом для проведення нами даного клінічного дослідження щодо вивчення ефективності й безпечності препарату Тіоцетам/Тіоцетам форте у хворих із ТІА.
Мета дослідження: вивчити ефективність препаратів Тіоцетам/Тіоцетам форте у хворих, які перенесли транзиторну ішемічну атаку.
Завдання дослідження:
1. Оцінити ефективність та безпечність препарату Тіоцетам/Тіоцетам форте у хворих, які перенесли транзиторну ішемічну атаку.
2. Оцінити перевищуючу ефективність препарату Тіоцетам/Тіоцетам форте порівняно з базисною терапією в лікуванні хворих, які перенесли транзиторну ішемічну атаку.
Матеріали та методи
У дослідження були включені 40 хворих (23 чоловіки і 17 жінок) віком від 45 до 70 років, які перенесли ТІА. Пацієнти звернулись в клініку через 24–36 годин після ТІА й мали легкі та помірні когнітивні розлади (від 24 до 27 балів за шкалою Mini-mental State Examination (MMSE)).
Усім хворим проводили соматичне, неврологічне, психодіагностичне (з використанням шкали MMSE, батареї лобових тестів (FAB) для оцінки стану когнітивних функцій, шкали депресії Монтгомері — Асберг (MADRS)), нейровізуалізаційне (КТ, МРТ головного мозку), лабораторні обстеження.
КТ/МРТ-дослідження головного мозку проводили одразу після звернення пацієнтів. Проведення нейровізуалізації показало відсутність у хворих вогнищевих уражень, які б свідчили про наявність у них ішемічного інсульту.
Аналіз даних проводився за допомогою вбудованих засобів статистичного аналізу електронних таблиць Microsoft Excel і пакета прикладних програм SPSS 13.1.
Хворі були розподілені на дві групи — основну й контрольну, по 20 осіб у кожній (табл. 1).
Пацієнтам основної групи на тлі терапії, спрямованої на вторинну профілактику МІ, упродовж 12–14 діб призначали досліджуваний препарат Тіоцетам, розчин для ін’єкцій, внутрішньовенно краплинно по 20 мл у розведенні на 100 мл 0,9% розчину натрію хлориду 1 раз на добу. Швидкість введення — 40–60 крапель на хвилину. Рекомендувалося введення препарату в один і той же час доби (з інтервалом 24 години). З наступного дня після останньої ін’єкції препарату хворі переводились на прийом таблеток Тіоцетам форте, вкритих оболонкою, які приймалися перорально по 1 таблетці 3 рази на добу протягом як мінімум 14 діб.
Хворим контрольної групи проводили лише терапію, спрямовану на вторинну профілактику МІ. У процесі дослідження не дозволялося призначення: препаратів, що містять пірацетам і/або тіотриазолін, крім досліджуваних препаратів, а також ноотропних і нейропротективних, вазоактивних препаратів.
Було передбачено 5 візитів: скринінг, 1, 5, 12 (14) і 26-й (28-й) день дослідження. Загальна тривалість дослідження для пацієнта становила не більше ніж 30 діб.
Більшість ТІА розвивалися за атеротромботичним механізмом, рідше — за механізмом кардіоемболії (табл. 2).
Причиною кардіоемболічних ТІА були: фібриляція передсердь, мітральний стеноз, штучні клапани серця, перенесений інфаркт міокарда, дилатаційна кардіоміопатія. У ряді випадків ТІА розвивалися в результаті зриву авторегуляції мозкового кровообігу на тлі різких коливань артеріального тиску, що призводило до ураження дрібних інтрацеребральних артерій. Однак у 10–15 % випадків механізм ТІА визначити не вдалося.
Розподіл хворих за класифікаційною категорією (згідно з МКХ-10) подано в табл. 3.
Клінічна картина ТІА в обстежених хворих проявлялася різними як загальномозковими, так і вогнищевими симптомами й залежала від локалізації порушень церебрального кровотоку.
ТІА в каротидному басейні (40–45 %) характеризувалася раптовим зниженням зору чи повною сліпотою одного ока, порушенням рухової й чутливої функції однієї або обох кінцівок протилежного боку, іноді судомами в них.
ТІА у вертебробазилярному басейні (30–35 %) супроводжувалася минущою вестибулярною атаксією й мозочковим синдромом. Пацієнти відзначали хиткість ходи, нестійкість, запаморочення, нечіткість мовлення (дизартрію), диплопію та інші порушення зору, симетричні або односторонні рухові та сенсорні порушення.
При ТІА в зоні кровопостачання артерії сітківки, циліарної або очноямкової артерії (10–15 %) виникав синдром скороминущої сліпоти — короткострокової (зазвичай на кілька секунд) втрати зору, частіше на одне око. Пацієнти описували подібну ТІА як спонтанне виникнення «затулки» або «штори», насунутої на очі знизу або зверху. Іноді втрата зору стосувалася лише верхньої або нижньої половини зорового поля.
У 10–15 % хворих відмічалися ТІА у вигляді транзиторної глобальної амнезії — раптової втрати короткочасної пам’яті при збереженні спогадів про минуле. Такі ТІА супроводжувалися розгубленістю, схильністю повторювати вже поставлені запитання, неповною орієнтацією в обстановці. Найчастіше вони виникали при впливі таких факторів, як біль, психоемоційне перенапруження. Тривалість епізоду амнезії варіювала від 20–30 хвилин до декількох годин, після чого відзначалося повне відновлення пам’яті.
Залежно від клінічної тяжкості (табл. 4) виділяли легкі ТІА тривалістю до 10 хвилин, ТІА середньої тяжкості тривалістю до декількох годин і тяжкі ТІА, що тривали 12–24 години.
Результати
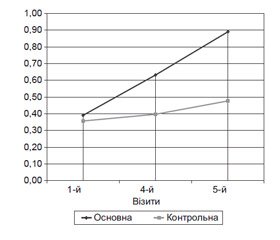
Основні показники когнітивних функцій у динаміці, що визначалися за допомогою шкали MMSE, подані на рис. 1.
Показники стану пацієнтів за шкалою MMSE статистично значимо більші (р < 0,001) на 3, 4 і 5-му візитах порівняно з 1-м візитом в обох групах, що свідчить про покращання психічного статусу пацієнтів у процесі спостереження. Так, якщо на 1-му візиті відмінності між групами за категоріальними оцінками психічного статусу пацієнтів статистично значуще не розрізнялися (р = 1,000), то на 4-му й 5-му візитах були виявлені статистично значущі відмінності (р = 0,029 на 4-му візиті; р = 0,025 на 5-му візиті) на користь основної групи порівняно з контрольною, що свідчить про більш виражений вплив лікування із застосуванням препарату Тіоцетам/Тіоцетам форте на покращання психічного статусу пацієнтів, оцінюваного за шкалою MMSE.
Оцінка стану когнітивних функцій також проводилася за допомогою шкали FAB. Динаміка середніх показників за шкалою FAB подана на рис. 2.
Як і за показниками шкали MMSE, стан когнітивних функцій пацієнтів за шкалою FAB статистично значимо кращий (р < 0,001) на 3, 4 і 5-му візитах порівняно з 1-м візитом в обох групах. Разом з тим виявлені відмінності між групами. Якщо на 1-му візиті спостерігалися відмінності між групами на користь контрольної групи (p = 0,045) порівняно з основною, то на 5-му візиті, навпаки, були виявлені статистично значущі відмінності на користь основної групи (р < 0,001) порівняно з контрольною, що свідчить про більш виражений вплив лікування із застосуванням препарату Тіоцетам/Тіоцетам форте на покращання стану пацієнтів, оцінюваного за шкалою FAB.
Психоемоційний стан хворих оцінювався за допомогою шкали депресії MADRS. Динаміка середніх значень оцінок стану пацієнтів за шкалою MADRS в обох групах подана на рис. 3.
Вираженість депресії за шкалою MADRS статистично значимо менша (р < 0,001) на 3, 4 і 5-му візитах порівняно з 1-м візитом в обох групах. Категоріальні оцінки шкали MADRS показують тенденцію до зниження рівня депресії в обох групах. Однак в основній групі починаючи з 3-го візиту спостерігаються статистично значимо кращі результати (р = 0,006 на 3-му візиті, р < 0,001 на 4-му й 5-му візитах) порівняно з контрольною групою, що свідчить про більш виражений вплив лікування із застосуванням препарату Тіоцетам/Тіоцетам форте на зменшення депресії.
Одним з критеріїв оцінки ефективності препарату Тіоцетам/Тіоцетам форте були лабораторні показники, що характеризують стан перекисного окислення ліпідів: малоновий діальдегід (МДА), дієнові кон’югати (ДК) та стан антиоксидантної системи (АОС): супероксиддисмутаза (СОД), каталаза крові.
Динаміка середніх значень МДА, ДК, СОД і каталази подана на рис. 4–7.
Результати проведених біохімічних досліджень свідчать про таке. Відносне зниження МДА і ДК на 4-му і 5-му візитах порівняно з 1-м візитом в основній групі статистично значимо більше (р < 0,001), ніж у контрольній групі, що свідчить на користь більшої ефективності терапії із застосуванням препарату Тіоцетам/Тіоцетам форте.
Відносне збільшення СОД і каталази на 4-му і 5-му візитах порівняно з 1-м візитом в основній групі статистично більш значиме (р < 0,001), ніж у контрольній групі, що також свідчить на користь більшої ефективності терапії із застосуванням препарату Тіоцетам/Тіоцетам форте.
Безпека препарату Тіоцетам/Тіоцетам форте оцінювалася на підставі скарг пацієнтів, перебігу захворювання й лабораторних досліджень.
У процесі лікування в 4 пацієнтів (10 %) в основній групі розвинулися побічні реакції (ПР)/побічні явища (ПЯ) у вигляді сухості в роті, діареї, легкого головного болю, нудоти, інсомнії, тривожності. Ці ПР/ПЯ були несерйозними, легкого та середнього ступеня тяжкості, не вимагали відміни препарату.
Ґрунтуючись на даних аналізу крові, сечі, печінкових проб, можна констатувати, що істотного негативного впливу проведеного лікування на показники біохімічного аналізу крові в процесі лікування виявлено не було, що свідчить про добру переносимість випробуваного препарату.
Загальна оцінка переносимості препарату Тіоцетам/Тіоцетам форте у досліджених хворих подана в табл. 5.
Як видно із табл. 5, переносимість препарату була доброю (у 90 % хворих) або задовільною (у 10 % хворих).
Висновки
Отже, проведене дослідження показало, що для більш повного та швидкого відновлення когнітивних порушень у хворих із перенесеними ТІА може бути рекомендована терапія препаратом Тіоцетам/Тіоцетам форте.
Лікування препаратами Тіоцетам/Тіоцетам форте при ТІА дозволяє вірогідно прискорити відновлення порушених неврологічних функцій і покращити когнітивні функції.
Препарати Тіоцетам/Тіоцетам форте знижують активність процесів перекисного окислення ліпідів, про що свідчить зниження показників малонового діальдегіду та дієнових кон’югат, і активують антиоксидантну систему, що характеризується підвищенням значень супероксиддисмутази й каталази.
Застосування препаратів Тіоцетам/Тіоцетам форте при ТІА є безпечним і добре переноситься хворими.
Конфлікт інтересів. Не заявлений.

/28-1.jpg)
/29-1.jpg)
/29-2.jpg)
/29-3.jpg)
/30-1.jpg)
/30-2.jpg)
/30-3.jpg)
/30-4.jpg)
/31-1.jpg)
/31-2.jpg)