Резюме
Актуальність. У літературі обговорюється застосування метаболічної терапії в пацієнтів із кардіологічною патологією, у тому числі вплив такої терапії на функцію ендотелію. Одним із найбільш популярних метаболічних препаратів є мельдоній. Метою нашого дослідження було вивчити вплив мельдонію в пацієнтів з артеріальною гіпертензією (АГ) та ішемічною хворобою серця (ІХС) на рівень артеріального тиску (АТ) та цитруліну крові через 1 місяць терапії. Первинною кінцевою точкою були зміни рівня цитруліну крові в пацієнтів групи комбінованої терапії із застосуванням мельдонію (препарат Тризипін для ін’єкцій та таблетки Тризипін лонг). Вторинною кінцевою точкою було зниження та досягнення цільового рівня АТ (< 140/90 мм рт.ст.), покращення якості життя за опитувальником EQ-5D, зміни еректильної функції в чоловіків, покращення прихильності до лікування. Матеріали та методи. Ми проводили спостереження за 38 хворими з АГ та ІХС (24 чоловіки, 14 жінок). Усіх пацієнтів було розподілено на 2 групи терапії. Хворим першої групи (n = 20) призначалася базова терапія АГ та ІХС із додаванням Тризипіну внутрішньовенно протягом 10 днів, далі призначався Тризипін лонг у дозі 1000 мг один раз на добу протягом 1 місяця (виробництва компанії «Мікрохім», Україна). Хворим другої групи (n = 18) призначалася базова терапія АГ та ІХС без додавання Тризипіну. Контрольну групу становили 7 практично здорових осіб. Перед початком лікування та через 1 місяць терапії пацієнти проходили обстеження, що включало електрокардіографію, офісне вимірювання АТ, добове моніторування АТ, ехокардіографію, лабораторне дослідження крові (загальний аналіз крові, К, Na, білірубін, креатинін, кліренс креатиніну, глюкоза, аланінамінотрансфераза, аспартатамінотрансфераза, холестерин, тригліцериди, холестерин ліпопротеїдів високої щільності, холестерин ліпопротеїдів низької щільності, холестерин ліпопротеїдів дуже низької щільності, визначення вмісту L-цитруліну в плазмі крові), заповнення опитувальників: якості життя EQ-5D, прихильності до лікування, еректильної функції в чоловіків («Міжнародний індекс еректильної функції»). Результати. Середній вік хворих становив 60,43 ± 1,80 року. Середній індекс маси тіла — 28,60 ± 0,90 кг/м2. Середні цифри офісного систолічного (САТ) та діастолічного АТ (ДАТ) на початку дослідження становили 147,03 ± 2,79 мм рт.ст. та 85,34 ± 1,54 мм рт.ст. відповідно. Середня офісна частота серцевих скорочень (ЧСС) — 71,31 ± 1,71 уд/хв. Середні рівні АТ при амбулаторному моніторуванні становили для САТ 128,36 ± 2,45 мм рт.ст., для ДАТ — 78,95 ± 1,72 мм рт.ст. Середня добова ЧСС — 72,41 ± 1,57 уд/хв. У групі базового лікування рівень цитруліну крові достовірно підвищився з 34,36 ± 1,29 мкмоль/л до 41,31 ± 1,51 мкмоль/л (р < 0,05), а в групі пацієнтів, які лікувалися Тризипіном, рівень цитруліну достовірно зменшився з 33,43 ± 1,71 мкмоль/л до 29,33 ± 1,42 мкмоль/л (р < 0,05). Ми порівняли початковий рівень цитруліну в групах лікування та групі практично здорових осіб. Рівні цитруліну в пацієнтів з АГ та ІХС були достовірно вищими порівняно з групою практично здорових осіб — 33,89 ± 1,69 мкмоль/л проти 25,73 ± 1,70 мкмоль/л відповідно (р < 0,05). При порівнянні кінцевих рівнів цитруліну після лікування ми відмітили, що в групі пацієнтів, які лікувалися Тризипіном, рівень цитруліну в кінці лікування наблизився до рівня цитруліну практично здорових осіб, у той час як у групі базової терапії рівень цитруліну значно виріс та достовірно відрізнявся від показника контрольної групи. Прихильність до лікування покращилася лише в групі Тризипіну (р = 0,03). Змін еректильної функції в обох групах не було. Покращувалася якість життя за EQ-5D за рахунок зниження тривоги та депресії в групі Тризипіну. Висновки. Комбінована терапія, що включала Тризипін для ін’єкцій та таблетки Тризипін лонг, сприяла зниженню офісного АТ у пацієнтів з АГ та ІХС, зменшенню рівня цитруліну крові; а також забезпечила покращення якості життя за рахунок зниження тривоги та депресії. Додавання Тризипіну до базової терапії покращувало прихильність до лікування в пацієнтів з АГ та ІХС порівняно з групою базової терапії.
Актуальность. В литературе обсуждается применение метаболической терапии у пациентов с кардиологической патологией, в том числе влияние такой терапии на функцию эндотелия. Одним из самых популярных метаболических препаратов является мельдоний. Целью нашего исследования было изучить влияние мельдония у пациентов с артериальной гипертензией (АГ) и ишемической болезнью сердца (ИБС) на уровень артериального давления (АД) и уровень цитруллина крови через 1 месяц терапии. Первичной конечной точкой были изменения уровня цитруллина крови у пациентов в группе комбинированной терапии с применением мельдония (препарат Тризипин для инъекций и таблетки Тризипин лонг). Вторичной конечной точкой было снижение и достижение целевого уровня АД (< 140/90 мм рт.ст.), улучшение качества жизни по опроснику EQ-5D, изменение эректильной функции у мужчин, улучшение приверженности к лечению. Материалы и методы. Мы наблюдали 38 больных с АГ и ИБС (24 мужчины, 14 женщин). Все пациенты были разделены на 2 группы терапии. Больным первой группы (n = 20) назначалась базовая терапия АГ и ИБС с добавлением Тризипина на протяжении 10 дней, затем назначался Тризипин лонг в дозе 1000 мг один раз в сутки в течение 1 месяца (производства компании «Микрохим», Украина). Больным второй группы (n = 18) назначалась базовая терапия АГ и ИБС без добавления Тризипина. Контрольную группу составили 7 практически здоровых лиц. Перед началом лечения и через 1 месяц терапии пациенты проходили обследование, включавшее электрокардиографию, офисное измерение АД, суточное мониторирование АД, эхокардиографию, лабораторное исследование крови (общий анализ крови, К, Na, билирубин, креатинин, клиренс креатинина, глюкоза, аланинаминотрансфераза, аспартатаминотрансфераза, холестерин, триглицериды, холестерин липопротеидов высокой плотности, холестерин липопротеидов низкой плотности, холестерин липопротеидов очень низкой плотности, определение содержания L-цитруллина в плазме крови), заполнение опросников: качества жизни EQ-5D, приверженности к лечению, эректильной функции у мужчин (Международный индекс эректильной функции). Результаты. Средний возраст больных составил 60,43 ± 1,80 года. Средний индекс массы тела — 28,60 ± 0,90 кг/м2. Средние цифры офисного систолического (САД) и диастолического АД (ДАД) в начале исследования составили 147,03 ± 2,79 мм рт.ст. и 85,34 ± 1,54 мм рт.ст. соответственно. Средняя офисная частота сердечных сокращений (ЧСС) — 71,31 ± 1,71 уд/мин. Средние уровни АД при амбулаторном мониторировании составляли для САД 128,36 ± 2,45 мм рт.ст., для ДАД — 78,95 ± 1,72 мм рт.ст. Средняя суточная ЧСС — 72,41 ± 1,57 уд/мин. В группе базового лечения уровень цитруллина крови достоверно повысился с 34,36 ± 1,29 мкмоль/л до 41,31 ± 1,51 мкмоль/л (р < 0,05), а в группе пациентов, лечившихся Тризипином, уровень цитруллина достоверно уменьшился с 33,43 ± 1,71 мкмоль/л до 29,33 ± 1,42 мкмоль/л (р < 0,05). Мы сравнили начальный уровень цитруллина в группах лечения и группе практически здоровых лиц. Уровни цитруллина у пациентов с АГ и ИБС были достоверно выше, чем в группе практически здоровых лиц — 33,89 ± 1,69 мкмоль/л против 25,73 ± 1,70 мкмоль/л соответственно (р < 0,05). При сравнении конечных уровней цитруллина после лечения мы заметили, что в группе пациентов, лечившихся Тризипином, уровень цитруллина в конце лечения приблизился к уровню цитруллина практически здоровых лиц, в то время как в группе базисной терапии уровень цитруллина значительно вырос и достоверно отличался от контрольной группы. Приверженность к лечению улучшилась только в группе Тризипина (р = 0,03). Изменений эректильной функции в обеих группах не было. Улучшалась качество жизни по EQ-5D за счет снижения тревоги и депрессии в группе Тризипина. Выводы. Лечение на основе Тризипина способствовало снижению офисного АД у пациентов с АГ и ИБС, уменьшению уровня цитруллина крови; улучшалось качество жизни за счет снижения тревоги и депрессии. Добавление Тризипина к базовой терапии улучшало приверженность к лечению у пациентов с АГ и ИБС по сравнению с группой базовой терапии.
Background. The literature discusses the use of metabolic therapy in patients with cardiological disorders, including the impact of such therapy on endothelial function. One of the most popular metabolic drugs is meldonium. The aim of our study was to examine the effect of meldonium in patients with arterial hypertension (AH) and coronary heart disease (CHD) on the levels of blood pressure (BP) and citrulline in the blood after 1 month of therapy. The primary endpoint was changes in blood levels of citrulline in patients from the group of combination therapy using meldonium (Trizipin for injections and pills Trizipin Long). Secondary endpoints were reduction and achievement of target BP (< 140/90 mmHg), improved quality of life according to EQ-5D questionnaire, changes in erectile function in men, improved adherence to treatment. Materials and methods. We have examined 38 patients with AH and CHD (24 men, 14 women). All patients were divided into 2 groups of therapy. Patients of the first group (n = 20) received basic treatment for AH and CHD with addition of Trizipin intravenously for 10 days, then Trizipin Long was administered at a dose of 1,000 mg once daily for 1 month (manufactured by Microkhim company, Ukraine). Patients of the second group (n = 18) received basic treatment for AH and CHD without Trizipin. The control group consisted of 7 apparently healthy people. Before treatment and 1 month after, patients underwent examinations, such as electrocardiography, office BP measuring, ambulatory BP monitoring, echocardiography, laboratory blood tests (complete blood count, K, Na, bilirubin, creatinine, creatinine clearance, glucose, alanine aminotransferase, aspartate aminotransferase, cholesterol, triglycerides, high-density lipoprotein cholesterol, low-density lipoprotein cholesterol, very-low-density lipoprotein cholesterol, L-citrulline levels in the blood plasma), filled out quality of life questionnaire EQ-5D, adherence to treatment questionnaire, questionnaire of erectile function in men (The international index of erectile function). Results. The average age of patients was 60.43 ± 1.80 years. The average body mass index — 28.60 ± 0.90 kg/m2. The average office systolic (SBP) and diastolic BP (DBP) at baseline was 147.03 ± 2.79 mmHg and 85.34 ± 1.54 mmHg. The average office heart rate (HR) — 71.31 ± 1.71 bpm. Mean BP levels during ambulatory monitoring were: SBP — 128.36 ± 2.45 mmHg, DBP — 78.95 ± 1.72 mmHg. The average daily HR — 72.41 ± 1.57 bpm. In the group of basic treatment, blood citrulline level significantly increased from 34.36 ± 1.29 µmol/l to 41.31 ± 1.51 µmol/l (p < 0.05), and in the group of patients treated with Trizipin citrulline levels significantly decreased from 33.43 ± 1.71 µmol/l to 29.33 ± 1.42 µmol/l (p < 0.05). We compared the initial level of citrulline in the treatment groups and the group of apparently healthy individuals. Citrulline levels in patients with AH and CHD were significantly higher compared with the group of apparently healthy individuals — 25.73 ± 1.70 µmol/l vs 33.89 ± 1.69 µmol/l in the group of patients with AH and CHD (p < 0.05). When comparing the final levels of citrulline after treatment, we noticed that in the group of patients treated with Trizipin levels of citrulline in the end of therapy were close to that of in apparently healthy people, while in the group of basic treatment, citrulline level increased substantially and was significantly different from the control group. Adherence to treatment has improved only in Trizipin group (p = 0.03). There were no changes in erectile function in both groups. The quality of life according to the EQ-5D has improved due to the reduction of anxiety and depression in Trizipin group. Conclusions. Treatment based on Trizipin contributed to the reduction of office BP in patients with AH and CHD, decrease of blood citrulline; quality of life was better due to the reduction of anxiety and depression. Adding Trizipin to the basic therapy has improved adherence to treatment in patients with AH and CHD compared to the group of basic therapy.
Вступ
У літературі обговорюється застосування метаболічної терапії в певних категорій кардіологічних хворих, у тому числі вплив такої терапії на функцію ендотелію [1]. Роль ендотелію полягає в підтриманні гомеостазу шляхом зберігання рівноваги між різнонаправленими процесами. Ендотелій бере участь у регуляції вазоконстрикції та вазодилатації, сприяє вивільненню судинорозширюючих та судинозвужуючих факторів, бере участь у регуляції судинної проникності, виробленні про- та протизапальних факторів, синтезі та пригніченні факторів проліферації й факторів агрегації тромбоцитів. Вивчення ролі ендотелію в патогенезі серцево-судинних захворювань сприяло формуванню концепції, що розглядає ендотелій як мішень для профілактики та лікування процесів, які формують серцево-судинну патологію. Фармакологічні методи корекції ендотеліальної дисфункції у хворих на артеріальну гіпертензію (АГ) та ішемічну хворобу серця (ІХС) направлені на зменшення негативних впливів на ендотеліальну стінку судин за рахунок зниження артеріального тиску (АТ), нормалізації ліпідного профілю крові та синтезу ендотеліальними клітинами оксиду азоту (NO).
Одним з найбільш популярних метаболічних препаратів є мельдоній. Механізм дії мельдонію обумовлений пригніченням окислення жирних кислот (ЖК). Вважається, що обмеження потоку ЖК через мембрану мітохондрій захищає клітину від загибелі в умовах ішемії та гіпоксії. ЖК у нормі є базовим субстратом, на основі якого в мітохондріях синтезується до 80 % енерговмісних сполук у вигляді молекул аденозинтрифосфату (АТФ). Останні 20 % АТФ утворюються за рахунок переважного окислення глюкози. Метаболізм глюкози можливий як за участю кисню (аеробний гліколіз), так і без нього (анаеробний гліколіз) [2, 6, 10].
Мельдоній сприяє пригніченню гамма-бутиробетаїн-гідроксилази, що перетворює гамма-бутиробетаїн (ГББ) у карнітин. У результаті поступово, приблизно протягом 10 днів, відбувається зниження концентрації карнітину та накопичення гамма-бутиробетаїну, через це знижується концентрація карнітину (який забезпечує транспорт жирних кислот), що призводить до зниження бета-окислення жирних кислот за рахунок блокади їх надходження в мітохондрії. Зазначені процеси забезпечують оптимізацію енергопродукції в клітинах у зонах ішемії за рахунок компенсаторної активації аеробного гліколізу на тлі опосередкованого пригнічення мельдонієм бета-окислення жирних кислот, оскільки підвищення концентрації жирних кислот у цитоплазмі клітин стимулює мітохондріальне окислення глюкози. Гамма-бутиробетаїн, взаємодіючи з рецепторами ендотелію судин, активує процеси біосинтезу NO, що сприяє вазодилатації, зниженню периферичного опору, артеріального тиску, запобіганню індукованим норадреналіном та ангіотензином вазоспастичним реакціям, зниженню агрегації тромбоцитів [2, 3, 23].
Не тільки NO відіграє важливу роль у регулюванні судинного тонусу. З молекули амінокислоти L-аргініну під впливом ферментної системи –NO-синтази (NOS) утворюються два кінцеві продукти — NO та L-цитрулін. Структура L-цитруліну та L-аргініну дуже подібна. Якщо L-цитрулін не вивільняється вчасно, накопичення цитруліну конкурентно інгібує центр ферментної активності NOS, що пригнічує утворення NO. За цих умов частина L-цитруліну може перетворюватися в L-аргінін за допомогою аміносукцинатсинтази та аргінінсукцинатліази в так званому цитрулін-NO-циклі [7, 19, 27–29].
Цитрулін — це амінокислота. Існує 20 стандартних амінокислот. Цитрулін — це нестандартна амінокислота. Цитрулін був уперше виділений із соку кавуна (citrullus vulgaris) і досліджений у 1930-х роках. Цитруліну в організмі не вистачає в людей, які постійно дотримуються дієти. На відміну від інших амінокислот цитрулін не задіяний у синтезі білка. Тривалий час вважалося, що його єдиною функцією є участь у метаболізмі сечовини. Однак дані недавніх досліджень довели його роль у регуляції синтезу NO [11, 27]. Цитрулін, який можна розглядати як опосередкований попередник у процесі синтезу NO, має потужні антиоксидантні властивості. Основна кількість цитруліну синтезується в кишечнику з амінокислоти глутаміну, що надходить із їжею. Частково він може синтезуватися в самому кишечнику з амінокислоти аргініну. Однак в ентероцитах цитрулін не може використовуватись через низьку активність ферментів, що забезпечують його подальші перетворення. У зв’язку з цим цитрулін, що вивільнився з кишечника, потрапляє в кров, звідки захоплюється нирками, у яких й відбувається його перетворення на амінокислоту аргінін.
У пацієнтів із хронічною серцевою недостатністю позитивний ефект мельдонію пояснюється покращенням енергетичного метаболізму міокарда та відновленням ендотеліальної функції за рахунок стимуляції синтезу NO [4]. В експерименті показано, що, обмежуючи транспорт та окислення жирних кислот, можна адаптувати кардіоміоцити та клітини мозку до умов гіпоксії. Продемонстровано, що прийом мельдонію ефективно захищає ішемізовані клітини міокарда від загибелі в умовах гострої ішемії. Y. Hayashi зі співавт. спостерігали збільшення тривалості життя експериментальних тварин із серцевою недостатністю після інфаркту міокарда (ІМ) під впливом мельдонію [22].
У проспективних дослідженнях з вивчення метаболізму аргініну показано, що концентрація аргініну крові значно зменшується при септичних станах. Метааналіз 341 пацієнта продемонстрував, що в пацієнтів із септичним станом концентрація аргініну плазми була на 41 % менше, ніж у контрольній групі. Однак клінічні рандомізовані дослідження показали, що вживання аргініну не сприяє достовірному зменшенню госпітальної смертності та інфекційних ускладнень [17].
S. Jaisson зі співавт. вивчали рівень цитруліну в пацієнтів з ураженням коронарних артерій. У 109 пацієнтів після коронарографії визначали рівень цитруліну крові. У пацієнтів з тяжким ураженням коронарних артерій рівень цитруліну крові був достовірно вищим порівняно з контрольною групою та пацієнтами без ураження коронарних артерій. Автори роблять висновок, що висока концентрація цитруліну крові є предиктором наявності ураження коронарних артерій (78,9% чутливість та 78,8% специфічність). Регресійний аналіз показав, що рівень цитруліну крові достовірно та незалежно асоціюється з наявністю ураження коронарних артерій та кількістю стенотичних уражень коронарних артерій [20].
Аргінін є одним із ключових субстратів для синтезу NO, тому його метаболіти, до яких належить і цитрулін, впливають на контроль АТ, серцево-судинні захворювання та хронічну хворобу нирок (ХХН). Оскільки серцево-судинні захворювання є причиною смерті пацієнтів із ХХН, важливо знати ранні субклінічні ознаки серцево-судинної захворюваності на ранніх стадіях розвитку хвороби в дитинстві. Оцінка жорсткості судин та добове моніторування АТ дозволяють раніше виявити серцево-судинні захворювання. Так, I.C. Lin зі співавт. вивчали концентрацію цитруліну, аргініну в сечі та їх зв’язок із рівнем АТ і судинним ураженням у підлітків із ХХН на ранній стадії захворювання. У дослідження було включено 55 пацієнтів, у яких у 75 % випадків виявлено підвищення АТ за даними добового моніторування, з них 35 % — non-dipper. Низький рівень цитруліну сечі та співвідношення цитрулін/аргінін сечі були пов’язані з навантаженням тиском у підлітків із початковою стадією ХХН. Співвідношення цитрулін/аргінін сечі було пов’язане з жорсткістю судин, а саме зі швидкістю поширення пульсової хвилі (ШППХ) та індексом аугментації. Автори цього дослідження дійшли висновку, що рання діагностика АГ, яка базується на визначенні рівня цитруліну й ШППХ, та вчасно розпочате лікування сприяють зниженню АТ та перешкоджають ранньому ремоделюванню судин у підлітків із ХХН [24].
На сьогодні вивчення рівня цитруліну крові в пацієнтів з АГ та ІХС на фоні лікування Тризипіном (мельдонієм) в Україні не проводилося. Отже, метою даного дослідження було оцінити дію мельдонію (таблетки Тризипін лонг 1000 мг та розчин Тризипін 100 мг/мл по 5 мл виробництва компанії «Мікрохім», Україна) на антигіпертензивну ефективність базової терапії та рівень цитруліну крові через 1 місяць лікування хворих з артеріальною гіпертензією I–ІІ ступеня та супутньою ішемічною хворобою серця зі стабільною стенокардією напруги II–III функціонального класу (ФК) без клінічних симптомів серцевої недостатності. ІХС підтверджена візуалізацією, реваскуляризацією чи перенесеним інфарктом міокарда, з часу якого минуло понад 6 місяців, зі збереженою систолічною функцією лівого шлуночка, позитивною навантажувальною пробою з дозованим фізичним навантаженням: наявність косонизхідної або горизонтальної депресії сегмента ST ≥ 2 мм протягом 0,08 с після точки J у поєднанні із загрудинним болем або без нього в пацієнта без патологічних змін сегмента ST у спокої.
Матеріали та методи
У дослідження було включено 38 пацієнтів з АГ та ІХС: середній рівень офісного систолічного (офСАТ)/діастолічного (офДАТ) артеріального тиску на початку дослідження — 147,03/85,34 ± 2,79/1,54 мм рт.ст. Середній вік хворих становив 60,43 ± 1,80 року.
Завдання дослідження:
1) вивчити вплив препарату Тризипін лонг на рівень цитруліну крові через 4–6 тижнів лікування;
2) вивчити потенціюючу антигіпертензивну дію препарату Тризипін лонг у хворих із артеріальною гіпертензією I–ІІ ст. та супутньою ішемічною хворобою серця;
3) вивчити вплив препарату Тризипін лонг на клінічний стан, показники артеріального тиску при добовому моніторуванні;
4) вивчити переносимість та можливі побічні ефекти препарату Тризипін лонг.
Первинною кінцевою точкою були зміни рівня цитруліну крові в пацієнтів групи комбінованої терапії із застосуванням мельдонію (препарат Тризипін для ін’єкцій та таблетки Тризипін лонг).
Вторинною кінцевою точкою було зниження та досягнення цільового рівня АТ (< 140/90 мм рт.ст.), покращення якості життя, зміни еректильної функції в чоловіків, покращення прихильності до лікування.
Критерії включення.
— чоловіки й жінки віком 35–65 років;
— артеріальна гіпертензія I–II ступеня в поєднанні з хронічною ішемічною хворобою серця: стенокардія напруження II–III ФК за класифікацією Канадського товариства кардіологів без клінічних ознак серцевої недостатності (фракція викиду ≥ 41 %) із задокументованим ІМ, перенесеним понад 6 місяців тому, або наявність візуально підтвердженого значущого стенозу хоча б однієї коронарної артерії понад 50 % діаметра судини, або реваскуляризація коронарних артерій, з часу проведення якої минуло 3 місяці та більше.
Критерії виключення:
— гіперчутливість до компонентів мельдонію;
— небажання хворого брати участь у дослідженні;
— участь пацієнта в іншому дослідженні;
— синдром мальабсорбції й інші розлади травлення та всмоктування в кишечнику;
— ангіоневротичний набряк в анамнезі;
— гостра серцева недостатність;
— порушення серцевого ритму (хронічна фібриляція передсердь, часта екстрасистолічна аритмія, шлуночкова або надшлуночкова тахікардія, тахікардія (частота серцевих скорочень (ЧСС) понад 100 уд/хв);
— порушення атріовентрикулярної провідності, або синусова брадикардія, або синдром слабкості синусового вузла;
— вади серця;
— вагітність або лактація;
— злоякісний перебіг артеріальної гіпертензії;
— вторинна артеріальна гіпертензія;
— виражена артеріальна гіпотензія (САТ нижче від 90 мм рт.ст.) або гіпертензія (САТ понад 180/110 мм рт.ст.);
— бронхіальна астма;
— декомпенсовані захворювання печінки (рівень аспартатамінотрансферази (АСТ), аналінамінотрансферази (АЛТ) вище від верхньої межі норми в 3 рази);
— нестабільна стенокардія протягом останніх 3 місяців;
— гостра або хронічна ниркова недостатність (розрахункова швидкість клубочкової фільтрації CKD-EPI < 30 мл/хв);
— серцева недостатність II ФК і вище (згідно з Нью-Йоркською класифікацією);
— інфаркт міокарда в анамнезі, з часу якого минуло менше ніж 6 місяців до моменту включення в дослідження;
— стенокардія напруження IV ФК;
— гостре порушення мозкового кровообігу в анамнезі;
— інфекційні та онкологічні захворювання, стани, що супроводжуються ендогенною депресією (чи наявність депресивних станів у сім’ї);
— стан після хірургічного втручання (менше від одного місяця до включення в дослідження);
— прийом стероїдних і нестероїдних проти–запальних засобів, контрацептивів;
— значні психічні розлади.
Після визначення відповідності критеріям включення/виключення пацієнти проходили початкове обстеження та розподіл методом конвертів на групи залежно від призначеної терапії.
Хворим першої групи (n = 20) призначалася базова терапія АГ та ІХС із додаванням Тризипіну внутрішньовенно протягом 10 днів, далі призначався Тризипін лонг у дозі 1000 мг один раз на добу вранці (виробництва компанії «Мікрохім», Україна).
Хворим другої групи (n = 18) призначалася базова терапія АГ та ІХС без додавання Тризипіну.
Третя група (n = 7) — практично здорові люди.
Схема рандомізації пацієнтів методом конвертів подана в табл. 1.
/35-1.gif)
Перед початком лікування та після завершення періоду спостереження, через 4–6 тижнів, пацієнти обох груп проходили обстеження, що включало огляд; електрокардіографію, офісне вимірювання АТ, добове моніторування АТ (ДМАТ), ехокардіографію; лабораторне дослідження крові (загальний аналіз крові, К, Na, білірубін, креатинін, кліренс креатиніну, глюкоза, АЛТ, АСТ, холестерин, тригліцериди, холестерин ліпопротеїдів високої щільності (ЛПВЩ), холестерин ліпопротеїдів низької щільності (ЛПНЩ), холестерин ліпопротеїдів дуже низької щільності (ЛПДНЩ), визначення вмісту L-цитруліну в плазмі крові); заповнювався опитувальник якості життя EQ-5D, у якому оцінювались «рухливість», «догляд за собою», «звичайна щоденна діяльність (робота, навчання, робота по дому)», «біль (дискомфорт)», «тривога (депресія)» та давалась оцінка стану здоров’я на момент опитування у відсотках; опитувальник прихильності до лікування, що містив 6 питань: чи пропускали ви прийом препарату цим ранком? Чи були пропуски в прийомі препарату з моменту останнього візиту до лікаря? Чи приймали ви препарати пізніше за необхідний час? Чи робили ви пропуски в прийомі препаратів через те, що забули чи були зайняті? Чи відмовлялися ви від прийому препаратів через їх побічні ефекти? Чи вважаєте ви, що кількість препаратів, які ви приймаєте щоденно, занадто велика? [5]. Ми оцінювали вплив терапії в групах спостереження на показники еректильної функції в чоловіків за допомогою Міжнародного індексу еректильної функції (МІЕФ) [25]. Оцінювали наявність еректильної дисфункції (ЕД), задоволення від статевого акту, вираженість оргазму, наявність бажання (лібідо), загальне задоволення. Під еректильною дисфункцією розуміють хронічну неспроможність досягати та/або підтримувати ерекцію для здійснення статевого акту. АГ є фактором, що сприяє виникненню або поглибленню ЕД. За даними переважної більшості спостережень, відносний ризик ЕД за наявності АГ підвищується в 1,3–6,9 раза.
Вимірювання САТ та ДАТ проводили на початку дослідження. Вимірювали АТ у положенні сидячи тричі з інтервалом 1–2 хвилини. Визначали середнє з трьох вимірів. ЧСС визначали після другого вимірювання.
Індекс маси тіла (ІМТ) визначали за формулою:
ІМТ = маса тіла/(ріст)2, кг/м2.
Методика добового моніторування артеріального тиску. ДМАТ проводили за допомогою апаратів АВРМ-04М (фірма «Медітек», Угорщина). Вивчали такі показники: САТ середньодобовий (24САТ), денний (серСАТдень), нічний (серСАТніч); ДАТ середньодобовий (24ДАТ), денний (серДАТдень), нічний (серДАТніч), ЧСС середньодобову (24ЧСС), денну (серЧССдень), нічну (серЧССніч). При аналізі ДМАТ для САТ і ДАТ розраховували індекс часу, що характеризує часове перевантаження тиском протягом доби та визначається як відсоток вимірів АТ, що перевищує 140/90 мм рт.ст. вдень і 120/80 мм рт.ст. уночі. Також визначали індекс навантаження тиском, що є площею між кривою підвищеного АТ та лінією межі норми, а також індекс варіабельності, який обчислювали як стандартне відхилення величини АТ. Крім того, за допомогою програмного забезпечення вираховували добовий індекс (ДІ) — відсоток зниження нічного АТ порівняно із денним. Моніторування проводили в такому режимі: у денний час — кожні 15 хвилин, уночі (з 22:00 до 6:00) — кожні 30 хвилин. Хворі вели звичайний спосіб життя, з побутовими фізичними й психоемоційними навантаженнями.
Індекс часу (навантаження тиском) розраховували як відсоток вимірів, що перевищують нормальні показники. Індекс часу для систолічного АТ вважається нормальним, якщо він не перевищує 20 %, а для діастолічного АТ — до 15 % (White, 1989). Динаміка індексу навантаження тиском дає змогу оцінити адекватність лікування.
При оцінці добового ритму АТ нормальним вважається зменшення АТ вночі під час сну на 10–20 % порівняно з денним періодом. Ступінь нічного зниження САТ та ДАТ, або добовий індекс, розраховували за формулою (окремо для САТ та ДАТ):
ДІ = (серАТд – серАТн) • 100 % / серАТд,
де серАТд — середньоденний АТ (САТ чи ДАТ), –серАТн — середньонічний АТ (САТ чи ДАТ).
Інтерпретація результатів:
а) нормальне зниження АТ вночі (dipper) — 10–20 %;
б) недостатнє зниження (non-dipper) — 0–10 %;
в) підвищений ступінь нічного зниження (hyper-dipper) — понад 20 %;
г) стійке підвищення АТ вночі (night-peaker) — нічний АТ більший за денний.
Доведено, що підвищення АТ протягом ночі супроводжується більшим ураженням органів-мішеней (гіпертрофія міокарда, серцева недостатність, гломерулосклероз та ниркова недостатність, ретинопатія тощо). Тривалі спостереження показали, що хворі з порушеним добовим ритмом АТ (non-dipper), особливо жінки, мають достовірно більший ризик виникнення серцево-судинних ускладнень.
Варіабельність АТ є важливою детермінантою ураження органів-мішеней. Крім того, існують непрямі докази, що збільшення варіабельності АТ несприятливо впливає на число серцево-судинних ускладнень та смертність. Варіабельність САТ та ДАТ розраховували як стандартне відхилення від середнього значення, тобто як коефіцієнт варіабельності середньої величини САТ і ДАТ за добу, день, ніч.
Біохімічні аналізи виконувалися на автоматичному фотометрі Livia (Сormay, Польща) у лабораторії ДУ ННЦ «Інститут кардіології імені академіка М.Д. Стражеска» НАМН України. Рівень L-цитруліну визначали колориметричним методом за допомогою набору L-Citrulline К 6600 компанії Immundiagnostik AG (Німеччина) в лабораторії ДУ ННЦ «Інститут кардіології імені академіка М.Д. Стражеска», цитрулін використовується як сурогатний маркер синтезу NO.
Супутня терапія. Під час дослідження пацієнти приймали призначену раніше базову антигіпертензивну та антиангінальну терапію. Усі пацієнти отримували статини та ацетилсаліцилову кислоту в дозі 75–100 мг/добу.
При розвитку нападу стенокардії пацієнти прий–мали таблетки нітрогліцерину в дозі для сублінгвального застосування — по 0,0005 г. Під час проведення дослідження пацієнти не приймали іншу терапію з метаболічною дією. Усіх учасників дослідження попереджали про необхідність продовжувати без змін базову терапію АГ та ІХС. Мельдоній (Тризипін) після рандомізації пацієнта спочатку призначався в дозі 500 мг (5 мл) 1 раз на добу внутрішньовенно краплинно протягом 10 днів, потім пацієнти продовжили прийом Тризипіну лонг у таблетках 1000 мг один раз на добу вранці протягом 1 місяця. Пацієнти не змінювали свій звичний спосіб життя та фізичну активність. Порушень з боку шлунково-кишкового тракту, розладів травлення, септичних станів у пацієнтів не було ні на момент включення в дослідження, ні протягом усього періоду дослідження. Оскільки цитрулін виробляється в кишечнику, будь-які розлади травлення, діарея, порушення всмоктування в кишечнику можуть сприяти змінам його рівня в крові. Усі пацієнти проживали на нерадіоактивно забрудненій території та не піддавалися дії радіоактивного опромінення за медичними показаннями, оскільки рівень цитруліну може змінюватися під дією радіоактивного опромінення.
Статистичну обробку результатів проводили після створення баз даних у системах Microsoft Excel. Усі статистичні розрахунки проводили за допомогою програми SPSS 21.0. Достовірність різниці середніх між групами визначалася методом незалежного t-тесту для середніх. Порівняння динаміки показників на етапах лікування проводили за допомогою парного двовибіркового t-тесту для середніх. Кореляційний аналіз проводили після визначення характеру розподілу за Spearman.
Результати
Середній вік хворих становив 60,43 ± 1,80 року. Середній ІМТ — 28,60 ± 0,90 кг/м2. Середні рівні офісного САТ та ДАТ на початку дослідження становили 147,03 ± 2,79 мм рт.ст. та 85,34 ± 1,54 мм рт.ст. відповідно. Середня офісна ЧСС — 71,31 ± 1,71 уд/хв. Середні рівні АТ при амбулаторному моніторуванні становили для САТ 128,36 ± 2,45 мм рт.ст., для ДАТ — 78,95 ± 1,72 мм рт.ст. Середня добова ЧСС — 72,41 ± 1,57 уд/хв. Основні клініко-демографічні показники пацієнтів груп, які досліджувалися, подані в табл. 2, 3. 70 % пацієнтів мали АГ та стенокардію напруження II ФК, 30 % мали АГ та стенокардію напруження III ФК. 30 % пацієнтів мали інфаркт міокарда в анамнезі. Більшість пацієнтів приймали інгібітори АПФ, бета-адреноблокатори та діуретики.
Контрольну групу становили 7 практично здорових жінок, середній вік яких — 32,4 ± 3,4 року, індекс маси тіла — 21,9 ± 0,7 кг/м2.
На початку дослідження обидві групи не відрізнялися між собою за основними клініко-демографічними характеристиками (табл. 3).
/37-1.gif)
На рис. 1 подана динаміка офісного САТ у групі базової терапії та групі, що отримувала базову терапію + Тризипін. Як видно з рис. 1, офісний САТ не відрізнявся між групами на початку лікування та достовірно знизився в обох групах лікування протягом дослідження. Звертає на себе увагу те, що спостерігалась достовірна різниця між групами в рівні САТ на 2-му та 4-му візитах, що може свідчити про додатковий вплив мельдонію на зниження АТ за рахунок його впливу на систему NO та сприяння вазодилатації, що збігається з даними літератури. В.П. Міхін зі співавт. показали, що застосування мельдонію в поєднанні з еналаприлом у пацієнтів з АГ підсилювало гіпотензивну дію еналаприлу, прискорювало досягнення цільових рівнів АТ, більшою мірою знижувало індекс часу та індекс площі для САТ та ДАТ при ДМАТ, сприяло нормалізації добового профілю АТ більшою мірою, ніж монотерапія інгібіторами ангіотензинперетворювального ферменту (ІАПФ). Нами спостерігалися й однонаправлені зміни рівня офісного ДАТ. На рис. 2 подана динаміка офісного ДАТ у групах спостереження. Відмічалась достовірна різниця між групами на 2-му та 4-му візитах. Усі пацієнти добре переносили терапію протягом періоду спостереження.
/36-2.gif)
Динаміка АТ та ЧСС при добовому моніторуванні відображена на рис. 3, 4. Як видно з рисунків, в обох групах лікування зміни АТ були однонаправленими й не відрізнялися між групами.
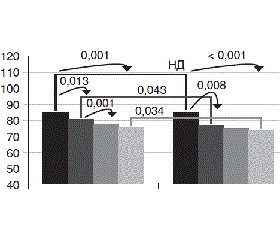
Ми оцінили динаміку рівня цитруліну крові в групі базового лікування та в групі, у якій додавався Тризипін (рис. 5). Так, у групі базового лікування рівень цитруліну крові достовірно підвищився з 34,36 ± 1,29 мкмоль/л до 41,31 ± 1,51 мкмоль/л (р < 0,05), а в групі пацієнтів, які лікувалися Тризипіном, рівень цитруліну достовірно зменшився з 33,43 ± 1,71 мкмоль/л до 29,33 ± 1,42 мкмоль/л (р < 0,05). Ми порівняли початковий рівень цитруліну в групах лікування та групі практично здорових осіб. Рівні цитруліну в пацієнтів з АГ та ІХС були достовірно вищі за показники в групі практично здорових осіб — 33,89 ± 1,69 мкмоль/л проти 25,73 ± 1,70 мкмоль/л відповідно (р < 0,05). При порівнянні кінцевих рівнів цитруліну після лікування ми відмітили, що в групі пацієнтів, які лікувалися Тризипіном, рівень цитруліну в кінці лікування наблизився до рівня цитруліну практично здорових осіб, у той час як у групі базової терапії рівень цитруліну значно виріс та достовірно відрізнявся від показників контрольної групи.
/38-1.gif)
Зниження рівня цитруліну крові в наших пацієнтів на фоні лікування мельдонієм може свідчити про збільшення його використання для синтезу аргініну в пацієнтів з ІХС та АГ, тому що в умовах гіпоксії підвищується потреба в NO, а за допомогою мельдонію буде надходити цитрулін у кров, що сприятиме збільшенню синтезу аргініну та, як наслідок, оксиду азоту, необхідних в умовах ішемії та гіпоксії, і сам рівень цитруліну буде зменшуватися, оскільки він вичерпується та витрачається на утворення аргініну, який далі сприяє синтезу NO. Ефект дії мельдонію можна порівняти з дією фізичного навантаження. Так, при фізичному навантаженні також буде витрачатися цитрулін на синтез аргініну, а аргінін — на синтез оксиду азоту, щоб задовольнити підвищену потребу організму в кисні при фізичному навантаженні.
Прихильність до лікування ми визначали за допомогою опитувальника з 6 питань. Прихильність до лікування загалом достовірно покращилася лише в групі Тризипіну (р = 0,03).
Оцінюючи якість життя в динаміці, ми виявили, що прийом Тризипіну супроводжувався покращенням показників за опитувальником якості життя EQ-5D. Покращення спостерігалось за рахунок достовірно позитивної динаміки в категорії «тривога та депресія» порівняно з групою базової терапії.
У групі базової терапії достовірно покращилися 3 показники з 5, а саме: «рухливість» (p = 0,006), «звичайна повсякденна діяльність» (p = 0,011), зменшилися біль і дискомфорт (p = 0,002). У групі терапії Тризипіном достовірно покращилися 4 із 5 показників: «догляд за собою» (p = 0,021), «звичайна повсякденна діяльність» (p = 0,005), зменшилися біль та дискомфорт (p = 0,028), а також тривога та депресія (p = 0,046). Показник стану здоров’я на момент опитування у групі базової терапії покращився з 59,1 ± 4,5 % до 79,1 ± 3,4 % (р = 0,002), у групі Тризипіну — з 62,8 ± 3,4 % до 72,3 ± 3,3 % (р = 0,004).
Ми оцінювали в групах спостереження вплив терапії на показники еректильної функції в чоловіків за допомогою анкети МІЕФ. У своєму дослідженні Р. Аranda зі співавт. у 2130 чоловіків з АГ вивчали поширеність ЕД та встановили, що 45,8 % чоловіків з АГ мали ЕД [16]. M. Doumas зі співавт. зіставляли поширеність ЕД у гіпертензивних та нормотензивних чоловіків та встановили, що поширеність ЕД в чоловіків з АГ становила 35,2 %, а в нормотензивних чоловіків — 14,1 % [18]. Деякі дослідження показують, що ІХС та ЕД мають спільні фактори ризику. Так, у дослідженні А. Greenstein зі спіавт. ЕД корелювала з кількістю закритих коронарних артерій [21]. В основі еректильного збудження лежить вивільнення оксиду азоту. Тому всі чинники, що впливають на вивільнення NO, можуть сприяти покращенню еректильної функції в чоловіків [12, 30]. Тому ми вирішили дослідити, яким чином Тризипін у комбінації зі стандартною антигіпертензивною терапією впливає на стан еректильної функції в чоловіків. Дані наведені в табл. 4. Нами не було виявлено достовірних змін еректильної функції в чоловіків, які брали участь у нашому дослідженні.
При аналізі переносимості відмічено, що терапія на основі Тризипіну добре переносилася пацієнтами. Нами не відмічено достовірних змін у біохімічних показниках крові в обох групах лікування (табл. 5), хоча в літературі є дані, що рівень цитруліну крові зростає з прогресуванням ниркової недостатності, причому ці зміни з’являються на ранній стадії ниркової недостатності, і зміни рівня цитруліну прямо корелювали із вмістом креатиніну крові [11]. Нами таких зв’язків не відмічено, можливо, тому що в наших пацієнтів не було ниркової недостатності. Також нами не виявлено жодних побічних реакцій на прийом Тризипіну, що потребували б відміни препарату. Одна пацієнтка поскаржилася на неприємний запах таблеток Тризипіну, що не призвело до відміни препарату.
/39-1.gif)
Отже, ми можемо сказати, що терапія на основі Тризипіну в пацієнтів з АГ та ІХС мала достовірний позитивний вплив на АТ, прихильність до лікування, покращувала якість життя, зменшуючи тривогу та депресію, знижувала рівень цитруліну крові порівняно з групою базової терапії.
Обговорення
У нашому дослідженні вперше в Україні проведено визначення рівня цитруліну крові колориметричним методом у пацієнтів з артеріальною гіпертензією та ішемічною хворобою серця та встановлено, що на фоні лікування мельдонієм (Тризипіном) відмічалося зменшення рівня цитруліну крові порівняно з показниками групи базової терапії без додавання мельдонію через 4–6 тижнів спостереження, що можна пояснити підвищеним використанням цитруліну — опосередкованого субстрату для утворення оксиду азоту, збільшення продукції якого забезпечує зниження тонусу судин і, відповідно, збільшення доставки кисню до тканин на фоні ішемії та артеріальної гіпертензії. Так, при застосуванні мельдонію в поєднанні з базовою терапією відмічалося достовірне зменшення рівня цитруліну крові, що практично наближався до рівня здорових осіб. У той же час у групі базової терапії рівень цитруліну крові достовірно підвищився, тобто він не витратився на підвищений синтез NO з L-аргініну для забезпечення потреб при артеріальній гіпертензії та ішемії. В обох групах на початку дослідження рівень цитруліну крові був вищим, ніж у групі здорових осіб, на 30 %, і ці рівні не відрізнялися. Рівень цитруліну крові в групі базової терапії підвищився на 17 % порівняно з початком та на 60 % — порівняно з групою здорових осіб, а в групі мельдонію зменшився на 14 % порівняно як з групою контролю, так і з початком лікування. Нами відмічено достовірне зменшення офісного АТ при додаванні мельдонію до базової терапії, що можна пояснити підвищенням продукції NO, що сприяє вазодилатації та зменшенню АТ при застосуванні мельдонію. Ми відмітили покращення якості життя за рахунок зменшення тривоги та депресії в групі пацієнтів, які лікувалися мельдонієм, порівняно з групою базової терапії. Також ми спостерігали підвищення прихильності до лікування в групі, у якій додавався мельдоній, незважаючи на збільшення кількості таблеток, які пацієнти повинні були приймати щодня. Нами не відмічено достовірного покращення еректильної функції в чоловіків в обох групах лікування, хоча ми очікували на позитивний ефект у групі пацієнтів, у якій додавався мельдоній, оскільки він впливає на синтез NO, що, у свою чергу, бере участь у регуляції еректильної функції. Можливо, це пов’язано з тим, що середній вік пацієнтів у нашому дослідженні був досить високим і становив 60,42 ± 1,80 року, а в цьому віці ознаки еректильної дисфункції вже присутні, і для їх корекції тільки прийому мельдонію та скоригованої антигіпертензивної терапії недостатньо. Нами не відмічено змін у біохімічних показниках в обох групах лікування та не відзначено побічних ефектів мельдонію, що може свідчити про безпечність терапії, яка використовувалась нами в дослідженні.
У спортивній медицині використовують дієтичну добавку L-цитруліну малат, що може підвищувати рівень метаболітів оксиду азоту, однак це не пов’язано з покращенням спортивних результатів. Біологічні добавки з L-цитруліном самі по собі не підвищують ефективність фізичних вправ. Енергетична відповідь на харчові добавки з L-цитруліном та L-аргініном залежить від фізичного статусу особи, її тренованості. Дослідження, у які включались нетреновані або помірно здорові люди, показали, що використання донаторів оксиду азоту як харчових добавок покращувало переносимість аеробних та анаеробних навантажень. При цьому особи з високим рівнем навантаження не показали покращення переносимості фізичних вправ [29].
У літературі є декілька публікацій, присвячених комбінованій терапії артеріальної гіпертензії інгібіторами АПФ у поєднанні з мельдонієм. У роботі Ф.Є. Хлєбодарова зі співавт. у 120 пацієнтів з АГ вивчався вплив різних комбінацій ІАПФ з мельдонієм (мілдронатом), мексикором або тільки ІАПФ на показники добового профілю АТ [15]. При прийомі лізиноприлу або еналаприлу з мельдонієм покращувалися показники ендотелійзалежної вазодилатації плечової артерії, зменшувався вміст у крові продуктів перекисного окислення ліпідів крові — малонового діальдегіду та дієнових кон’югат. При прийомі лізиноприлу з мельдонієм зниження АТ підсилювалося при добовому моніторуванні.
В.П. Міхін зі співавт. проаналізували дані рандомізованого дослідження 60 пацієнтів з АГ II ступеня, які не отримували постійної антигіпертензивної терапії до скринінгу. Пацієнтів розподілили на 3 групи, по 20 осіб у кожній [8]. У всіх групах перші 10 днів пацієнти отримували тільки монотерапію еналаприлом. Далі пацієнтам першої групи додавався до еналаприлу мельдоній (мілдронат) у дозі 750 мг на добу, у другій групі — триметазидин 70 мг на добу, третя група була контрольною, у ній застосовувалась монотерапія еналаприлом. Строк спостереження становив 6 місяців. У групі мельдонію зниження рівня дієнових кон’югат було більш вираженим порівняно з іншими групами: 31 проти 20 %. Такі зміни поєднувались зі збільшенням ступеня ендотелійзалежної вазодилатації при проведенні проби з манжеткою, причому в групі мельдонію такі зміни були достовірними. Застосування мельдонію в поєднанні з гіпотензивною терапією не тільки підсилювало вазодилатуючу активність судинного ендотелію, але й збільшувало ангіопротекторний ефект терапії, що виявлялося в зменшенні товщини комплексу інтима-медіа сонних артерій у групі мельдонію на 16,2 %, а в групах монотерапії еналаприлом або в комбінації з триметазидином — на 9,5 та 9,7 % відповідно. Застосування мельдонію в поєднанні з еналаприлом у пацієнтів з АГ підсилювало антигіпертензивну дію еналаприлу, прискорювало досягнення цільових рівнів АТ, більшою мірою знижувало індекс часу та індекс площі для САТ та ДАТ при ДМАТ, сприяло нормалізації добового профілю АТ більшою мірою, ніж монотерапія ІАПФ. Автори роблять висновок і про покращення діастолічної функції лівого шлуночка при комбінованій терапії [9]. Так, у хворих під впливом ІАПФ та мельдонію ІММЛШ через 6 місяців терапії знизився на 16,8 %, а в групах порівняння — на 10,4 та 10,6 %.Отже, Ф.Є. Хлєбодаров та В.П. Міхін у своїх публікаціях показали, що комбінована терапія еналаприлом та мельдонієм у пацієнтів з АГ сприяє більш швидкій нормалізації показників АТ при добовому моніторуванні, корекції ендотеліальної дисфункції та вільнорадикального окислення, покращує морфофункціональний стан міокарда лівого шлуночка. Усе це може сприяти зменшенню прогресування ураження органів-мішеней.
Л.А. Хаїшева та співавт. оцінювали вплив мельдонію (мілдронату) на жорсткість та еластичність судинної стінки в пацієнтів з АГ [14]. Було обстежено 99 пацієнтів з АГ I–II ступеня. Їх поділили на 2 групи: одній групі призначався еналаприл у комбінації з мельдонієм, іншій — тільки еналаприл. –Через 12 тижнів терапії рівень АТ достовірно знизився в обох групах. Достовірних змін у швидкості поширення пульсової хвилі в обох групах не було. Очевидно, це пов’язано з тим, що ШППХ змінюється достовірно лише через 6–12 місяців терапії.
М.Є. Стаценко та співавт. порівнювали вплив безперервної та курсової терапії мельдонієм на показники когнітивних функцій у 180 пацієнтів з АГ та когнітивним дефіцитом. Так, безперервна терапія мельдонієм сприяла достовірному покращенню всіх показників когнітивних функцій порівняно з групою контролю [13]. Результати вищенаведених досліджень продемонстрували, що мельдоній у комплексній терапії АГ сприяє більш швидкій нормалізації АТ, покращує профіль АТ, зменшує прояви ендотеліальної дисфункції, що дозволяє використовувати його для запобігання прогресуванню ураження органів-мішеней.
У процесі роботи з літературою за тематикою цього дослідження нам не вдалося знайти опублікованих матеріалів стосовно впливу мельдонію на показники рівня цитруліну в крові у пацієнтів з АГ та ІХС. Результати, отримані в нашому дослідженні, свідчать про позитивний вплив мельдонію на рівень АТ, вміст цитруліну в крові, зменшення депресії, покращення прихильності до лікування у пацієнтів з АГ та ІХС.
Висновки
1. Комбінована терапія, що включала Тризипін для ін’єкцій та таблетки Тризипін лонг, сприяла достовірно більшому зниженню офісного АТ у пацієнтів з артеріальною гіпертензією та ішемічною хворобою серця порівняно з групою базової терапії.
2. Лікування Тризипіном сприяло достовірному зменшенню рівня цитруліну крові в пацієнтів з артеріальною гіпертензією та ішемічною хворобою серця.
3. Прийом Тризипіну супроводжувало покращення показників опитувальника якості життя EQ-5D за рахунок достовірно позитивної динаміки в категорії «тривога та депресія».
4. Додавання Тризипіну достовірно покращувало прихильність до лікування в пацієнтів з артеріальною гіпертензією та ішемічною хворобою серця порівняно з групою базової терапії.
5. Лікування на основі Тризипіну добре переносилося хворими. Змін еректильної функції не було.
Конфлікт інтересів. Не заявлений.
Список литературы
1. Батушкін В.В. Клініко-патогенетичне обґрунтування метаболічної терапії гострих та хронічних форм ІХС // Здоров’я України. — 2016. — № 15–16. — С. 8-9.
2. Дзерве В.Я. Милдронат: лечение кардионеврологической патологии в условиях ишемии и гипоксии. Факторы доказательной медицины // Здоров’я України. — 2016. — № 4. — С. 4-5.
3. Дзерве В.Я. Эффективность Милдроната в лечении ишемической болезни сердца: результаты исследования MILLS II // Здоров’я України. — 2010. — № 7. — С. 1-3.
4. Ена Л.М., Христофорова А.М. Эффективность пролонгированной лекарственной формы мельдония (тризипинлонг) у пациентов с ишемической болезнью сердца // Український медичний часопис. — 2014. — № 5. — С. 10-15.
5. Клінічні рекомендації з артеріальної гіпертензії Європейського товариства з гіпертензій (ESH) та Європейського товариства кардіологів (ESC) 2013 року / Переклад Сіренка Ю.М. // Артеріальна гіпертензія. — 2013. — № 4. — С. 62-157.
6. Кузнецова С.М., Кузнецов В.В., Шульженко Д.В. Эндотелиальная дисфункция — фармакологическая мишень дисциркуляторной энцефалопатии // Журнал неврології. — 2015. — № 4. — С. 6-12.
7. Лутай М.И., Лысенко А.Ф., Товстуха В.В., Моисеенко О.И. Оценка антиангинальной эффективности мельдония (тризипина) у пациентов со стабильной ишемической болезнью сердца и стенокардией напряжения // Український медичний часопис. — 2014. — № 4. — С. 12-17.
8. Михин В.П., Поздняков Ю.М., Хлебодаров Ф.Е., Кольцова О.Н. Милдронат в кардиологической практике — итоги, новые направления, перспективы // Кардиоваскулярная терапия и профилактика. — 2012. — № 11. — С. 95-102.
9. Михин В.П., Хлебодаров Ф.Е. Перспективы применения милдроната у больных с сердечно-сосудистой патологией // Российский кардиологический журнал. — 2010. — № 4. — С. 83-92.
10. Мітченко О.І., Романов В.Ю., Ілюшина Г.Я. Оптимізація лікування пацієнтів із метаболічним синдромом та гіпертонічною хворобою із застосуванням тризипіну (мельдонію) // Український медичний часопис. — 2014. — № 2. — С. 5-10.
11. Мхітарян Л.С., Кучменко О.Б., Евстратова І.Н. та ін. Цитрулін як маркер функціонального стану органів за умов патологічних станів // Український кардіологічний журнал. — 2016. — № 3. — С. 109-115.
12. Радченко А.Д. Проблема сексуальной дисфункции в кардиологии. — К., 2013. — 64 с.
13. Стаценко М.Е., Недогода С.В., Туркина С.В. и др. Возможности милдроната в коррекции когнитивных нарушений у пациентов с артериальной гипертензией пожилого возраста // Российский кардиологический журнал. — 2011. — № 4. — С. 124-128.
14. Хаишева Л.А., Шлык С.В., Глова С.Е. и др. Возможности медикаментозной коррекции сосудистых нарушений у пациентов с артериальной гипертензией // Российский кардиологический журнал. — 2010. — № 5. — С. 131-135.
15. Хлебодаров Ф.Е. Влияние милдроната и мексикора на эффективность ингибиторов ангиотензинпревращающего фермента у больных с артериальной гипертензией: Автореф. дис… канд. мед. наук. — Курск, 2005. — 22 с.
16. Aranda P., Ruilope L.M., Calvo C. et al. Erectile dysfunction in essential arterial hypertension and effects of sildenafil: results of a Spanish national study // Am. J. Hypertens. — 2004. — Vol. 17(2). — P. 139-145.
17. Cai B., Luo Y.L., Wang S.J. et al. Does citrulline have protective effects on liver injury in septic rats? // Biomed. Research International. — 2016. — 2016. — 1469590. doi: 10.1155/2016/1469590. Epub 2016 Apr 19.
18. Doumas M., Tsakiris A., Douma S. et al. Factors affecting the increased prevalence of erectile dysfunction in Greek hypertensive compared with normotensive subjects // J. Androl. — 2006. — Vol. 27(3). — P. 469-477.
19. Figueroa A., Alvarez-Alvarado S., Ormsbee M.J. et al. Impact of L-citrulline supplementation and wholy-body vibration training on arterial stiffness and leg muscle function in obese postmenopausal women with high blood pressure // Exp. Gerontol. — 2015. — Vol. 63. — P. 35-40.
20. Jaisson S., Kerkeni M., Santos-Weiss I.C. et al. Increased serum homocitrulline concentrations are associated with the severity of coronary artery disease // Clin. Chem. Lab. Med. — 2015. — Vol. 53(1). — P. 103-110.
21. Greenstein A., Chen J., Miller H. et al. Does severity of ischemic coronary disease correlate with erectile function? // Int. J. Impot. Res. — 1997. — Vol. 9(3). — P. 123-126.
22. Hayashi Y., Kirimoto T., Asaka N. et al. Beneficial effects of MET-88, a gamma-butyrobetaine hydroxylase inhibitor in rats with heart failure following myocardial infarction // Eur. J. Pharmacol. — 2000. — Vol. 3, № 395(3). — P. 217-224.
23. Kulu R., Akyildiz H., Akcan A. et al. Plasma citrulline measurement in the diagnosis of acute mesenteric ischaemia // ANZ Journal Surgery. — 2016. — Vol. 8. — doi: 10.1111/ans.13524 Epub ahead of print.
24. Lin I.C., Hsu C.N., Lo M.N. et al. Low urinary citrulline/arginine ratio associated with blood pressure abnormalities and arterial stiffness in childhood chronic kidney disease // J. Am. Soc. Hypertension. — 2016. — Vol. 10(2). — P. 115-123.
25. Rosen R.C., Riley A., Wagner G. et al. The international index of erectile function (IIEF): a multidimensional scale for assessment of erectile dysfunction // Urology. — 1997. — Vol. 49(6). — P. 822-830.
26. Silva M.P., Haag U., Guest J.F. et al. Health-related quality of life impact of a triple combination of olmesartan medoxomil, amlodipine besylate and hydrochlorotiazide in subjects with hypertension // Health Qual Life Outcomes. — 2015. — Vol. 21. — P. 13-24.
27. Wong A., Alvarez-Alvarado S., Jaime S.J. et al. Combined whole-body vibration training and L-citrulline supplementation improves pressure wave reflection in obese postmenopausal women // Appl. Physiol. Nutr. Metab. — 2016. — Vol. 41(3). — P. 292-297.
28. Sureda A., Cуrdova A., Ferrer M.D. et al. L-citrulline-malate influence over branched chain amino acid utilization du–ring exercise // Eur. J. Appl. Physiol. — 2010. — Vol. 110(2). — P. 341-351.
29. Sureda A., Pons A. Arginine and citrulline supplementation in sports and exercise: ergogenic nutrients? // Med. Sport Sci. — 2012. — Vol. 59. — P. 18-28.
30. Cormio L., De Siati M., Lorusso F. Oral L-citrulline supplementation improves erection hardness in men with mild erectile dysfunction // Urology. — 2011. — Vol. 77(1) — P. 119-22.
31. Figueroa A., Wong A., Jaime S.J., Gonzales J.U. Influence of L-citrulline and watermelon supplementation on vascular function and exercise performance // Curr. Opin. Clin. Nutr. Metab. Care. — 2016. — Oct 5. [Epub ahead of print]

/35-1.gif)
/36-1.gif)
/37-1.gif)
/36-2.gif)
/38-1.gif)
/39-1.gif)