Статья опубликована на с. 39-52
Список сокращений
АВ — атриовентрикулярная (блокада, проводимость)
АД — артериальное давление
АДГ — антидиуретический гормон
АИК — аппарат искусственного кровообращения
АКШ — аортокоронарное шунтирование
АНЦА — антинейтрофильные цитоплазматические аутоантитела (аутоантитела к цитоплазме нейтрофилов)
АТ II — ангиотензин II
АФС — антифосфолипидный синдром
АЦЦ — N-ацетилцистеин
АЧТВ — активированное частичное тромбопластиновое время
БКК — блокаторы кальциевых каналов
БПНС — быстропрогрессирующий нефритический синдром
БРА — блокаторы рецепторов ангиотензина II
БЭН — белково-энергетическая недостаточность
ВПВ — верхняя полая вена
ГБМ — гломерулярная базальная мембрана
ГД — гемодиализ
ГДФ — гемодиафильтрация
ГЛПС — геморрагическая лихорадка с почечным синдромом
ГМК — гладкомышечные клетки
ГН — гломерулонефрит
ГРС — гепаторенальный синдром
ГУС — гемолитико-уремический синдром
ГЭК — гидроксиэтилкрахмалы
ДЗЛА — давление заклинивания легочной артерии
ДЗЛК — давление заклинивания в легочных капиллярах
ДИ — доверительный интервал
ДК — дендритные клетки
ДПП — давление в правом предсердии
ЗПТ — заместительная почечная терапия
иАПФ — ингибиторы ангиотензинпревращающего фермента
ИВЛ — искусственная вентиляция легких
ИРП — ишемическое реперфузионное повреждение
ИТН — ишемический тубулярный некроз
ИФА — иммуноферментный анализ
ИХА — иммунохроматографический анализ
КИ-ОПП — контрастиндуцированное острое повреждение почек
КИУП — контрастинтенсифицированная ультрасонография почек
ККОС — клубочково-канальцевая обратная связь
КОС — кислотно-основное состояние
КРС — кардиоренальный синдром
КТ — компьютерная томография
КФ — клубочковая фильтрация
КФО — комплексное функциональное обследование почек
ЛДГ — лактатдегидрогеназа
ЛПС — липополисахариды
ММ — молекулярная масса
МО — мочевая обструкция
МОД — минутный объем дыхания
МПГН — мембранопролиферативный гломерулонефрит
МРТ — магнитно-резонансная томография
МТ — масса тела
ННА — ненаркотические анальгетики
НПВ — нижняя полая вена
НПВП — нестероидные противовоспалительные препараты
НПЗТ — непрерывная почечная заместительная терапия
ОБП — острая болезнь почек
ОГПС — острый гемпигментный синдром
ОИН — острый интерстициальный нефрит
ОИТН — острый ишемический тубулярный некроз
ОКН — острый кортикальный некроз
ОКРС — острый кардиоренальный синдром
ОМ — объем мочи
ОНС — острый нефритический синдром
ОПН — острая почечная недостаточность
ОПП — острое повреждение почек
ОПСС — общее периферическое сосудистое сопротивление
ОРДС — острый респираторный дистресс-синдром
ОРИТ — отделение реанимации и интенсивной терапии
оРТПХ — острая реакция «трансплантат против хозяина»
ОСН — острая сердечная недостаточность
ОТИН — острый тубулоинтерстициальный нефрит
ОТИНС — тубулоинтерстициальный нефритический синдром
ОТН — острый тубулярный некроз
ОТТН — острый токсический тубулярный некроз
ОЦК — объем циркулирующей крови
ОЦП — объем циркулирующей плазмы
п/ж — подкожно-жировая (клетчатка)
ПД — перитонеальный диализ
ПДКВ — положительное давление в конце выдоха
ПМЯЛ — полиморфноядерные лейкоциты
ПНГ — пароксизмальная ночная гемоглобулинурия
ПОЛ — перекисное окисление липидов
ПОПП — преренальное острое повреждение почек
ПЦР — полимеразная цепная реакция
РААС — ренин-ангиотензин-альдостероновая система
РАС — ренинангиотензиновая система
РДСВ — респираторный дистресс-синдром взрослых
РКИ — рандомизированное клиническое исследование
РКС — рентгеноконтрастные средства
РМА — реакция микроагглютинации
РСК — реакция связывания комплемента
РТ — рост
РТПО — реакция «трансплантат против опухоли»
РТПХ — реакция «трансплантат против хозяина»
СВ — сердечный выброс
СД — сахарный диабет
СЗП — свежезамороженная плазма
СИАГ — синдром интраабдоминальной гипертензии
СИИ — строгий ионный интервал
СК — система комплемента
СКВ — системная красная волчанка
СКФ — скорость клубочковой фильтрации
СЛОК — синдром лизиса опухолевых клеток
СН — сердечная недостаточность
СНС — симпатическая нервная система
СОС — синдром обструкции синусоидов печени
ССВО — синдром системного воспалительного ответа
ССВР — синдром системной воспалительной реакции
СХАЭ — синдром холестериновой атероэмболии
ТБМ — тубулярная базальная мембрана
ТГCК — трансплантация гемопоэтических стволовых клеток
ТИН — тубулоинтерстициальный нефрит
ТМА — тромботическая микроангиопатия
ТПН — терминальная почечная недостаточность
ТТН — токсический тубулярный некроз
ТТП — тромботическая тромбоцитопеническая пурпура
ТЭЛА — тромбоэмболия легочной артерии
УФ — ультрафильтрация
ФВЛЖ — фракция выброса левого желудочка
ФДЭ — фосфодиэстераза
ФР — фактор риска
ФЭNa — фракционная экскреция натрия
ХБП — хроническая болезнь почек
ХКПС — хантавирусный кардиопульмональный синдром
ХНТВ — хантавирусы
ХНТВИ — хантавирусные инфекции
ХСН — хроническая сердечная недостаточность
ЦВД — центральное венозное давление
цАМФ — циклический аденозинмонофосфат
цГМФ — циклический гуанозинмонофосфат
ЦМВ — цитомегаловирус
ЦП — цирроз печени
ЭК — эпителиальные клетки
ЭКК — экстракорпоральный контур
ЭН — эпидемическая нефропатия
ЭПР — эндоплазматический ретикулум
ЭЦО — эффективный циркулирующий объем
ЮВД — югулярное венозное давление
ЮГА — юкстагломерулярный аппарат
ACT — активированное время свертывания
BNP — натрийуретический пептид B-типа
Ccr — клиренс креатинина
CIN — ингибиторы кальциневрина
CРБ — C-реактивный белок
HGF — фактор роста гепатоцитов
HHV-6 — вирус герпеса шестого типа
IGF — инсулиноподобный фактор роста
IL — интерлейкины
KIM — молекула почечного повреждения
NGAL — нейтрофильный желатиназоассоци-ированный липокалин
PAF — фактор активации тромбоцитов
ROS — реактивные радикалы кислорода
Scr — концентрация креатинина в сыворотке крови
TGF — трансформирующий фактор роста
TLR — Toll-подобные рецепторы
TNF — фактор некроза опухолей
TNFR — рецептор фактора некроза опухоли
VEGF — сосудистый эндотелиальный фактор роста
Раздел 4. Мониторинг, профилактика и основные подходы к лечению ОПП
Рекомендация 4.1
Первичная профилактика ОПП должна быть основана на своевременном выявлении, минимизации или устранении факторов риска и ассоциированных состояний (табл. 4.1) (1A); больные с высоким риском развития ОПП (табл. 4.2) должны быть консультированы нефрологом (2B).
Комментарий
Основные факторы риска и ассоциированные состояния при ОПП приведены в табл. 4.1.
Примерный риск развития ОПП можно определить, исходя из комбинации факторов риска и ассоциированных состояний (табл 4.2).
Рекомендация 4.2
Основными направлениями лечебно-профилактических мероприятий у пациентов с ОПП следует считать: 1) максимально быстрое устранение или минимизацию действия основных факторов, провоцирующих ОПП (преренальные, постренальные, ренальные); 2) контроль и коррекцию жизнеугрожающих осложнений дисфункции почек (гипергидратация, нарушения электролитного баланса и кислотно-основного состояния, уремическая интоксикация) (NG).
Комментарий
Максимально быстрое устранение или минимизацию действия основных провоцирующих ОПП факторов (преренальные, постренальные, ренальные) прежде всего требует правильной диагностики основного этиопатогенетического варианта ОПП (см. раздел III). Выявление ведущего патогенетического механизма развития ОПП зачастую ориентирует врача на необходимость дополнительных консультаций смежных специалистов. Так, при подозрении на постренальное ОПП необходима экстренная консультация уролога. При кардиоренальном синдроме I типа тактику ведения пациента целесообразно согласовать с кардиологом. Привлечение врачей смежных специальностей во многих случаях обеспечивает своевременное устранение или минимизацию факторов, провоцирующих ОПП (синдром интраабдоминальной гипертензии, гепаторенальный синдром 1-го типа и др.).
Стадии 1 и 2 ОПП, как правило, позволяют проводить консервативную терапию. Признаки ОПП 3-й стадии и экстраренальных системных осложнений требуют решения вопроса о начале ЗПТ (табл. 4.3, 4.4).
Рекомендация 4.2.1
При наличии гиповолемии и вне зависимости от наличия или отсутствия критериев ОПП необходимо принять срочные меры к восстановлению ОЦК, не дожидаясь завершения диагностики ОПП (NG).
Рекомендация 4.2.2
У лиц с факторами риска острого повреждения почек и уже при развившемся ОПП следует оптимизировать фармакотерапию за счет исключения/минимизации потенциально нефротоксичных препаратов (NG).
Комментарий
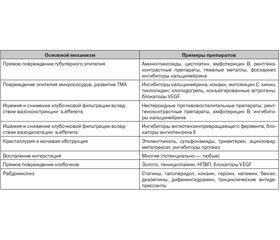
Лекарственные механизмы развития ОПП разнообразны и могут быть связаны с преимущественным вовлечением разных компартментов органа: сосудов, клубочков, канальцев, интерстиция (табл. 4.5). Одной из важнейших причин лекарственного ОПП является развитие токсического тубулярного некроза (ТТН), который возникает в результате прямого повреждения тубулярного эпителия при воздействии экзотоксинов и ксенобиотиков. Другие аспекты побочных эффектов фармакопрепаратов, касающиеся нарушений внутрипочечной гемодинамики, иммуноопосредованного воспаления интерстиция и клубочков, развития тромботической микроангиопатии, тубулярной обструкции, рабдомиолиза, тоже могут стать причиной ОПП лекарственной этиологии (табл. 4.5).
Рекомендация 4.2.3
При высоком риске развития или уже развившемся ОПП следует временно отменить средства, блокирующие компоненты РАС (иАПФ, БРА), и перейти на лечение с использованием других групп антигипертензивных препаратов (2С).
Рекомендация 4.2.4
Терапия ОПП должна включать нутриционную поддержку с обеспечением суточного потребления белка в пределах 0,8–1,2 г/кг массы тела (2С) и энергии не ниже 20–30 ккал/кг массы тела (2С).
Рекомендация 4.2.5
У пациентов с ОПП рекомендуется осуществлять преимущественно энтеральное питание и прибегать к парентеральному лишь по мере необходимости (2C).
Рекомендация 4.2.6
Применение петлевых диуретиков при ОПП с олигурией/анурией с целью восстановления диуреза следует считать оправданным только при наличии признаков гиперволемии; в остальных случаях от применения диуретиков следует воздержаться (2В).
Рекомендация 4.2.7
Предпочтительно парентеральное (внутривенное) введение фуросемида; при резистентности к первоначальной терапии фуросемидом можно рассмотреть тактику эскалации дозы препарата, однако его применение в дозах более 400 мг/сут не оправданно (2С).
Комментарий
Применение петлевых диуретиков в ряде случаев может вызывать неблагоприятные эффекты. Так, их использование при постренальном ОПП до восстановления оттока мочи будет способствовать развитию гидронефроза и усугубит течение ОПП. С учетом механизма действия фуросемида его введение в условиях гиповолемии усугубит гипоперфузию почек за счет снижения ударного объема левого желудочка, а также значительно увеличит риск тромбоэмболических осложнений. Независимо от патогенетического механизма развития ОПП низкий диуретический эффект фуросемида может быть вызван сочетанием различных механизмов, включающих в себя гипопротеинемию, низкую канальцевую секрецию и слабое действие на Na-K-2Cl-котранспортер в петле Генле. При ОПП фуросемид не уменьшает необходимость в ЗПТ (относительный риск 1,02, 95% С1 0,9–1,16, р = 0,73), а также внутригоспитальную смертность (относительный риск 1,12, 95% С1 0,93–1,34, р = 0,23) при его назначении с профилактической или лечебной целью пациентам с риском или уже возникшим ОПП соответственно [Ho K.M. и соавт., 2010]. Поэтому в соответствии с рекомендациями KDIGO 2012 фуросемид следует использовать только при наличии гиперволемии [KDIGO Clinical Practice Guideline for Acutе, 2012]. Рекомендуется внутривенное введение фуросемида в начальной дозе 5 мг/кг/ч с постепенным увеличением максимально до 20 мг/кг/ч. Применение маннитола в раннем периоде ОПП ограничено исключительно случаями рабдомиолиза.
Рекомендация 4.2.8
Для лечения и профилактики преренального и контрастиндуцированного ОПП, ОПП при рабдомиолизе и ОПП в периоперационном периоде рекомендуется проводить коррекцию (увеличение) внутрисосудистого объема жидкости с использованием 0,9% раствора хлорида натрия (2В).
Комментарий
Кристаллоидные растворы используются для коррекции умеренной гиповолемии (до 20 % ОЦК) при профилактике и лечении преренального ОПП. Инфузия кристаллоидов при визуализирующих процедурах — мера, направленная на увеличение объема распределения контрастного препарата. Это препятствует прямому тубулотоксическому эффекту последнего, а также способствует улучшению внутрипочечной гемодинамики за счет снижения продукции вазопрессина и ингибиции активности ренин-ангиотензин-альдостероновой системы. Одновременно происходит увеличение продукции сосудорасширяющих простагландинов [Nguyen S.A. et al., 2008; Weisbord S.D., Palevsky P.M., 2008]. Введение 0,9% раствора NaCl также способствует увеличению скорости тока мочи в канальцах, что уменьшает время экспозиции в них контрастного вещества [McCullough P.A., 2008].
При рабдомиолизе увеличение скорости образования и тока мочи препятствует формированию пигментных цилиндров, способствуя устранению внутриканальцевой обструкции.
Рекомендация 4.2.8.1
При необходимости выполнения рентгеноконтрастных исследований у пациентов с наличием факторов риска и ассоциированных с ОПП состояний следует проводить профилактику ОПП путем использования низко- и изоосмолярных контрастов, минимизации объема вводимого йодсодержащего рентгеноконтрастного агента, инфузий изотонических растворов хлорида или бикарбоната натрия (1А), назначения умеренных доз N-ацетилцистеина (2С) и предупреждать развитие анафилактоидных реакций (2B).
Комментарий
В настоящее время нет сомнений в том, что профилактика КИ-ОПП в группах пациентов с наличием факторов риска может существенно снизить частоту его развития. Оптимальным считается применение инфузий изотонических растворов кристаллоидов (хлорида или бикарбоната натрия) до и после рентгеноконтрастной процедуры. Убедительных доказательств преимуществ одной соли перед другой не имеется [KDIGO Clinical Practice Guideline for Acutе, 2012]. В частности, может быть рекомендована следующая схема инфузионной профилактики: 3 мл/кг массы тела изотонического раствора хлорида натрия за час до процедуры и 1 мл/кг
в час в течение 6 ч после процедуры. Для профилактики КИ-ОПП KDIGO считает возможным также применение умеренных доз N-ацетилцистеина, хотя в доступной литературе данные по этому вопросу более чем противоречивы (для справки см. Каюков И.Г., Румянцев А.Ш., 2015). Наиболее распространенным режимом в настоящее время считается применение per os 600 мг × 2 р. в сутки до выполнения и первые сутки после введения РКС. В/в назначение АЦЦ в умеренных дозах (600 мг) перед исследованием целесообразно при необходимости проведения рентгеноконтрастной процедуры по ургентным показаниям [Каюков И.Г., Смирнов А.В., 2009].
Для уменьшения риска развития анафилактоидных реакций следует применять премедикацию (антигистаминные препараты, глюкокортикоиды, адреномиметики и др.).
В частности, существует следующая схема:
— за 12 часов до проведения рентгеноконтрастной процедуры назначить 40 мг преднизона или 32 мг метилпреднизолона реr os;
— за 2 ч до процедуры вновь назначить 40 мг преднизона или 32 мг метилпреднизолона и 300 мг циметидина или 150 мг ранитидина per os;
— непосредственно перед процедурой ввести внутривенно 50 мг дифенгидрамина (димедрол, бенадрил). В качестве альтернативы может использоваться пероральное назначение дифенгидрамина в той же дозе за 2 ч до исследования.
Другой подход заключается в том, что непосредственно перед введением йодсодержащего рентгеновского контраста пациенту в/в болюсом вводятся [Каюков И.Г., Смирнов А.В., 2009]:
— преднизолон 30–60 мг (или эквивалентная доза любого другого препарата глюкокортикоидных гормонов);
— 20–40 мг хлоропирамина (супрастин) — 1,0–2,0 мл
или
— 2 мг клемастина (тавегил) — 2,0 мл;
— 10 мл 10% р-ра глюконата кальция.
Важное место в профилактике КИ-ОПП занимают использование современных низко- или изоосмолярных контрастов (убедительных доказательств преимуществ одних перед другими не существует) и минимизация дозы рентгеноконтрастного агента.
Следует также иметь в виду, что:
— только пероральная гидратация недостаточна для адекватной профилактики КИ-ОПП (необходимо прибегать к в/в инфузиям кристаллоидов, как указано выше);
— эффективность метилксантинов (теофиллина), фенолдопама, аскорбиновой кислоты как средств предотвращения КИ-ОПП не доказана, поэтому от применения этих препаратов в целях профилактики данного состояния следует воздерживаться;
— диуретики, особенно петлевые, не только не снижают, а, скорее, даже увеличивают риск развития КИ-ОПП, поэтому не могут рассматриваться в качестве профилактических средств;
— эффективность применения эфферентных методов (гемодиализ, гемофильтрация) до или после введения рентгеновского контраста, например для элиминации препарата, не доказана, поэтому прибегать к ним не следует (это не означает, что не следует проводить диализ пациентам с наличием показаний при ОПП вследствие введения РКС) [KDIGO Clinical Practice Guideline, 2012].
Рекомендация 4.2.9
Больным с постренальным ОПП показана срочная консультация уролога с решением вопроса о способе устранения мочевой обструкции; вмешательство, направленное на восстановление пассажа мочи, должно быть выполнено как можно раньше, но не позднее 12 часов от момента установления диагноза (NG).
Комментарий
Особенностью реакции почки на острую обструкцию мочевыводящих путей является быстрое развитие воспаления и фибропластических процессов. В течение нескольких часов после экспериментальной окклюзии мочеточника в пораженной почке происходят изменения гидростатических сил и развитие окислительного стресса. Увеличение давления мочи в канальцах многократно увеличивает экспрессию TGF-β1, развиваются апоптоз и воспалительные реакции, опосредованные NF-κB. Быстро развивается накопление внеклеточного матрикса, причем последнее обусловлено увеличением синтеза коллагена и фибронектина (преимущественно активированными фибробластами или миофибробластами) в сочетании с пониженной деградацией матрикса. В течение нескольких последующих дней просвет канальцев расширяется с развитием тубулярной атрофии, прогрессирующего интерстициального фиброза, гибелью нефронов с необратимыми нарушениями функции почки [Al-Ani A., 2015]. Для клинической практики небезынтересны экспериментальные данные об обратимости описанных изменений. Показано, что даже кратковременная, 72-часовая, мочевая обструкция приводит к резидуальному функциональному дефекту почки за счет частичной потери нефронов [Rosenzweig B. et al., 2015].
Основная задача лечения постренального ОПП — как можно быстрее устранить нарушение оттока мочи для того, чтобы избежать необратимой потери паренхимы почек. Поэтому выжидательную тактику при мочевой обструкции нельзя считать приемлемой. Кроме того, своевременное устранение обструкции является органопротективной стратегией, а кроме того, позволяет предотвратить развитие системных осложнений дисфункции почек.
Рекомендация 4.2.10
Лечение ренального ОПП, возникшего в результате поражения клубочков, микрососудов почки и воспаления интерстиция, следует проводить в условиях нефрологического отделения на основе принципов доказательной медицины и в соответствии с существующими принципами и клиническими рекомендациями (NG).
Рекомендация 4.2.10.1
При подозрении или выявлении ОПП, связанного с действием токсического экзогенного продукта или ксенобиотика, следует осуществить консультацию специалиста в области токсикологии для определения способа детоксикации, включая экстракорпоральные методы (NG).
Рекомендация 4.2.10.2
Агонисты допаминергических рецепторов (дозы допамина менее 3 мкг/кг/мин (1А), фенолдопам (2С), предсердный натрийуретический пептид (2С), рекомбинантный человеческий инсулиноподобный фактор роста 1 (1В) не обладают нефропротективными свойствами, поэтому их применение в группах высокого риска с целью профилактики ОПП не оправданно.
Рекомендация 4.2.10.3
Возникновение жизнеугрожающих осложнений дисфункции почек — гиперволемии/гипергидратации, нарушений электролитного баланса и кислотно-основного состояния является показанием для срочного начала лечебно-профилактических мероприятий, которые включают консервативную терапию, в соответствии с существующими подходами и принципами доказательной медицины и ЗПТ (1А).
Рекомендация 4.2.10.4
ЗПТ у пациентов с ОПП следует начинать ургентно при наличии следующих абсолютных показаний:
— жизнеугрожающей и рефрактерной к медикаментозной терапии гипергидратации;
— гиперкалиемии (> 6,5 ммоль/л);
— клинических проявлений уремической интоксикации;
— тяжелом метаболическом ацидозе (рН < 7,1) (1А).
Рекомендация 4.2.10.5
Ургентное проведение ЗПТ вне абсолютных показаний (см. Рекомендацию 4.2.10.4) оправдано только целью быстрого удаления из циркуляции диализируемого токсического экзогенного продукта или ксенобиотика, которые могли стать причиной ОПП (NG).
Рекомендация 4.2.10.6
У пациентов с признаками прогрессирующего ОПП при динамическом наблюдении целесообразно начинать ЗПТ до появления угрожающих жизни осложнений (гиперкалиемия, выраженный ацидоз, перегрузка жидкостью или уремия) с целью их вторичной профилактики (2В).
Комментарий
При проведении ЗПТ необходимо учитывать риски, связанные с наличием временного сосудистого доступа, инфекции и антикоагулянтной терапии. Как правило, необходимость применения ЗПТ возникает при ОПП 3-й стадии (но не ограничивается этим). Показания для начала ЗПТ можно (с некоторой долей условности и вследствие ограниченности данных исследований) разделить на абсолютные и относительные (табл. 4.6). Начало ЗПТ по относительным показаниям целесообразно обсудить с нефрологом.
Очевидно, что основными клиническими ситуациями, требующими решения вопроса о проведении ЗПТ, являются следующие:
1) выявление ОПП в стадии уже развившихся жизнеугрожающих осложнений, которые являются абсолютными показаниями к срочному началу ЗПТ;
2) прогрессирующее снижение функции почек у пациента с ранее выявленным ОПП и находящегося под динамическим наблюдением.
В последнем случае оптимальное время начала ЗПТ не определено, однако очевидно, что в таких случаях ЗПТ нужно начинать заранее, до развития критических осложнений ОПП (абсолютных показаний), представляющих угрозу жизни [Thakar C.V. и соавт., 2013]. В литературе имеются ограниченные сведения о том, что начало ЗПТ при уровне мочевины 21–27 ммоль/л связано со снижением смертности в сравнении с более высокими уровнями (> 37 ммоль/л).
Гемодиализ помогает справиться со многими осложнениями, возникающими в ходе течения ОПП, поэтому его своевременное начало, под которым следует понимать прежде всего патогенетически обоснованное применение этого метода лечения, безусловно, улучшает прогноз ОПП в целом. Однако дискуссия о необходимости раннего начала гемодиализа при ОПП, иногда инициируемая некоторыми специалистами, беспочвенна по причине неправильной постановки вопроса. Гемодиализ в лучшем случае не влияет на процессы репарации в почечной паренхиме, а в некоторых ситуациях может оказать даже отрицательное воздействие на скорость восстановления функции почек.
Интермиттирующий гемодиализ может быть использован при острых отравлениях барбитуратами, соединениями тяжелых металлов и мышьяка, дихлорэтаном, метиловым спиртом, этиленгликолем, хинином и рядом других токсических веществ.
Вещества, удаляемые во время гемодиализа при острых отравлениях: азатиоприн, аллопуринол, амикацин, аминофиллин, ампициллин, анальгетики, атенолол, ацетаминофен, ацетон, бацитрацин, бромиды, ванкомицин. гентамицин, дигоксин, изопропанол, ингибиторы АПФ, ингибиторы МАО, йодиды, калий, камфора канамицин, карбенициллин, колхицин, литий, маннитол, метанол, метилдопа, метилпреднизолон, мышьяк, неомицин, паральдегид, паракват, пенициллин, пропранолол, салицилаты, свинец, спирты, стрептомицин, стрихнин, сульфонамиды, теофиллин, тетрациклин, тобрамицин, хлоралгидрат, химиотерапевтические средства, хинин, хлориды, хлороквин, фенобарбитал, флуорид, фолиевая кислота, фосфаты, 5-фторурацил, цефамандол, циклосерин, эрготамин, этиленгликоль.
Рекомендация 4.2.11
Для лечения и профилактики развития угрожающих жизни осложнений ОПП может быть использован любой доступный в данном лечебном учреждении метод ЗПТ (NG).
Рекомендация 4.2.11.1
Предпочтительными методами ЗПТ следует считать интермиттирующий гемодиализ и вено-венозную гемодиафильтрацию, применение которых одинаково эффективно у больных с ОПП (NG).
Рекомендация 4.2.11.2
Интермиттирующий гемодиализ является процедурой выбора по медико-экономическим причинам (NG).
Рекомендация 4.2.11.3
Продленные процедуры или увеличение времени проведения интермиттирующей процедуры следует рассматривать как предпочтительные в случаях острого церебрального повреждения, фульминантной печеночной недостаточности и нестабильной гемодинамики (NG).
Рекомендация 4.2.11.4
Диализаторы должны быть с биосовместимой синтетической мембраной, адекватной площади и с удовлетворительными клиренсовыми характеристиками. Не допускается повторное использование диализаторов (NG).
Рекомендация 4.2.11.5
Диализирующий раствор должен готовиться из набора сухих солей или жидкого концентрата фабричного изготовления и контролироваться на содержание пирогенов (NG).
Комментарий
Очевидно, что в условиях ограниченных возможностей с целью предотвращения гибели пациента от осложнений ОПП следует применять любой имеющийся в распоряжении метод ЗПТ.
Наиболее распространенными и зарекомендовавшими себя в клинической практике методами являются стандартный гемодиализ и продленные процедуры ЗПТ (ПЗПТ). Существующие данные не позволяют считать, что какая-либо из этих процедур имеет преимущество в терминах снижения летальности и скорости восстановления функции почек, а целесообразность применения интермиттирующего гемодиализа определяется экономикой.
Также нет убедительных данных о том, что интенсификация гемодиализа (увеличение KT/V одиночной процедуры или увеличение частоты процедур) или интенсификация продленной процедуры (> 20–25 мл/кг/ч) приводит к улучшению клинических исходов ОПП, включая выживаемость.
В большинстве случаев при острой дисфункции почек требуется экстренно удалить избыток жидкости и некоторых ионов. Для этой цели достаточно проведения стандартного интермиттирующего ежедневного гемодиализа. В качестве временного доступа рекомендуется катетеризация одной из югулярных вен под контролем УЗИ.
Первую пробную процедуру рекомендуется проводить не более 1,0–1,5 часа, если состояние больного не требует иного. В дальнейшем длительность ежедневных процедур интермиттирующего гемодиализа постепенно (под контролем состояния пациента и концентрации азотистых метаболитов и электролитов) увеличивают до 3–4 часов, а величину KT/V доводят до > 1,2. Достижение хотя бы одного из указанных показателей является поводом для перевода больного на три процедуры интермиттирующего гемодиализа в неделю.
Скорость потока диализата рекомендуется не ниже 500 мл/мин, температура диализирующего раствора 36–37 ºС. Скорость кровотока при доступе через центральный венозный катетер в среднем составляет 250–300 мл/мин и подбирается индивидуально в соответствии с состоянием гемодинамики больного. При концентрации мочевины в сыворотке крови более 40 ммоль/л рекомендуется во избежание дисэквилибриум-синдрома длительность процедуры и скорость кровотока уменьшить таким образом, чтобы получить URR около 40 %. Обычно для этого выставляют скорость кровотока, равную трехкратной массе тела больного в килограммах для взрослых пациентов.
Недостаточная эффективность диализа может быть связана с рециркуляцией крови в катетере (чаще всего при бедренном доступе). Нередко процедуру приходится прерывать из-за развития гипотензии. Сопутствующая инфузионная терапия снижает уровень мочевины за счет разведения крови и также может уменьшать эффективность диализа. При недостаточной эффективности диализа вследствие любых причин рекомендуется проводить два коротких сеанса интермиттирующего диализа в течение суток либо переходить на продленные или гибридные процедуры. Техническое обеспечение гемодиализной процедуры требует строгого соблюдения имеющихся нормативов, включая ГОСТ РФ на воду для гемодиализа. Следует помнить, что качество солей, используемых для приготовления концентрированных диализирующих растворов, выше существующих в РФ требований фармакопеи, в связи с чем необходимо применять продукты фабричного изготовления. Наиболее приемлемым и оптимальным способом является использование бикарбонатного картриджа для приготовления раствора В в режиме он-лайн в сочетании с жидким концентратом А фабричного изготовления. Замещающие растворы при гемодиафильтрации должны быть апирогенны. Могут использоваться как готовые растворы в фабричной упаковке, так и растворы, приготовленные в режиме он-лайн. В последнем случае особо высокие требования предъявляются к качеству воды, солей и диализному оборудованию в соответствии с технической документацией производителя.
Продленные процедуры позволяют удалять вещества молекулярной массой более 10 кДа, более физиологичны в плане восстановления гомеостаза и волемического статуса, наиболее эффективны при нестабильной гемодинамике. Однако они сокращают пропускную способность диализной аппаратуры, требуют больших доз антикоагулянтов, постоянного контроля со стороны медперсонала, имеют существенно более высокую стоимость. Рекомендуемая скорость замещения — 20–25 мл/кг/ч, однако следует учитывать, что на практике реальная скорость оказывается меньше назначенной (на 20–25 %). Есть данные о небольших группах сравнения о том, что при одинаковой эффективности артерио-
венозной и вено-венозной гемодиафильтрации последняя при одинаковой эффективности имела меньшее число осложнений сосудистого доступа.
Перитонеальный диализ также может использоваться при ОПП, однако РКИ по его применению отсутствуют. К преимуществам этого вида ЗПТ можно отнести простоту, доступность, отсутствие необходимости применения антикоагулянтов. Однако ПД не лишен недостатков. К ним в первую очередь относят относительно невысокие клиренсы уремических токсинов, трудно регулируемую ультрафильтрацию, зависимость от объема брюшины, риск перитонита.
Количество обмениваемой жидкости выбирают индивидуально с учетом состояния внешнего дыхания, объема брюшной полости, а также типа перитонеального катетера. Начинают с введения 1,0–1,5 л раствора, при хорошей переносимости увеличивают объем вливаемого раствора до 2,0 л. Пациентам с большим объемом брюшной полости обменивают за цикл по 2,5–3 л раствор. Обмены производят каждый час. В процессе ПД в брюшную полость вводят гепарин (500 ЕД на 1 л раствора), чтобы предупредить закупорку катетера сгустками фибрина. Введенный в брюшную полость гепарин не реабсорбируется и практически не увеличивает опасность кровотечения. Пациенты, находящиеся на ПД и парентеральном питании, нуждаются в дополнительном введении аминокислот и белка.
Рекомендация 4.2.12
У больных с ОПП, требующих проведения ЗТП, необходим дифференцированный подход к проведению антикоагулянтной терапии (NG).
Рекомендация 4.2.12.1
У больных с ОПП, требующих проведения ЗТП, при решении вопроса о характере антикоагулянтной терапии не рекомендуется использовать шкалы оценки риска кровотечений HAS-BLED, CRUSADE, ATRIA (NG).
Рекомендация 4.2.12.2
У пациентов с низким или средним риском кровотечения, нарушениями коагуляции, не получающих системные антикоагулянты при проведении интермиттирующей ЗПТ, рекомендуется использовать нефракционированный или низкомолекулярный гепарин (1С).
Комментарий
Антикоагулянтная терапия необходима при ЗПТ для профилактики тромбирования диализатора (потеря крови в тромбированном диализаторе) и/или снижения проницаемости мембраны. Однако эти положительные эффекты необходимо сопоставлять с риском кровотечений. При использовании нефракционированного гепарина дозу титруют до достижения целевого АЧТВ 60 с. В качестве низкомолекулярного гепарина предпочтительно использовать эноксипарин в дозе 1 мг/кг массы тела. При высоком риске развития кровотечения доза снижается до 0,5 мг/кг массы тела с последующей инфузией препарата 0,05 мг/кг/ч.
У пациентов с тромбоцитопенией, увеличением протромбинового времени или АЧТВ, обусловленными основным заболеванием (например, печеночной недостаточностью) или дилюционной коагулопатией, дополнительная антикоагулянтная терапия при ЗПТ не имеет преимуществ [Bellomo R. и соавт., 2009; Palevsky P.M. и соавт., 2008].
Низкомолекулярный и нефракционированный гепарин одинаково безопасны в отношении риска кровотечения и эффективны в отношении тромбоза экстракорпорального контура [Lim W. и соавт., 2004]. Однако применение низкомолекулярного гепарина более удобно (одна болюсная инъекция в начале интермиттирующего ГД) и из-за низкого риска развития гепарининдуцированной тромбоцитопении, а также отдаленных побочных эффектов (дислипидемия, остеопороз, гиперальдостеронизм) [European Best Practice Guidelines for Haemodialysis, 2002].
Однако необходимо помнить о том, что элиминация низкомолекулярных гепаринов осуществляется преимущественно почками. В связи с этим при ОПП возможна кумуляция препарата, что увеличивает риск кровотечения.
Поэтому дозы препаратов при интермиттирующем ГД следует подбирать индивидуально в зависимости от наличия/отсутствия нарушений коагуляции и/или риска кровотечений.
Рекомендация 4.2.12.3
При продленных процедурах ЗПТ рекомендуется использовать регионарную антикоагуляцию цитратом (при отсутствии противопоказаний для введения цитрата) (2B).
Рекомендация 4.2.12.4
При наличии противопоказаний для введения цитрата рекомендуется использовать низкомолекулярный гепарин (2C).
Рекомендация 4.2.12.5
У пациентов с высоким риском кровотечения, не получающих системную антикоагулянтную терапию, рекомендуется использовать регионарную цитратную антикоагуляцию (при отсутствии противопоказаний для введения цитрата) (2C).
Комментарий
Антикоагулянтное действие цитрата натрия заключается в образовании комплекса с ионизированным кальцием и, таким образом, прерывании коагуляционного каскада. Часть цитрата потребляется в экстракорпоральном контуре. Цитрат, попадающий в системную циркуляцию, быстро метаболизируется в печени, мышцах и почках с высвобождением кальция и образованием бикарбоната. Экстракорпоральные потери кальция необходимо компенсировать дополнительно инфузиями растворов кальция.
При проведении процедуры ЗПТ дозу цитрата титруют до достижения уровня ионизированного кальция после диализатора менее 1,2 мг/дл (0,3 ммоль/л).
Рекомендация 4.2.12.6
Рекомендуется избегать применения регионарной гепаринизации при проведении продленных процедур ЗПТ у пациентов с высоким риском кровотечения (2C).
Рекомендация 4.2.13
Режимы и техника выполнения отдельной процедуры или серии процедур ЗПТ должны быть индивидуализированы и направлены на обеспечение необходимого контроля и ликвидацию ведущих осложнений ОПП (NG).
Рекомендация 4.2.14
При проведении интермиттирующего ГД следует стремиться к достижению KТ/V за одну процедуру ≥ 1,2 или > 3,9 за неделю (1B); если по тем или иным причинам достижение такой дозы диализа невозможно, то следует увеличить частоту или время выполнения процедур (NG).
Рекомендация 4.2.15
ЗПТ следует продолжать до тех пор, пока не произойдет восстановление функций органа до уровня, обеспечивающего достаточное водовыделение, азотистый и электролитный баланс, поддержание КОС (NG).
Комментарий
В качестве ориентировочных критериев для принятия решения о прекращении процедур ЗПТ можно использовать следующие показатели:
— диурез более 0,5 мл/кг/ч при суточной потребности в петлевых диуретиках не более 200 мг/сут и ЦВД не выше 15 мм вод.ст.;
— концентрацию калия в сыворотке крови не выше 5,6 ммоль/л;
— отсутствие тяжелого метаболического ацидоза (SB более 15 ммоль/л без инфузий бикарбоната натрия);
— концентрацию мочевины в сыворотке крови перед началом очередного сеанса гемодиализа менее 20 ммоль/л.
Часть иллюстративных материалов заимствована из: Смирнов А.В., Добронравов В.А., Румянцев А.Ш., Каюков И.Г. Острое повреждение почек. — М.: МИА, 2015, с разрешения издательства «Медицинское информационное агентство», г. Москва (Россия)
*Рабочая группа членов Ассоциации нефрологов России
Руководители группы
Смирнов А.В., директор Научно-исследовательского института нефрологии
Первого Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова, д.м.н., профессор
Добронравов В.А., заместитель директора Научно-исследовательского института нефрологии Первого Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова, д.м.н., профессор
Члены группы
Румянцев А.Ш., профессор кафедры факультетской терапии медицинского факультета
Санкт-Петербургского государственного университета, д.м.н.
Шилов E.М., заведующий кафедрой нефрологии и гемодиализа Института профессионального образования Первого Московского государственного медицинского университета им. И.М. Сеченова, главный внештатный специалист, нефролог Министерства здравоохранения России, д.м.н., профессор
Ватазин А.В., руководитель отдела оперативной нефрологии и хирургической гемокоррекции Московского областного научно-исследовательского института им. М.Ф. Владимирского, д.м.н., профессор
Каюков И.Г., заведующий лабораторией клинической физиологии почек Научно-исследовательского института нефрологии Первого Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова, д.м.н., профессор
Кучер А.Г., профессор кафедры пропедевтики внутренних болезней Первого Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова, д.м.н.
Есаян А.М., заведующий кафедрой нефрологии и диализа Первого Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова, д.м.н., профессор
Материал публикуется с разрешения авторов
и редакции журнала «Нефрология».
Впервые опубликовано в журнале
«Нефрология». — 2016. — 20(2). — 86-100
Список литературы
1. Добронравов В.А. Обзор патофизиологии острого повреждения почек // Острое повреждение почек / А.В. Смирнов, В.А. Добронравов, А.Ш. Румянцев, И.Г. Каюков. — М.: МИА, 2015. — 30-79.
2. Каюков И.Г., Смирнов А.В., Эмануэль В.Л. Цистатин С в современной медицине // Нефрология. — 2012. — 16(1). — 22-39.
3. Каюков И.Г., Смирнов А.В. Рентгеноконтрастная нефропатия // Нефрология: Национальное руководство / Под ред. Мухина Н.А. — М.: ГЭОТАР-Медиа, 2009. — 688-704.
4. Смирнов А.В. Клиника и диагностика острого повреждения почек // Острое повреждение почек / А.В. Смирнов, В.А. Добронравов, А.Ш. Румянцев, И.Г. Каюков. — М.: МИА, 2015. — 80-206.
5. Смирнов А.В. Клинические синдромы острого повреждения почек // Острое повреждение почек / А.В. Смирнов, В.А. Добронравов, А.Ш. Румянцев, И.Г. Каюков. — М.: МИА, 2015. — 207-304.
6. Смирнов А.В, Добронравов В.А., Каюков И.Г. Кардиоренальный континуум: патогенетические основы превентивной нефрологии // Нефрология. — 2005. — 9(3). — 7-15.
7. Смирнов А.В., Каюков И.Г., Дегтерева О.А. и др. Проблемы диагностики и стратификации тяжести острого повреждения почек // Нефрология. — 2009. — 13(3). — 9-18.
8. Al-Ani A1., Al-Jalham K., Ibrahim T. et al. Factors determi-ning renal impairment in unilateral ureteral colic secondary to calcular disease: a prospective study // Int. Urol. Nephrol. — 2015. — 47(7). — 1085-1090.
9. Bagshaw S.M., Hoste E.A., Braam B., Briguori C., Kellum J.A., McCullough P.A., Ronco C. Cardiorenal syndrome type 3: pathophysiologic and epidemiologic considerations // Contrib. Nephrol. — 2013. — 182. — 137-157.
10. Bainey K.R., Rahim S., Etherington K. et al. Effects of withdrawing vs continuing renin-angiotensin blockers on incidence of acute kidney injury in patients with renal insufficiency undergoing cardiac catheterization: Results from the Angiotensin Converting Enzyme Inhibitor/Angiotensin Receptor Blocker and Contrast Induced Nephropathy in Patients Receiving Cardiac Catheterization (CAPTAIN) trial // Am. Heart J. — 2015. — 170(1). — 110-116.
11. Basi S., Pupim L.B., Simmons E.M. et al. Insulin resistance in critically ill patients with acute renal failure // Am. J. Physiol. Renal. Physiol. — 2005. — 289. — 259-264.
12. Bellomo R., Ronco C., Kellum J.A., Mehta R.L., Palevsky P. Acute Dialysis Quality Initiative workgroup. Acute renal failure – definition, outcome measures, animal models, fluid therapy and information technology needs: the Second International Consensus Conference of the Acute Dialysis Quality Initiative (ADQI) Group // Crit. Care. — 2004. — 8. — 204-212.
13. Bellomo R., Cass A., Cole L. et al. Intensity of continuous renal replacement therapy in critically ill patients // N. Engl. J. Med. — 2009. — 361. — 1627-1638.
14. Bonventre J.V., Vaidya V.S., Schmouder R. et al. Next-ge-neration biomarkers for detecting kidney toxicity // Nat. Biotechnol. — 2010. — 28(5). — 436-440.
15. Bouman C., Kellum J.A., Levin N. Definition of acute renal failure. Acute Dialysis Quality Initiative. 2nd International Consensus Conference, 2002; National Kidney Foundation KD: Clinical practice guidelines for chronic Kidney disease: Evaluation, classification and stratification // Am. J. Kidney Dis. — 2002. — 39 [Suppl. 1]. — 1-266.
16. Bucaloiu I.D., Kirchner H.L., Norfolk E.R. et al. Increased risk of death and de novo chronic kidney disease following reversible acute kidney injury // Kidney Int. — 2012. — 81(5). — 477-485.
17. Case J., Khan S., Khalid R., Khan A. Epidemiology of acute kidney injury in the intensive care unit // Crit. Care Res. Pract. — 2013. — 479730. — doi: 10.1155/2013/479730. Epub 2013 Mar 21.
18. Casaer M.P., Mesotten D., Schetz M.R. Bench-to-bedside review: metabolism and nutrition // Crit. Care. — 2008. — 12(4). — 222.
19. Chowdhury A.H., Cox E.F., Francis S.T., Lobo D.N. A randomized, controlled, double-blind crossover study on the effects of 2-L infusions of 0.9% saline and plasma-lyte(R) 148 on renal blood flow velocity and renal cortical tissue perfusion in healthy volunteers // Annals of Surgery. — 2012. — 256(1). — 18-24.
20. Coca S.G., Singanamala S., Parikh C.R. Chronic kidney disease after acute kidney injury: a systematic review and metaanalysis // Kidney Int. — 2012. — 81(5). — 442-448.
21. Cogliati A.A., Vellutini R., Nardini A. et al. Fenoldopam infusion for renal protection in high-risk cardiac surgery patients: a randomized clinical study // J. Cardiothorac. Vasc. Anesth. — 2007. — 21. — 847-85.
22. Conti M., Moutereau S., Zater M. et al. Urinary cystatin C as a specifi c marker of tubular dysfunction // Clin. Chem. Lab. Med. — 2006. — 44(3). — 288-291.
23. Chertow G.M., Burdick E., Honour M. et al. Acute kidney injury, mortality, length of stay, and costs in hospitalized patients // J. Am. Soc. Nephrol. — 2005. — 16. — 3365-3370.
24. Edelstein C.L. Biomarkers in Kidney Disease. — Elsevier Inc., 2011.
25. Ertmer C., Rehberg S., Van Aken H. et al. Relevance of non-albumin colloids in intensive care medicine // Best Pract. Res. Clin. Anaesthesiol. — 2009. — 23. — 193-212.
26. European Best Practice Guidelines for Haemodialysis (Part 1). V. Chronic intermittent haemodialysis and prevention of clotting in the extracorporal system // Nephrol. Dial. Transplant. — 2002. — 17 (Suppl. 7). — 63-71.
27. Fiaccadori E., Regolisti G., Cabassi A. Specific nutritional problems in acute kidney injury, treated with non-dialysis and dialytic modalities // NDT Plus. — 2010. — 3(1). — 1-7.
28. Fiaccadori E., Regolisti G., Maggiore U. Specialized nutritional support interventions in critically ill patients on renal replacement therapy // Curr. Opin. Clin. Nutr. Metab. Care. — 2013. — 16(2). — 217-224.
29. Fouque D., Kalantar-Zadeh K., Kopple J. et al. A proposed nomenclature and diagnostic criteria for protein-energy wasting in acute and chronic kidney disease // Kidney Int. — 2008. — 73(4). — 391-398.
30. Friedrich J.O., Adhikari N., Herridge M.S., Beyene J. Meta-analysis: low-dose dopamine increases urine output but does not prevent renal dysfunction or death // Ann. Intern. Med. — 2005. — 142. — 510-524.
31. Fuiano G., Mazza G., Comi N. et al. Current indications for renal biopsy: a questionnaire-based survey // Am. J. Kidney Dis. — 2000. — 35(3). — 448-457.
32. Geus H., Betjes M., Bakker J. Biomarkers for the prediction of acute kidney injury: a narrative review on current status and future challenges // Clin. Kidney J. — 2012. — 5(2). — 102-108.
33. Giampietri C., Starace D., Petrungaro S., Filippini A., Ziparo E. Necroptosis: Molecular signalling and translational Implications // Int. J. Cell. Biol. — 2014. — 490275.
34. Gibney N.I., Hoste E., Burdmann E.A. et al. Timing of initiation and discontinuation of renal replacement therapy in AKI: unanswered key questions // Clin. J. Am. Soc. Nephrol. — 2008. — 3(3). — 876-880.
35. Haase M., Bellomo R., Haase-Fielitz A. Serum cystatin C may diagnose rather than predict acute kidney injury // Am. J. Kidney Dis. — 2012. — 59(4). — 582.
36. Haase N., Perner A., Hennings L.I. et al. Hydroxyethyl starch 130/0.38-0.45 versus crystalloid or albumin in patients with sepsis: systematic review with meta-analysis and trial sequential analysis // BMJ. — 2013. — 346. — f839.
37. Hirschberg R.I., Kopple J., Lipsett P. et al. Multicenter clinical trial of recombinant human insulin-like growth factor I in patients with acute renal failure // Kidney Int. — 1999. — 55(6). — 2423-2432.
38. Ho K.M., Power B.M. Benefits and risks of furosemide in acute kidney injury // Anaesthesia. — 2010. — 65(3). — 283-293.
39. Hoste E.A., Clermont G., Kersten A., Venkataraman R., Angus D.C., De Bacquer D., Kellum J.A. RIFLE criteria for acute kidney injury are associated with hospital mortality in critically ill patients: a cohort analysis // Crit. Care. — 2006. — 10(3). — R73.
40. Jones J., Holmen J., De Graauw J. et al. Association of complete recovery from acute kidney injury with incident CKD stage 3 and all-cause mortality // Am. J. Kidney Dis. — 2012. — 60(3). — 402-408.
41. Hsu C.Y., McCulloch C.E., Fan D. et al. Community-based incidence of acute renal failure // Kidney Int. — 2007. — 72. — 208-212.
42. Kidney Disease: Improving Global Outcomes (KDIGO) Acute Kidney Injury Work Group. KDIGO Clinical Practice Guideline for Acute Kidney Injury // Kidney Int. — 2012. — Issue 1 Suppl. — 1-126.
43. Korkeila M., Ruokonen E., Takala J. Costs of care, long-term prognosis and quality of life in patients requiring renal replacement therapy during intensive care // Intensive Care Med. — 2000. — 26. — 1824-1831.
44. Lewington A.J.P., Cerdá J., Mehta R.L. Raising awareness of Acute Kidney Injury: A global perspective of a silent killer // Kidney Int. — 2013. — 84(3). — 457-467.
45. Liano F., Pascual J. Epidemiology of acute renal failure: a prospective, multicenter, community-basedstudy. Madrid Acute Renal Failure Study Group // Kidney Int. — 1996. — 50. — 811-818.
46. Lim W., Cook D.J., Crowther M.A. Safety and efficacy of low molecular weight heparins for hemodialysis in patients with end-stage renal failure: a meta-analysis of randomized trials // J. Am. Soc. Nephrol. — 2004. — 15. — 3192-3206.
47. Lobo D.N., Stanga Z., Aloysius M.M. et al. Effect of volume loading with 1 liter intravenous infusions of 0.9% saline, 4% succinylated gelatine (Gelofusine) and 6% hydroxyethyl starch (Voluven) on blood volume and endocrine responses: a randomized, three-way crossover study in healthy volunteers // Critical Care Medicine. — 2010. — 38(2). — 464-470.
48. Lopez-Gomez J.M., Rivera F. Renal biopsy findings in acute renal failure in the cohort of patients in the Spanish Registry of Glomerulonephritis // Clin. J. Am. Soc. Nephrol. — 2008. — 3(3). — 674-681.
49. Macedo E., Bouchard J., Soroko S.H. et al. Fluidh accumulation, recognition and staging of acute kidney injury in critically-ill patients // Crit. Care. — 2010. — 14(3). — R82.
50. Mammen C., Al Abbas A., Skippen P. et al. Long-term risk of CKD in children surviving episodes of acute kidney injury in the intensive care unit: a prospective cohort study // Am. J. Kidney Dis. — 2012. — 59(4). — 523-530.
51. Mårtensson J., Martling C.R., Bell M. Novel biomarkers of acute kidney injury and failure: clinical applicability // Br. J. Anaesth. — 2012. — 109(6). — 843-850.
52. Mehta R.L., Kellum J.A., Shah S.V., Molitoris B.A., Ronco C., Warnock D.G., Levin A. Acute Kidney Injury Network. Acute Kidney Injury Network: report of an initiative to improve outcomes in acute kidney injury // Crit. Care. — 2007. — 11(2). — R31.
53. Murugan R., Kellum J.A. // Nat. Rev. Nephrol. — 2011. — 7. — 209-217.
54. Noto A., Cibecchini F., Fanos V. et al. NGAL and metabolomics: the single biomarker to reveal the metabolome alterations in kidney injury // Biomed. Res. Int. — 2013. — id 612032.
55. Palevsky P.M., Zhang J.H., O’Connor T.Z. et al. Intensity of renal support in critically ill patients with acute kidney injury // N. Engl. J. Med. — 2008. — 359. — 7-20.
56. Patel K., King C.A., Jovin I.S. Angiotensin-converting enzyme inhibitors and their effects on contrast-induced nephropathy aft er cardiac catheterization or percutaneous coronary intervention // Cardiovasc. Revasc. Med. — 2011. — 12. — 90-93.
57. Palevsky P.M., Liu K.D., Brophy P.D., Chawla L.S., Parikh C.R., Thakar C.V., Tolwani A.J., Waikar S.S., Weisbord S.D. KDOQI US commentary on the 2012 KDIGO clinical practice guideline for acute kidney injury // Am. J. Kidney Dis. — 2013. — 61(5). — 649-672.
58. Peng F., Su J., Lin J., Niu W. Impact of renin-angiotensin-aldosterone system-blocking agents on the risk of contrast-induced acute kidney injury: a prospective study and meta-analysis // J. Cardiovasc. Pharmacol. — 2015. — 65(3). — 262-268.
59. Piccinni P., Cruz D.N., Gramaticopolo S., Garzotto F., Dal Santo M., Aneloni G. et al. NE FROINT investigators. Prospective multicenter study on epidemiology of acute kidney injury in the ICU: a critical care nephrology Italian collaborative effort (NEFROINT) // Minerva Anestesiol. — 2011. — 77. — 1072-1083.
60. Rivera F., Lopez-Gomez J.M., Perez-Garcia R. Clinicopathologic correlations of renal pathology in Spain // Kidney Int. — 2004. — 66(3). — 898-904.
61. Ronco C., Haapio M., House A.A., Anavekar N., Bellomo R.J. Cardiorenal syndrome // Am. Coll. Cardiol. — 2008. — 52(19). — 1527-1539.
62. Rosenzweig B., Pinthus J.H., Kleinmann N. et al. The relative contribution of urine extravasation to elevate plasma creatinine levels in acute unilateral ureteral obstruction // Can. Urol. Assoc. J. — 2015. — 9(7–8). — 428-433.
63. Salvadori M., Bertoni E. Update on hemolytic uremic syndrome: Diagnostic and therapeutic recommendations // World J. Nephrol. — 2013. — 2(3). — 56-76.
64. Scheinkestel C.D., Kar L., Marshall K. et al. Prospective randomized trial to assess caloric and protein needs of critically ill, anuric, ventilated patients requiring continuous renal replacement therapy // Nutrition. — 2003. — 19(11–12). — 909-916.
65. Shamir M.Y., Kaplan L., Marans R.S. et al. Urine fl ow is a novel hemodynamic monitoring tool for the detection of hypovolemia // Anesth. Analg. — 2011. — 112(3). — 593-596.
66. Slocum J.L., Heung M., Pennathur S. Marking renal injury: can we move beyond serum creatinine? // Transpl. Res. — 2012. — 159(4). — 277-289.
67. Sward K., Valsson F., Odencrants P. et al. Recombinant human atrial natriuretic peptide in ischemic acute renal failure: a randomized placebocontrolled trial // Crit. Care Med. — 2004. — 32. — 1310-1315.
68. Tagawa M., Ogata A., Hamano T. Pre- and/or Intra-Operative Prescription of Diuretics, but Not Renin-Angiotensin-System Inhibitors, Is Significantly Associated with Acute Kidney Injury after Non-Cardiac Surgery: A Retrospective Cohort Study. — PLoS One, 2015, Jul 6. — 10(7). — e0132507. — doi: 10.1371.
69. Tesch G.H. Review: Serum and urine biomarkers of kidney disease: A pathophysiological perspective // Nephrology (Carlton). — 2010. — 15(6). — 609-616.
70. Thakar C.V., Christianson A., Almenoff P. et al. Degree of acute kidney injury before dialysis initiation and hospital mortality in critically ill patients // Int. J. Nephrol. — 2013. — 827459.
71. Umruddin Z., Moe K., Superdock K. ACE inhibitor or angiotensin II receptor blocker useis a risk factor for contrast-induced nephropathy // J. Nephrol. — 2012. — 25(5). — doi: 10.5301/jn.5000059.
72. Wiedermann C.J. Systematic review of randomized clinical trials on the use of hydroxyethyl starch for fluid management in sepsis // BMC Emerg. Med. — 2008. — 8. — 1-8.
73. Wu V.C., Wu C.H., Huang T.M. et al. Long-Term risk of coronary events after AKI // J. Am. Soc. Nephrol. — 6 February 2014. — doi: 10.1681/ASN.2013060610.
74. Waikar S.S., Liu K.D., Chertow G.M. Diagnosis, epidemiology and outcomes of acute kidney injury // Clin. J. Am. Soc. Nephrol. — 2008. — 3(3). — 844-861.
75. Waikar S.S., Bonventre J.V. Creatinine kinetics and the definition of acute kidney injury // J. Am. Soc. Nephrol. — 2009. — 20(3). — 672-679.
76. Wu P.C., Wu C.J., Lin C.J. et al. Long-term risk of upper gastrointestinal hemorrhage after advanced AKI // Clin. J. Am. Soc. Nephrol. — 2015. — 10(3). — 353-362.
77. Yang R.L., Wang X.T., Liu D.W., Liu S.B. Energy and oxygen metabolism disorder during septic acute kidney injury // Kidney Blood Press Res. — 2014. — 39(4). — 240-251.
78. Zeng X., McMahon G.M., Bates D.W., Waikar S.S. Incidence, outcomes, and comparisons across definitions of AKI in hospitalized individuals // Clin. J. Am. Soc. Nephrol. — 2014. — 9(1). — 12-20.
79. Zhang Z., Lu B., Sheng X. et al. Cystatin C in prediction of acute kidney injury: a systemic review and meta-analysis // Am. J. Kidney Dis. — 2011. — 58(3). — 356-365.

/41.jpg)
/42.jpg)
/42_2.jpg)
/43.jpg)
/43_2.jpg)
/47.jpg)