Международный неврологический журнал 4 (82) 2016
Вернуться к номеру
Взаємозв’язок показників автоімунореактивності та судинорухової функції ендотелію у пацієнтів із початковими проявами хронічної ішемії мозку
Авторы: Тріщинська М.А. - Національна медична академія післядипломної освіти імені П.Л. Шупика, м. Київ, Україна
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
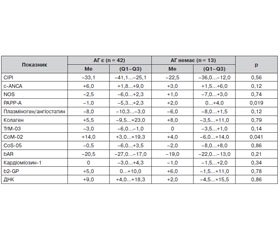
Вступ. Артеріальна гіпертензія (АГ) є одним з основних модифікованих судинних факторів ризику хронічної ішемії мозку (ХІМ). Ендотеліальна дисфункція супроводжує АГ і претендує на роль одного з патогенетичних механізмів розвитку ХІМ. Нами проведено дослідження, метою якого була оцінка показників автоімунореактивності до структурних компонентів серцево-судинної системи залежно від наявності АГ і ендотеліальної дисфункції у пацієнтів із початковими проявами ХІМ. Матеріал і методи. Нами було обстежено 55 осіб середнього віку (51,3 ± 7,0 року) з початковими проявами ХІМ. Усім пацієнтам проводилися загальноклінічне, клініко-неврологічне, клініко-інструментальні та клініко-лабораторні обстеження. Рівень автоантитіл (автоАТ) до антигенів тромбоцитів, кардіоміоцитів і ендотелію судин у сироватці крові пацієнтів визначали за методикою О.Б. Полетаєва. Ендотеліальна функція оцінювалася за показниками потокозалежної вазодилатації, рівнем нітриту та ендотеліну‑1. Результати та обговорення. Пацієнти з АГ та особи без АГ статистично значущо відрізнялися лише за рівнями автоАТ до PAPP-A та СоМ‑02. Залежно від ступеня відхилення артеріального тиску (АТ) (АГ І та ІІ ступеня, клінічна артеріальна гіпотензія або нормальний АТ) пацієнти відрізнялися лише за показниками середнього індивідуального рівня імунореактивності (СІРІ) (р = 0,001) та рівнем автоАТ до ДНК (р = 0,015). Статистичний аналіз показав, що пацієнти з АГ (І та ІІ стадії) та особи без АГ статистично значущо відрізнялися за показником СІРІ (χ2(3) = 11,5; р = 0,009) і рівнем автоАТ до ДНК (χ2(3) = 8,6; р = 0,04). Відсоток потокозалежної вазодилатації статистично значущо корелював з СІРІ (r = 0,409; p = 0,003), а також із рівнем автоАТ до с-ANCA (r = –0,309; p = 0,027) та білка PAPP-A (r = 0,361; p = 0,009). Оцінка судинорухової функції ендотелію за вмістом біохімічних маркерів виявила, що рівень нітриту статистично значущо корелював з відносним умістом автоАТ до СоS‑05 (r = 0,326; p = 0,033) та с-ANCA (r = –0,312; p = 0,042) на відміну від ендотеліну‑1, з рівнем якого не було виявлено статистично значущих кореляційних зв’язків. Висновки. За оцінкою показників автоімунореактивності у пацієнтів із початковими проявами ХІМ залежно від ступеня порушення АТ у пацієнтів з АГ спостерігалося підвищення активності кардіодистрофічних процесів на фоні порушення регулюючих впливів на ліпідний і вуглеводний обмін порівняно з особами без АГ. У міру розвитку ендотеліальної дисфункції, за даними компресійної проби у пацієнтів із початковими проявами ХІМ, спостерігалася тенденція до зниження рівня імунореактивності, активації ендотелію та порушення регулювання ліпідного і вуглеводного обміну.
Введение. Артериальная гипертензия (АГ) является одним из основных модифицируемых факторов риска хронической ишемии мозга (ХИМ). Эндотелиальная дисфункция сопровождает АГ и претендует на роль одного из патогенетических механизмов развития ХИМ. Нами проведено исследование, целью которого явилась оценка показателей аутоиммунореактивности к структурным компонентам сердечно-сосудистой системы в зависимости от наличия АГ и эндотелиальной дисфункции у пациентов с начальными проявлениями ХИМ. Материал и методы. Нами обследованы 55 человек среднего возраста 51,3 ± 7,0 года с начальными проявлениями ХИМ. Всем пациентам проводились общеклиническое, клинико-неврологическое, клинико-инструментальное и клинико-лабораторное обследования. Уровень аутоантител (аутоАТ) к антигенам тромбоцитов, кардиомиоцитов и эндотелиоцитов сосудов в сыворотке крови пациентов определяли по методу О.Б. Полетаева. Эндотелиальную функцию оценивали по показателям потокозависимой вазодилатации, уровню нитрита и эндотелина‑1. Результаты и обсуждение. Пациенты с АГ и лица без АГ статистически значимо отличались по уровню аутоАТ к PAPP-A и СоМ‑02. В зависимости от степени нарушения уровня артериального давления (АД) (АГ І и ІІ степени, АГ или нормальное АД) пациенты отличались по показателю среднего индивидуального уровня иммунореактивности (СИУИ) (р = 0,001) и уровню аутоАТ к ДНК (р = 0,015) согласно критерию Краскала — Уоллиса. Статистический анализ показал, что пациенты с АГ (І и ІІ стадии) и лица без АГ статистически значимо отличались по показателю СИУИ (χ2(3) = 11,5; р = 0,009), уровню аутоАТ к ДНК (χ2(3) = 8,6; р = 0,04). Процент потокозависимой вазодилатации статистически значимо коррелировал с СИУИ (r = 0,409; p = 0,003), а также с уровнем аутоАТ к с-ANCA (r = –0,309; p = 0,027) и к белку PAPP-A (r = 0,361; p = 0,009). Оценка сосудодвигательной функции эндотелия по уровню биохимических маркеров выявила, что уровень нитрита статистически значимо коррелировал с относительным содержанием аутоАТ к СоS‑05 (r = 0,326; p = 0,033) и к с-ANCA (r = –0,312; p = 0,042) в отличие от эндотелина‑1, с уровнем которого не было выявлено статистически значимых корреляционных связей. Выводы. Оценка показателей аутоиммунореактивности у пациентов с начальными проявлениями ХИМ в зависимости от степени нарушения АД показала, что у пациентов с АГ наблюдалось повышение активности кардиодистрофических процессов на фоне нарушения регуляции липидного и углеводного обмена в сравнении с лицами без АГ. По мере развития эндотелиальной дисфункции, согласно данным компрессионной пробы у пациентов с начальными проявлениями ХИМ, наблюдалась тенденция к снижению уровня иммунореактивности, активации эндотелия и нарушению липидного и углеводного обмена.
Introduction. Arterial hypertension (AH) is one of the major modified cardiovascular risk factors of chronic cerebral ischemia (ChCI). Endothelial dysfunction is associated with AH and is claimed to be one of the pathogenic mechanisms of the ChCI. We have conducted a study, the objective of which was to evaluate autoimmune reactivity to the structural components of the cardiovascular system, depending on the presence of AH and endothelial dysfunction in patients with initial manifestations of ChCI. Material and methods. We have examined 55 patients of middle age (51.3 ± 7.0 years) with initial manifestations of the ChCI. All patients underwent general clinical, clinical and neurological, clinical and instrumental, clinical and laboratory tests. The level of autoantibodies (autoAB) to platelet antigens, cardiomyocytes and vascular endothelium in the blood serum of patients was determined by the method of O.B. Poletaiev. Endothelial function was assessed in terms of flow-dependent vasodilation, the level of nitrite and endothelin‑1. Results and discussion. Patients with AH and those without AH statistically significantly differed only by the levels of autoAB to PAPP-A and CoM‑02. Depending on the degree of blood pressure (BP) deviation (AH degree I and II, clinical hypotension or normal BP), the patients differed only in terms of average individual level of immune reactivity (AILI) (p = 0.001) and the level of autoAB to DNA (p = 0.015). Statistical analysis showed that patients with AH (stage I and II) and individuals without AH were statistically significantly different in terms of AILI (χ2(3) = 11.5; p = 0.009) and the level of autoAB to DNA (χ2(3) = 8.6; p = 0.04). The percentage of flow-dependent vasodilation statistically significantly correlated with AILI (r = 0.409; p = 0.003), as well as with the level of autoAB to c-ANCA (r = –0.309; p = 0.027) and PAPP-A protein (r = 0.361; p = 0.009). Evaluation of vasomotor endothelial function by content of the biochemical markers discovered that nitrite levels statistically significant correlated with relative content of autoAB to CoS‑05 (r = 0.326; p = 0.033) and the c-ANCA (r = –0.312; p = 0.042) in contrast to endothelin‑1 level, which showed no statistically significant correlations. Conclusions. Patients with AH had an increased activity of cardiodegenerative processes against the background of disturbed regulatory influences on the lipid and carbohydrate metabolism in comparison with individuals without AH, as indicated by the evaluation of autoimmune reactivity in patients with initial manifestations of ChCI depending on the degree of BP disorders. With the development of endothelial dysfunction, according to compression test in patients with initial manifestations of ChCI, there was a downward trend in immune reactivity, endothelial activation and violation of lipid and carbohydrate metabolism regulation.
хронічна ішемія мозку, початкові прояви, артеріальна гіпертензія, автоімунологічна реактивність, ендотеліальна функція.
хроническая ишемия мозга, начальные проявления, артериальная гипертензия, аутоиммунологическая реактивность, эндотелиальная дисфункция.
chronic cerebral ischemia, initial manifestations, arterial hypertension, autoimmune reactivity, endothelial function.
Статтю опубліковано на с. 37-42
Хронічна ішемія мозку (ХІМ) розвивається внаслідок функціональних і структурних порушень у судинах головного мозку під впливом ряду судинних факторів ризику [9]. Одним із найбільш агресивних і прогнозованих за впливом на мозкові судини факторів ризику є артеріальна гіпертензія (АГ) [8, 16]. Реакція мозкових судин на стійке підвищення системного артеріального тиску (АТ) має адаптивний характер (структурна і функціональна адаптація) — розвиваються гіпертрофія середньої оболонки, гіпереластоз, мікроеластофіброз, вогнищеві й циркуляторні м’язово-еластичні потовщення внутрішньої оболонки, склероз стінки артерії. До адаптивної реакції відносять не тільки зміни в артеріях, але й у тканині головного мозку, судинах мікроциркуляторного русла (утворюються конволюти — мікросудини з декількома просвітами) [3]. Наведені зміни у судинній стінці відбуваються за умови порушення функціональної та/або структурної цілісності судинного ендотелію, що підтримує гомеостаз у серцево-судинній системі за рахунок збалансованого синтезу біологічно активних речовин, протилежно направлених за дією на судинний тонус, структурну цілісність судинної стінки, гемостаз та імунологічну активність [7, 13].
Матеріал і методи
Результати та обговорення
Висновки
1. Бисярина В.П. Артериальные сосуды и возраст / В.П. Бисярина, В.М. Яковлев, П.Я. Кукса. — М.: Медицина, 1986. — 224 с.
2. Кузьменко Л.Г. Методы группы ЭЛИ-Тест в клинической лабораторной практике / Л.Г. Кузьменко, А.Б. Полетаев. — М.: Мед. информационное агентство, 2004. — 46 с.
3. Лелюк В.Г. Церебральное кровообращение и артериальное давление / В.Г. Лелюк, С.Э. Лелюк. — М.: Реальное время, 2004. — С. 304.
4. Bian K. Nitric oxide — biogeneration, regulation, and relevance to human diseases [Text] / K. Bian, F. Murad // Frontiers in Bioscience. — 2003. — № 8. — Р. 264-278.
5. Celermajer D.S. Non-invasive detection of endothelial dysfunction in children and adults at risk of atherosclerosis [Text] / D.S. Celermajer, K.E. Sorensen, V.M. Goochetal // Lancet. — 1992. — Vol. 340. — P. 1111-1115.
6. Davignon J. Role of Endothelial Dysfunction in Atherosclerosis [Text] / J. Davignon, P. Ganz // Circulation. — 2004. — № 109. — Р. 27-32.
7. Galley H.F. Physiology of the endothelium [Text] / H.F. Galley, N.R. Webster // British Journal of Anaesthesia. — 2004. — № 93(1). — Р. 105-13.
8. Goff D.C. 2013 ACC/AHA Guideline on the Assessment of Cardiovascular Risk [Text] / D.C. Goff, D.M. Lloyd-Jones, G. Bennett, S. Coady, R.B. D’Agostino, R. Gibbons et al. // Circulation. — 2013. — Vol. 129, Issue 25. — P. S49–S73. doi: 10.1161/01.cir.0000437741.48606.98.
9. Guidelines for the Primary Prevention of Stroke [Text] / J.F. Meschia, C. Bushnell, B. Boden-Albala, L.T. Braun, D.M. Bravata, S. Chaturvedi et al. // Stroke. — 2014. — Vol. 45, Issue 12. — P. 3754-3832. doi: 10.1161/str.0000000000000046.
10. Kuvin J.T. Clinical utility of endothelial function testing: ready for prime time? / J.T. Kuvin, R.H. Karas // Circulation. — 2003. — № 107(25). — Р. 3243-3247.
11. Mancia G. 2013 ESH/ESC Guidelines for the management of arterial hypertension [Text] / G. Mancia, R. Fagard, K. Narkiewicz et al. // J. Hypertens. — 2013. — № 31. — Р. 1281-1357.
12. Pepine C.J. Why vascular biology metters? [Text] / C.J. Pepine // Am. J. Cardiology. — 2001. — № 88(8).
13. Radegran G. Nitric oxide in the regulation of vasomotor tone in human skeletal muscle [Text] / G. Radegran, B. Saltin // Am. J. Physiol. Heart Circ. Physiol. — 1999. — Vol. 276. — P. 1951-1960.
14. Ruschitzka F.T. Neuroimaging standards for research into small vessel disease and its contribution to ageing and neurodegeneration [Text] / J. Wardlaw, E. Smith, Ch. Cordonnier еt al. // Lancet Neurol. — 2013. — № 12. — P. 822-38.
15. Wardlaw J.M. Neuroimaging standards for research into small vessel disease and its contribution to age in gandneurodegeneration [Text] / J.M. Wardlaw, E.E. Smith, G.J. Biessels, C. Cordonnier, F. Fazekas, R. Frayne et. al // The Lancet Neurology. — 2013. — Vol. 12, Issue 8. — P. 822-838. doi: 10.1016/s1474-4422(13)70124-8.
16. White W.B. Blood pressure load and target organ effects in patients with essential hypertension [Text] / W.B. White // J. Hypertens. — 1991. — № 9 (Suppl. 8). — Р. 39–S41.

/39.jpg)
/40.jpg)