Статья опубликована на с. 88-91
Проблема оптимальной анестезиологической защиты пациента, особенно при кесаревом сечении, по-прежнему остается одной из актуальных задач акушерской анестезиологии. Общая многокомпонентная анестезия с искусственной вентиляцией легких (ИВЛ), которая еще не потеряла своей актуальности в настоящее время при обеспечении абдоминального родоразрешения, несмотря на внедрение современных медицинских технологий и достижений в области фармакологии, не может обеспечить достаточную антиноцицептивную защиту пациентки в период до извлечения плода. Все это сводит к значительному ограничению применение метода при кесаревом сечении.
В связи с этим нейроаксиальная анестезия по-прежнему остается методом выбора при абдоминальном родоразрешении. Однако, обеспечивая полноценную защиту пациента при кесаревом сечении, она не создает достаточную аналгезию в послеоперационном периоде. Периоперационная и послеоперационная боль совершенно различна: если во время операции в основном преобладает механический компонент повреждения, то в послеоперационном периоде — медиаторы повреждения (провоспалительные цитокины, эйкозаноиды, кинины и др.) [3–6, 9].
В настоящее время мультимодальная защита пациента в периоперационном периоде занимает все более прочные позиции в практической анестезиологии и реаниматологии. В последние годы стала широко использоваться в качестве антиноцицептивной защиты упреждающая аналгезия. С этой целью мы впервые в Узбекистане использовали неопиоидный анальгетик Инфулган (парацетамол) фирмы «Юрия-Фарм» в сочетании с Лонгокаином Хеви при кесаревом сечении.
Цель исследования — изучить возможность использования Инфулгана для периоперационной аналгезии, его переносимость и безопасность при акушерских операциях.
Материалы и методы исследования
В клинической практике для оценки боли используется визуально-аналоговая шкала (ВАШ), по которой пациент оценивает свои болевые ощущения от 0 до 10 баллов [1]. Оценку интенсивности боли проводили в покое и при активизации (кашель, дыхательная гимнастика и т.д.) больных. Эффективность обезболивания оценивали по общепринятым клиническим признакам на мониторе Argus Schiller, Швейцария. Центральную гемодинамику оценивали методом эхокардиографического исследования с помощью аппарата –SA-600 фирмы Medison (Южная Корея). Сердечный ритм — методом кардиоинтервалографии. Новорожденных оценивали по шкале Апгар на 1-й и 5-й минуте.
Выполнено 97 операций кесарева сечения у пациенток в возрасте от 21 до 39 лет. В структуре экстрагенитальной патологии преобладала хроническая анемия различной степени тяжести — у 75 (77,3 %), ожирение II cт. — у 45, III — у 18 и IV — у 5 пациенток. 25 из них оперированы по экстренным показаниям, 72 — в плановом порядке. Показанием к операции служили: болезнь оперированной матки, несостоятельность рубца на матке, клинически узкий таз, миопия высокой степени, вторичная родовая слабость. Продолжительность оперативного вмешательства колебалась в пределах от 30 до 72 минут.
Исследование проводили в II группах. I группу составили 49 пациенток, которым упреждающую аналгезию не проводили, во II группе (48) в качестве упреждающей аналгезии за 15–20 минут до операции в/в вводили Инфулган в течение 15 минут [6]. В послеоперационном периоде обезболивание осуществляли Инфулганом, сочетая его при необходимости с наркотическими анальгетиками (морфин). При появлении клиники неадекватной аналгезии осуществляли внутривенную инфузию Инфулгана в дозе 1 г. Плановая суточная доза Инфулгана не превышала 4 г. Длительность терапии не превышала двух дней.
Кесарево сечение выполняли в условиях спинальной анестезии (СА) в положении пациентки на боку на уровне LII-LIV, интратекально вводили Лонгокаин Хеви (0,2–0,15 мг/кг) производства «Юрия-Фарм». Оперативное вмешательство начинали через 5–6 мин после интратекального введения местного анестетика. Исследования ВАШ проводили в VI этапов: I — при появлении клиники неадекватной аналгезии, II — через 30 минут после обезболивания, III — 8 ч, IV — 12 ч, V — 24 и VI — 36 ч. КИГ — в V этапов: I — исходно до операции, II — при появлении клиники неадекватной аналгезии, III — 12 ч, IV — 24 ч и V — 36 ч. Суммарный кортизол и КИГ — в V этапов: I — исходно до операции, II — при появлении клиники неадекватной аналгезии, III — 12 ч, IV — 24 ч и V — 36 ч.
Полученные результаты обработаны статистически с использованием критерия Стьюдента.
Результаты исследования и их обсуждение
Исходное состояние гемодинамики оценивалось как гиподинамический тип кровообращения. На основных этапах анестезии и оперативного вмешательства (кожный разрез, тракция матки (извлечение плода) и окончание операции) отмечали стабильный уровень основных систем жизнеобеспечения. Новорожденных по шкале Апгар в I группе оценивали в 7,9 ± 0,1 балла и 9,80 ± 0,08 балла, во II — соответственно в 8,20 ± 0,11 и 9,78 ± 0,10.
В I группе послеоперационная боль возникала сразу после окончания сенсорно-моторного блока на 235,5 ± 3,1 мин, во II же только на 394,7 ± 2,4 мин и соответствовала 5,60 ± 0,16 балла при кашле в I и 2,80 ± 0,14 — во II, причем в I — с тенденцией к нарастанию.
При решении вопроса о необходимости обезболивания мы ориентировались на критерии максимально допустимой интенсивности боли (пороги вмешательства), по 10-балльной визуально-рейтинговой шкале она составляет 3 балла в покое и 4 балла при движении (кашле) [1].
Через 30 минут (II) после внутривенной инфузии Инфулгана в I группе отмечали уменьшение интенсивности боли до 4,80 ± 0,12, в то время как во II — до 1,50 ± 0,12 (Р < 0,05) относительно исходного уровня (I). На III этапе исследования интенсивность боли по ВАШ в I группе уменьшилась в 1,4 раза относительно исходных показателей и имела характер умеренной, во II она составляла 1,70 ± 0,13 (Р < 0,05). На последующих этапах (IV–VI) отмечали достоверное снижение интенсивности боли относительно исходных показателей, с тем различием, что во II группе через 36 часов после начала аналгезии боли практически отсутствовали, в то время как в I они характеризовались как умеренные.
/89.jpg)
Сравнительная оценка интенсивности боли в исследуемых группах показала, что во II группе, где проводилась упреждающая аналгезия, она была достоверно ниже по сравнению с группой контроля на всех этапах исследования. В 8 (16,3 %) случаях пациенткам I группы с целью аналгезии дополнительно вводили наркотические анальгетики (морфин 10 мг).
Кратность введения Инфулгана в I группе по сравнению со II была в 2 раза выше (Р < 0,05), а продолжительность аналгезии — в 2,1 раза меньше (Р < 0,05) в течение первых суток. На вторые сутки инфулган в I группе вводили в 2,1 раза чаще, чем во II (Р < 0,05), а продолжительность аналгезии составила соответственно 6,40 ± 0,15 ч и 12,50 ± 0,12 ч (Р < 0,05).
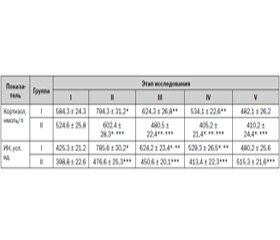
Со стороны суммарного кортизола отмечали достоверное его увеличение в обеих группах после операции при появлении болей. После аналгезии через 24 и 36 часов он был достоверно ниже во II группе относительно исходного уровня — на 22,7–22,8 %. В первой группе изменения носили недостоверный характер (табл. 4).
Сравнительная оценка кортизола в исследуемых группах показала, что после оперативного вмешательства при появлении болей во II группе он был достоверно ниже, чем в I, на 24,2 %, такая же динамика сохранялась и на последующих этапах исследования.
Исходное состояние вегетативной нервной системы (ВНС) характеризовалось умеренной активизацией центральных механизмов управления сердечным ритмом.
На втором этапе отмечали достоверное увеличение активности высших уровней управления сердечным ритмом (ИН) в I группе относительно II на 164,9 % (Р < 0,05). На последующих этапах исследования ИН (I гр.) сохранялся достоверно выше исходных величин и только лишь к концу вторых суток изменения носили недостоверный характер. Во II группе функциональное состояние ВНС имело тенденцию к увеличению на всех этапах исследования, и только к концу исследования оно было достоверно ниже исходного на 29 %. Сравнительная оценка показателей сердечного ритма обеих групп показала, что в I относительно II наблюдали достоверное увеличение активности центральных компенсаторных механизмов регуляции сердечного ритма (табл. 4).
Ни в одном случае не наблюдали осложнений, связанных с заболеваниями желудочно-кишечного тракта.
Проведенные клинические исследования указывают на оптимальную защиту пациентов II группы в периоперационном периоде, где в качестве упреждающей аналгезии использовали Инфулган: оптимальное регулирование управления сердечным ритмом с минимальным участием высших уровней, что указывает на полноценный уровень нейровегетативной защиты; достоверно низкая оценка боли на всех этапах исследования и позднее возникновение болей после окончания операции.
Внутривенное введение Инфулгана в методике мультимодальной анестезии обеспечивает эффективное и безопасное обезболивание в периоперационном периоде в акушерстве, исключая использование для обезболивания наркотических анальгетиков, а следовательно, снижая частоту послеоперационных осложнений и побочных эффектов.
В отличие от других нестероидных противовоспалительных средств Инфулган не имеет присущего им комплекса побочных эффектов, что позволяет использовать его у более широкой категории больных.
Выводы
1. Инфулган высокоэффективен при использовании его в упреждающей аналгезии, послеоперационная боль возникает через 6,5 часа (в группе контроля — через 3,9 ч).
2. Упреждающая аналгезия исключает возможность использования наркотических анальгетиков в послеоперационном периоде без ущерба для качества обезболивания; исключает риск развития депрессии внешнего дыхания у пациентов с высоким риском осложнений.
3. Использование в качестве упреждающей аналгезии и послеоперационного обезболивания Инфулгана обеспечивает вегетативную стабильность в раннем послеоперационном периоде, оптимальное функционирование физиологических систем с участием минимальной активности центральных механизмов управления; не оказывает выраженного влияния на глюкокортикоидную функцию коры надпочечников.
4. Спинальная анестезия 0,5% Лонгокаином Хеви является высокоэффективным методом анестезиологической защиты пациента в периоперационном периоде, не оказывает отрицательного влияния на плод и новорожденного.
5. Применение упреждающей аналгезии Инфулганом в схеме анестезиологического пособия позволит значительно повысить экономический эффект послеоперационного обезболивания и снизит нежелательные эффекты наркотических анальгетиков.
Список литературы
1. Гельфанд Ю.Р., Кириенко П.А., Черниенко Л.Ю., Борзенко А.Г. Послеоперационная аналгезия: современное состояние проблемы // Регионарная анестезия и лечение боли. Тематический сборник. — Москва; Тверь, 2004. — С. 46-60.
2. Лебедева Р.Н., Никода В.В. Фармакотерапия острой боли. — М., 1998.
3. Овечкин А.М. Послеоперационный болевой синдром: клинико-патофизиологическое значение и перспективные направления терапии // Consilium Medicum. — 2005. — Т. 7, № 6. — С. 486-490.
4. Осипова Н.А., Свиридов С.В. Обоснование применения ингибиторов простагландино- и кининогенеза в комплексе общей анестезии и послеоперационного обезболивания // Анестезиол. и реаниматол. — 1993. — № 2. — С. 3-9.
5. Осипова Н.А., Петрова В.В., Митрофанов С.В., Береснев В.А. и др. Средства периферического и сегментарного уровней защиты пациента в системе общей анестезии и послеоперационного обезболивания // Анестезиол. и реаниматол. — 2002. — № 4. — С. 14-19.
6. Осипова Н.А., Петрова В.В., Донскова Ю.С., Маршутина Н.В., Любицев Н.И. Место парацетамола (Перфалгана) в мультимодальной послеоперационной аналгезии // Русский медицинский журнал. — 2006. — Т. 14, № 28. — С. 2014-2018.
7. Bjirkman R. Antinociceptive effects of non-steroidal anti-inflammatory drugs and paracetamol // Acta Anaesthesiol. Scand. — 1995. — 39. — 1039.
8. Ferrante F.M., VadeBoncouer T.R. Postoperative Pain Ma–nagement / Послеоперационная боль. — M., 1998.
9. Koppert W., Webertritz A., Korber N. The cyclooxygenase isoenzime inhibitors parecocsib and paracetamol induce central hyperalgesia in humans // Pain. — 2004. — 108. — 148-153.
10. Schmitt E., Vainchtock A., Nicoloyannis N. Readdy to use injectable paracetamol: easier, safer, lovering workload and costs // Europ. J. of Hospital Pharmacy (E.J.H.P.). — 2003. — V. 9, Iss 6. — Р. 96-102.

/89.jpg)
/90.jpg)