Статтю опубліковано на с. 67-72
Системне запалення тепер розглядається як один із ключових патогенетичних механізмів атерогенезу — від формування атеросклеротичної бляшки до її розриву та розвитку серцево-судинних катастроф. Крім того, активація запалення низької градації визнана одним із факторів розвитку та прогресування артеріальної гіпертензії (АГ), серцевої недостатності та фібриляції передсердь [1–4]. Результати проспективних спостережень засвідчують прогностичну роль високочутливого С-реактивного протеїну (СРП) у розвитку АГ як у жінок, так і в чоловіків: ризик розвитку АГ зростає в 3 рази при підвищенні рівня СРП > 3 мг/л при зіставленні з СРП < 1 мг/л [5]. До того ж вміст в крові СРП корелює з рівнем АТ як у нормотоніків, так і в пацієнтів з АГ. За умов АГ продемонстровано зв’язок між активацією системного запалення, з одного боку, та зростанням жорсткості судинної стінки, гіпертрофією лівого шлуночка (ГЛШ), погіршенням функції нирок — з іншого [6]. Крім того, установлено, що СРП є незалежним предиктором розвитку та прогресування потовщення інтима-медії сонних артерій, ГЛШ та гіпертензивного ураження нирок [7–9].
З урахуванням ролі запалення низької градації в прогресуванні АГ та зв’язку маркерів запалення з рівнем АТ здатність антигіпертензивних препаратів до пригнічення активності системного запалення є предметом досліджень. Найчисельнішими є свідчення на користь блокаторів ренін-ангіотензинової системи, дія яких спрямована на зменшення тканинних, зокрема і мітогенних, ефектів ангіотензину ІІ. Завдяки активації ядерного фактора транскрипції NF-κβ з наступною продукцією молекул адгезії, хемо- та цитокінів ангіотензин ІІ здатен до індукції системного запалення низької градації [1, 10]. У ряді клінічних робіт установлено, що інгібітори ангіотензинперетворюючого ферменту (периндоприл, раміприл) та блокатори АТ1-рецепторів ангіотензину ІІ (БРА) (лозартан, кандесартан, валсартан, олмесартан) зменшують вміст у крові СРП та прозапальних цитокінів, поміж яких найбільш вивчені інтерлейкін-6 (ІЛ-6) і фактор некрозу пухлин α (ФНП-α) [11–15]. Дані щодо впливу інших класів антигіпертензивних препаратів обмежені та менш оптимістичні. Блокатори кальцієвих каналів (амлодипін та лерканідипін) істотно не змінюють рівень СРП у крові хворих на АГ або знижують його вміст за умов високих вихідних значень [16–18].
Проте тільки в поодиноких роботах було вивчено вплив комбінованої терапії на активність системного запалення. Так, у дослідженні Val-MARK (Valsartan-Managing blood pressure Aggressively and evaluating Reductions in hsCRP) було отримано незначне, у межах 8,9 %, проте достовірне зниження рівня СРП під впливом монотерапії валсартаном, тоді як комбінація валсартану з гідрохлоротіазидом не чинила впливу на цей маркер системного запалення. Дослідники припустили, що тіазидоподібний діуретик може стояти на заваді протизапальній дії валсартану [19]. Хоча в дослідженні VAST (Valsartan/HCTZ versus Amlodipine in STage II hypertensive patients) продемонстровано достовірний вплив валсартану в комбінації з гідрохлоротіазидом на рівень СРП, зниження якого становило 13 % через 6 місяців терапії у хворих на ГХ [20].
Ураховуючи, що більшість пацієнтів з АГ потребують комбінованого лікування, дуже цікаве дослідження ефектів фіксованої комбінації валсартану з амлодипіном паралельно з вивченням впливу монотерапії (телмісартан, рацемічна форма амлодипіну — S-амлодипін) щодо маркеру та медіаторів запалення низької градації. Крім того, питання щодо зв’язку між динамікою показників добового моніторування артеріального тиску (АТ) та зменшенням активності системного запалення залишається маловивченим, а результати наявних досліджень носять неоднозначний характер.
Метою роботи є оцінка впливу моно- та комбінованої антигіпертензивної терапії на показники системного запалення у взаємозв’язку з динамікою характеристик добового профілю АТ.
Матеріал і методи
У дослідження включено 99 хворих на ГХ І–ІІ стадії 1–2-го ступеня, середній вік яких на момент первинного обстеження був 56,4 ± 2,2 року, чоловіки становили 43 %. Після 7-денного безмедикаментозного періоду та ініціального обстеження пацієнтам призначали монотерапію телмісартаном у дозі 40–80 мг/добу (29 хворих), S-амлодипіном у дозі 5 мг/добу (27 хворих) та фіксовану комбінацію валсартану з амлодипіном у дозі 160/5 мг/добу (43 хворі). Лікування тривало 6 міс., після чого пацієнти підлягали повторному обстеженню.
Щоб оцінити характеристику циркадного ритму АТ, проводили добове амбулаторне моніторування АТ (ДМАТ) за допомогою монітору ABPM-04 (Meditech, Угорщина) згідно зі стандартним протоколом: вимірювання АТ кожні 15 хвилин у період денної активності (з 7-ї до 22-ї години) і кожні 30 хвилин під час нічного сну (з 22-ї до 7-ї години).
Активність системного запалення оцінювали на основі дослідження вмісту в крові С-реактивного протеїну та прозапальних цитокінів — ІЛ-6 та ФНП-α. Вміст у крові високочутливого СРП визначали імунотурбідиметричним методом. Імуноферментний метод ELISA був застосований для визначення концентрації ІЛ-6 та ФНП-α.
Статистичну обробку результатів дослідження проводили за допомогою програми SPSS, версія 13. Усі зміни, що підлягали аналізу, підпорядковувалися нормальному розподіленню за результатом тесту Колмогорова — Смірнова для однієї вибірки. При порівняльному аналізі використовували t-критерій Стьюдента і дисперсійний аналіз ANOVA, при кореляційному — парний метод Пірсона. Усі значення наведено у вигляді M ± m, де М — середнє арифметичне значення показника, m — стандартна помилка середньої величини. Різниця між сукупностями порівнюваних даних вважалася достовірною при р < 0,05.
Результати та їх обговорення
За даними вимірювання офісного АТ у групах монотерапії було зареєстровано зіставний антигіпертензивний ефект телмісартану та S-амлодипіну — рівень систолічного артеріального тиску (САТ) знизився відповідно на 11 та 11,7 %, діастолічного — відповідно на 11,6 та 12,4 % (p < 0,001 для всіх показників). Більш вираженим було зниження АТ у групі комбінованої терапії, що становило для САТ 15,5 %, а для ДАТ — 14,9 % (p < 0,001 для обох показників) (табл. 1). Застосовуючи монотерапію, цільового рівня АТ (< 140/90 мм рт.ст.) вдалося досягти в 56,7 % хворих, які отримували телмісартан, та в 54,6 % пацієнтів, які лікувалися S-амлодипіном. Ліпший контроль АТ забезпечувала комбінована терапія — відсоток пацієнтів, у яких вдалося досягти та утримувати АТ < 140/90 мм рт.ст., дорівнював 69,8 %. Слід зазначити, що достовірної різниці між вихідними показниками АТ, як офісними, так і амбулаторними, за результатами однобічного тесту ANOVA знайдено не було (табл. 1).
Зіставне зниження АТ на тлі монотерапії було зафіксоване й за даними ДМАТ. Зниження середньодобового САТ становило 10,7 %, середньодобового ДАТ — 11,2 % у групі телмісартану та 12,9 і 14 % відповідно в групі S-амлодипіну (p < 0,001 для всіх показників). Комбіноване лікування сприяло зниженню САТ у середньому за добу на 15,4 %, ДАТ — на 15,1 % (p < 0,001 для обох показників). У всіх 3 групах зниження середньодобового АТ відбулося за рахунок впливу на рівень АТ як у денний, так і в нічний період. Проте більший ефект щодо рівня САТ усі три препарати проявили в денний період: середньоденний САТ знизився на 11,9, 13,9 і 16 % (p < 0,001 для всіх показників), тоді як середньонічний — на 10,7, 11,9 і 12,7 % (p < 0,001 для всіх показників) відповідно в 1, 2 і 3-й групах терапії.
Зниження ДАТ було рівнозначним у денний та нічний період: у середньому за день на 9,8, 12,1 і 13,3 % (p < 0,001 для всіх показників), у середньому за ніч — на 9,4, 12,7 і 12,8 % (p < 0,001 для всіх показників) відповідно в 1, 2 і 3-й групах.
Як монотерапія, так і комбінація не чинили суттєвого впливу на показник добового індексу САТ. У групі пацієнтів, які отримували телмісартан, на початку лікування порушення добового ритму АТ спостерігалися в 44,8 % випадків (у всіх випадках за типом non-dipper), у групі лікування S-амлодипіном — у 44,4 % (з яких у 10 пацієнтів за типом non-dipper та в 2 — over-dipper), у групі комбінації валсартану з амлодипіном — у 48,8 % (поміж них 16 — non-dipper, 1 — night-peaker та 4 — over-dipper). Під впливом телмісартану кількість хворих із нормальним добовим профілем АТ збільшилася на 4 пацієнти, проте це не вплинуло на середнє значення добового індексу САТ. Лікування S-амлодипіном сприяло поліпшенню циркадного ритму САТ як за рахунок трансформації типу over-dipper у 3 пацієнтів, так і non-dipper у 4 осіб у тип dipper. Подібна тенденція спостерігалась і в групі комбінованої терапії, де кількість пацієнтів із надмірним зниженням АТ уночі зменшилася з 4 до 1 особи та зросла кількість хворих із нормальним добовим ритмом АТ із 19 до 26 осіб. Таким чином, комбіноване лікування з використанням фіксованої комбінації валсартану та амлодипіну найбільшою мірою сприяло відновленню нормального двофазного циркадного ритму АТ.
Під впливом терапії у всіх трьох групах втручання відбулося достовірне зменшення варіабельності САТ і ДАТ у денний та нічний періоди, про що свідчить також зниження ранкового приросту як діастолічного, так і систолічного АТ (табл. 1).
/69-1.jpg)
Аналіз динаміки маркерів та медіаторів системного запалення показав, що телмісартан, S-амлодипін та комбінація валсартану з амлодипіном загалом сприяли зменшенню проявів запального процесу низької градації. Вміст у крові прозапального цитокіну ІЛ-6 достовірно зменшився в усіх трьох групах: під впливом телмісартану на 36,4 % (з 4,4 ± 0,7 до 2,8 ± 0,4 пг/л; р = 0,02), S-амлодипіну — на 39 % (з 4,1 ± 0,5 до 2,5 ± 0,3 пг/л; р < 0,001) і комбінації валсартану з амлодипіном — на 31,5 % (з 3,8 ± 0,6 до 2,6 ± 0,3 пг/л; р = 0,03). Проте тільки на тлі S-амлодипіну відбулося зниження рівня ФНП-α з 0,67 ± 0,07 до 0,59 ± 0,04 пг/л, яке становило 11,9 %, що, мабуть, зумовлене найвищим поміж групами порівняння середнім показником ФНП-α у групі S-амлодипіну — 0,67 ± 0,07 пг/л проти 0,56 ± 0,01 пг/л у групі телмісартану та 0,61 ± 0,05 пг/л у групі комбінованої терапії, хоча різниця в обох випадках не досягла межі достовірності (p > 0,05). Проте телмісартан і комбінація валсартану з амлодипіном сприяли зниженню рівня СРП відповідно на 13,9 % (з 3,6 ± 0,3 до 3,1 ± ± 0,2 мг/л; р = 0,04) та 12,5 % (з 4,0 ± ± 0,2 до 3,5 ± 0,24 мг/л; р = 0,03), тоді як під впливом S-амлодипіну спостерігалася тільки тенденція до його регресу — 11,2 % (з 3,7 ± 0,3 до 3,3 ± 0,2 мг/л; р = 0,07).
Загалом на тлі антигіпертензивної терапії відбулося зменшення активності системного запалення низької градації, що проявлялось у достовірному зниженні рівня СРП із 3,9 ± 0,1 до 3,3 ± 0,1 мг/л (р < 0,001) та прозапальних цитокінів: ІЛ-6 із 3,9 ± 0,3 до 2,6 ± 0,2 пг/л (р < 0,001) та ФНП-α із 0,62 ± 0,10 до 0,57 ± ± 0,10 пг/л (р < 0,001).
За результатами нашого дослідження були виявлені деякі особливості дії антигіпертензивних препаратів різних класів на прозапальні показники. Як було продемонстровано в попередніх клінічних роботах, в яких вивчали БРА [13–15], представник цієї групи телмісартан знижував сироватковий рівень СРП та ІЛ-6, проте не чинив впливу на ФНП-α. Монотерапія антагоністом кальцію S-амлодипіном сприяла зменшенню вмісту в крові прозапальних цитокінів ІЛ-6 та ФНП-α, проте, як і в дослідженнях [17, 18], достовірно не знижувала рівень СРП. У групі хворих, які отримували фіксовану комбінацію валсартану з амлодипіном, більш виражений антигіпертензивний ефект не супроводжувався більш вираженим, ніж у групах монотерапії, зниженням СРП і ІЛ-6.
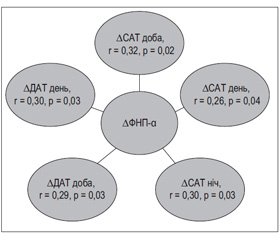
Результати кореляційного аналізу вказують на наявність прямого зв’язку між динамікою амбулаторного АТ та показниками запалення низької градації. Зменшення вмісту в крові ФНП-α асоціювалося зі зниженням середньодобового, середньоденного систолічного та діастолічного АТ та середньонічного САТ (рис. 1).
До того ж динаміка СРП корелювала тільки зі змінами показників САТ — середньодобового (r = 0,36; p = 0,001) та середньоденного (r = 0,37; p = 0,001), а також зі зростанням добового індексу САТ (r = 0,31; p = 0,03) і зменшенням нічної варіабельності САТ (r = 0,29; p = 0,03). Асоціації між ІЛ-6 та показниками ДМАТ під впливом терапії встановлено не було.
В експериментальних дослідженнях показано, що ІЛ-6 і ФНП-α, окрім їх безпосередньої медіаторної прозапальної функції, можуть сприяти структурним та функціональним змінам ендотелію судин. Навіть невеликий їх надлишок стимулює продукцію ендотеліоцитами потужного вазоконстриктору ендотеліну, зменшує ацетилхолінзалежну вазодилатацію та дестабілізує мікро-РНК ендотеліальної NO-синтази, що сукупно може сприяти підвищенню АТ [20, 21]. З іншого боку, показано, що блокада ІЛ-6 або ФНП-α в експериментальних тварин стає на заваді розвитку ангіотензин-ІІ-індукованої гіпертензії, що також вказує на прогіпертензивну дію цих цитокінів [22, 23].
У нашій роботі продемонстровано зворотну асоціацію — зниження АТ було прямо пов’язано зі зменшенням активності системного запалення, що оцінювали за динамікою СРП, ІЛ-6 і ФНП-α. Так, зменшення сироваткового вмісту ФНП-α корелює зі зниженням систолічного та діастолічного АТ у всі періоди доби під впливом лікування, а зниження рівня СРП асоціюється зі змінами середньодобового та середньоденного САТ та його добового індексу. Проте ми не маємо змоги оцінити первинну складову цієї асоціації. З одного боку, зниження тиску per se з наступним поліпшенням ендотеліальної функції сприяє зменшенню запального процесу в судинній стінці, з іншого — препарати, що проявляють протизапальні властивості, можуть чинити додатковий вплив на рівень АТ [10].
Отримані нами дані засвідчують зменшення активності запалення низької градації під впливом БРА (телмісартан) та антагоністів кальцію (S-амлодипін) як при монотерапії, так і при використанні їх комбінації (валсартан з амлодипіном), яке прямо корелює зі зниженням АТ за даними амбулаторних вимірювань. З урахуванням того факту, що приблизно 50 % пацієнтів із АГ характеризуються наявністю запального процесу низької градації [2], використання препаратів із наявними властивостями зменшення його активності може надавати їм додаткові переваги не тільки в контролі АТ, а й у вторинній профілактиці АГ.
Список литературы
1. Cachofeiro V., Miana M., Heras N. et al. Inflammation: a link between hypertension and atherosclerosis // Curr. Hypertens. Rev. — 2009. — Vol. 5. — P. 40-8.
2. Міщенко Л.А. Роль нетрадиційних чинників серцево-судинного ризику в патогенезі гіпертонічної хвороби // Український кардіологічний журнал. — 2012. — № 3. — С. 15-21.
3. Osman R., L’Allier P.L., Elgharib N. et al. Critical appraisal of C-reactive protein throughout the spectrum of cardiovascular di–sease // Vasc. Health Risk. Manag. — 2006. — Vol. 2(3). — P. 221-37.
4. Patel P., Dokainish H., Tsai P., Lakkis N. Update on the association of inflammation and atrial fibrillation // J. Cardiovasc. Electrophysiol. — 2010. — Vol. 21. — P. 1064-70.
5. Niskanen L., Laaksonen D.E., Nyssonen K. et al. Inflammation, abdominal obesity and smoking as predictors of hypertension // Hypertension. — 2004. — Vol. 44. — P. 859-865.
6. Hage F.G. C reactive protein and hypertension // J. Hum. Hypertens. — 2014. — Vol. 28. — P. 410-5.
7. Міщенко Л.А., Свіщенко Є.П., Яринкіна О.А. Предиктори прогресування ураження сонних артерій у хворих на гіпертонічну хворобу // Серце і судини. — 2013. — № 1. — С. 47-53.
8. Міщенко Л.А. Предиктори прогресування гіпертрофії лівого шлуночка у хворих на гіпертонічну хворобу // Український кардіологічний журнал. — 2012. — № 6. — С. 110-116
9. Sander K., Horn C.S., Briesenick C. et al. High-sensitivity C-reactive protein is independently associated with early carotid artery progression in women but not in men / The INVADE study // Stroke. — 2007. — Vol. 38. — P. 2881-2886.
10. Sanz-Rosa D., Oubina M.P., Cideil E. et al. Effect of AT1 receptor antagonism on vascular and circulating inflammatory mediators in SHR: role of NF κB/ I κB system // Am. J. Physiol. Heart Circ. Phisiol. — 2005. — Vol. 288. — Р. 111-115.
11. Ceconi C., Fox K.M., Remme W.J. ACE inhibition with perindopril and biomarkers of atherosclerosis and thrombosis: results from the PERTINENT study // Atherosclerosis. — 2009. — Vol. 204(1). — P. 273-275.
12. Mitrovic V., Klein H.H., Krekel N. et al. Influence of the –angiotensin converting enzyme inhibitor ramipril on high sensitivity C-reactive protein (hs-CRP) in patients with documented atherosclerosis // Z. Kardiol. — 2005. — Vol. 94. — P. 336-342.
13. Derosa G., Maffioli P., Salvadeo S.A. et al. Candesartan effect on inflammation in hypertension // Hypertens. Res. — 2010. — Vol. 33. — P. 209-213.
14. Fliser D., Buchholz K., Haller H. et al. European Trial on Olmesartan and Pravastatin in Inflammation and Atherosclerosis (EUTOPIA) investigators. Antiinflammatory effects of angiotensin II subtype I receptor blockade in hypertensive patients with microinflammation // Circulation. — 2004. — Vol. 110. — P. 1103-1107.
15. Manabe S. Effects of angiotensin II receptor blockade with valsartan on pro-inflammatory cytokines in patients with essential hypertension // J. Cardivsc. Pharmacol. — 2005. — Vol. 46. — P. 735-739.
16. Shurtz-Swirski R., Farah R., Sela S. The effect of calcium channel blocker lercanidipine on lowgrade inflammation para–meters in essential hypertension patients // Harefuah. — 2006. — Vol. 45(12). — P. 895-899.
17. Farah R., Shurtz-Swirski R. The combined effect of calcium channel blocker Lercanidipine and antioxidants on low-grade systemic inflammation parameters in essential hypertensive patients // Minerva Cardioangiol. — 2008. — Vol. 56. — P. 467-476.
18. Yasunari K., Maeda K., Watanabe T. et al. Comparative effects of valsartan versus amlodipine on left ventricular mass and reactive oxygen species formation by monocytes in hypertensive patients with left ventricular hypertrophy // J. Am. Col. Cardiol. — 2004. — Vol. 43. — P. 2116-2123.
19. Ridker P.M., Danielson E., Rifai N. et al. Valsartan, blood pressure reduction, and C-reactive protein: primary report of the –Val-MARC trial // Hypertens. — 2006. — Vol. 48. — P. 73-79.
20. Ruilope L.M., Malacco E., Khder Y. et al. Efficacy and tole–rability of combination therapy with valsartan plus hydrochlorothiazide compared with amlodipine monotherapy in hypertensive patients with other cardiovascular risk factors: the VAST study // Clin. Ther. — 2005. — Vol. 27(5). — P. 578-587.
21. Giardina J.B., Green G.M., Cockrell K.L. et al. TNF enhances contraction and inhibits endothelial NO-cGMP relaxation in systemic vessels of pregnant rats // Am. J. Physio. Regul. Integr. Comp.Physiol. — 2002. — Vol. 283. — P. 130-143.
22. LaMarca B.B., Cockrell K., Sullivan E. et al. Role of endothelin in mediating tumor necrosis factor-induced hypertension in pregnant rats // Hypertension. — 2005. — Vol. 46. — P. 82-86.
23. Sriramula S., Haque M., Majid D.S. et al. Involvement of tumor necrosis factor-alpha in angiotensin II-mediated effects on salt appetite, hypertension, and cardiac hypertrophy // Hypertension. — 2008. — Vol. 51. — P. 1345-1351.
24. Brands M.W., Banes-Berceli A.K., Inscho E.W. et al. Interleukin 6 knockout prevents angiotensin II hypertension: role of renal vasoconstriction and Janus kinase 2/signal transducer and activator of transcription 3 activation // Hypertension. — 2010. — Vol. 56. — P. 879-884.

/69-1.jpg)
/70-1.jpg)