Журнал «» 3 (41) 2015
Вернуться к номеру
Оцінка впливу моно та комбінованої антигіпертензивної терапії дигідропіридиновими та недигідропіридиновими антагоністами кальцію на пружноеластичні властивості артерій та центральний артеріальний тиск у пацієнтів із м’якою та помірною артеріальною гіпертензією
Авторы: Сіренко Ю.М., Рековець О.Л. - ДУ «ННЦ «Інститут кардіології імені академіка М.Д. Стражеска» НАМН України», м. Київ
Рубрики: Кардиология
Разделы: Справочник специалиста
Версия для печати
Вступ. Нині широко обговорюється пошук новітніх методів зниження серцево-судинного ризику в популяції. У багатьох рандомізованих дослідженнях було доведено значення жорсткості артеріальної стінки в погіршенні прогнозу кардіологічних хворих. Тому, виходячи з таких міркувань, терапія, що сприяє покращенню еластичності артерій, можливо, має більшу ефективність у профілактиці основних кардіоваскулярних подій. Мета даного дослідження — порівняти ефективність різнодозової комбінації лерканідипіну та дилтіазему в пацієнтів із м’якою та помірною артеріальною гіпертензією за впливом на центральний артеріальний тиск (ЦАТ) та пружно-еластичні властивості артерій. Матеріали та методи. У дослідження були включені 123 пацієнти з м’якою та помірною артеріальною гіпертензією: середній рівень офісного систолічного (САТ)/діастолічного (ДАТ) АТ — 149,12/91,92 ± 1,42/0,93 мм рт.ст. Середній вік хворих становив 51,83 ± 0,86 року. Усіх пацієнтів було розділено на групи терапії. Першій групі пацієнтів (n = 20) призначався дилтіазем у дозі 240 мг на добу у два прийоми. Другій (n = 20) — лерканідипін 20 мг один раз на добу. Третій (n = 22) — нефіксована комбінація 20 мг лерканідипіну та 240 мг дилтіазему на добу. Четвертій (n = 20) — нефіксована комбінація 10 мг лерканідипіну та 240 мг дилтіазему на добу. П’ятій (n = 21) — нефіксована комбінація 10 мг лерканідипіну та 120 мг дилтіазему на добу. Шоста група пацієнтів (n = 20) отримувала нефіксовану комбінацію 20 мг лерканідипіну та 120 мг дилтіазему на добу.
Усім пацієнтам на початку та в кінці лікування проводили такі дослідження: вимірювання маси тіла та зросту, розрахунок індексу маси тіла. Діагноз надлишкової маси тіла або ожиріння встановлювали відповідно до критеріїв ВООЗ (1997). Проводили вимірювання офісного САТ, ДАТ і ЧСС, добове моніторування АТ, визначення швидкості поширення пульсової хвилі по артеріях еластичного та м’язового типів, центрального САТ, біохімічне дослідження крові, що включало визначення вмісту загального холестерину, тригліцеридів, холестерину ліпопротеїнів високої, низької, дуже низької щільності, індексу атерогенності. Термін лікування становив 1 місяць. Результати. Після аналізу всіх даних було встановлено, що показники офісних САТ і ДАТ значно знизилися у хворих як із м’якою, так і з помірною гіпертензією у всіх групах практично однаково. ЦАТ у всіх групах лікування знизився ефективно та однаково. У групі дилтіазему 240 мг ЦАТ достовірно знизився на 10,95 мм рт.ст., у групі лерканідипіну 20 мг — на 12,18 мм рт.ст.,
у групі комбінації лерканідипіну 20 мг та дилтіазему 240 мг — на 14,13 мм рт.ст., у групі комбінації лерканідипіну 10 мг та дилтіазему 240 мг — на 11,93 мм рт.ст., у групі комбінації лерканідипіну 10 мг та дилтіазему 120 мг — на 13,11 мм рт.ст., у групі комбінації лерканідипіну 20 мг та дилтіазему 120 мг — на 14,82 мм рт.ст. Тобто всі вибрані схеми лікування були однаково ефективними в плані зниження центрального АТ. Не спостерігалося негативного впливу всіх схем лікування на рівень ліпідного спектра крові. Центральний САТ пов’язаний із рівнем ДАТ при добовому моніторуванні та з показниками, що характеризують пружно-еластичні властивості артерій, рівнем холестерину, товщиною комплексу інтима-медіа сонних артерій. У різних групах лікування спостерігалися різні фактори, що достовірно корелювали із кінцевим ЦАТ та ступенем його зниження. У групі комбінованої терапії кінцевий ЦАТ був пов’язаний із рівнем кінцевих офісного САТ, офісного ДАТ, показниками, що характеризують пружно-еластичні властивості артерій. У групі монотерапії кінцевий ЦАТ був достовірно обернено пов’язаний із ступенем зниження на фоні лікування офісної ЧСС і рівнем офісного САТ у кінці лікування. Ступінь зниження ЦАТ у групі комбінованої терапії достовірно був пов’язаний із показниками пружно-еластичних властивостей артерій, а також із товщиною комплексу інтима-медіа сонних артерій і рівнем загального холестерину. Усі схеми лікування достовірно не впливали на середні величини показників, що характеризують пружно-еластичні властивості артерій (у зв’язку з коротким терміном спостереження). Висновок. Як монотерапія, так і комбінація лерканідипіну та дилтіазему були ефективними в плані зниження як офісного АТ, так і АТ при добовому моніторуванні та центрального АТ. У зв’язку з найкращою переносимістю лерканідипіну 20 мг на добу та низькодозової комбінації лерканідипіну 10 мг та дилтіазему 120 мг ці стратегії лікування можна рекомендувати для подальшого лікування пацієнтів з артеріальною гіпертензією м’якого та помірного ступеня.
Введение. В настоящее время широко обсуждается поиск новых методов снижения сердечнососудистого риска в популяции. Во многих рандомизированных исследованиях было доказано значение жесткости артериальной стенки в ухудшении прогноза кардиологических больных. Поэтому, исходя из этого, терапия, способствующая улучшению эластичности артерий, возможно, имеет большую эффективность в профилактике основных кардиоваскулярных событий. Цель данного исследования — сравнить эффективность разнодозовой комбинации лерканидипина и дилтиазема у пациентов с мягкой и умеренной артериальной гипертензией по воздействию на центральное артериальное давление (ЦАД) и упругоэластичные свойства артерий. Материалы и методы. В исследование были включены 123 пациента с мягкой и умеренной артериальной гипертензией: средний уровень офисного систолического (САД)/диастолического (ДАД) АД — 149,12/91,92 ± 1,42/0,93 мм рт.ст. Средний возраст больных составил 51,83 ± 0,86 года. Все пациенты были разделены на группы терапии. Первой группе пациентов (n = 20) назначался дилтиазем в дозе 240 мг в сутки в два приема. Второй (n = 20) — лерканидипин 20 мг один раз в сутки. Третьей (n = 22) — нефиксированная комбинация 20 мг лерканидипина и 240 мг дилтиазема в сутки. Четвертой (n = 20) — нефиксированная комбинация 10 мг лерканидипина и 240 мг дилтиазема в сутки. Пятой (n = 21) — нефиксированная комбинация 10 мг лерканидипина и 120 мг дилтиазема в сутки. Шестая группа пациентов (n = 20) получала нефиксированную комбинацию 20 мг лерканидипина и 120 мг дилтиазема в сутки.
Всем пациентам в начале и конце лечения проводили следующие исследования: измерение массы тела и роста, расчет индекса массы тела. Диагноз избыточной массы тела или ожирения устанавливали в соответствии с критериями ВОЗ (1997). Проводили измерения офисного САД, ДАД и ЧСС, суточное мониторирование АД, определение скорости распространения пульсовой волны по артериям эластичного и мышечного типов, центрального САД, биохимическое исследование крови, включавшее определение содержания общего холестерина, триглицеридов, холестерина липопротеинов высокой, низкой, очень низкой плотности, индекса атерогенности. Срок лечения составил 1 месяц. Результаты. После анализа всех данных было установлено, что показатели офисных САД и ДАД значительно снизились у больных как с мягкой, так и с умеренной гипертензией во всех группах практически одинаково. ЦАД во всех группах лечения снизилось эффективно и одинаково. В группе дилтиазема 240 мг ЦАД достоверно снизилось на 10,95 мм рт.ст., в группе лерканидипина 20 мг — на 12,18 мм рт.ст., в группе комбинации лерканидипина 20 мг и дилтиазема 240 мг — на 14,13 мм рт.ст., в группе комбинации лерканидипина 10 мг и дилтиазема 240 мг — на 11,93 мм рт.ст., в группе комбинации лерканидипина 10 мг и дилтиазема 120 мг — на 13,11 мм рт.ст., в группе комбинации лерканидипина 20 мг и дилтиазема 120 мг — на 14,82 мм рт.ст. То есть все выбранные схемы лечения были одинаково эффективными в плане снижения центрального АД. Не наблюдалось негативного влияния всех схем лечения на уровень липидного спектра крови. Центральное САД связано с уровнем ДАД при суточном мониторировании и с показателями, характеризующими упругоэластичные свойства артерий, уровнем холестерина, толщиной комплекса интимамедиа сонных артерий. В различных группах лечения наблюдались различные факторы, которые достоверно коррелировали с конечным ЦАД и степенью его снижения. В группе комбинированной терапии конечное ЦАД было связано с уровнем конечных офисного САД, офисного ДАД, показателями, характеризующими упругоэластичные свойства артерий. В группе монотерапии конечное ЦАД было достоверно обратно связано со степенью снижения на фоне лечения офисной ЧСС и уровнем офисного САД в конце лечения. Степень снижения ЦАД в группе комбинированной терапии достоверно была связана с показателями упругоэластичных свойств артерий, а также с толщиной комплекса интимамедиа сонных артерий и уровнем общего холестерина. Все схемы лечения достоверно не влияли на средние величины показателей, характеризующих упругоэластичные свойства артерий (в связи с коротким сроком наблюдения). Вывод. Как монотерапия, так и комбинация лерканидипина и дилтиазема были эффективны в плане снижения как офисного АД, так и АД при суточном мониторировании и центрального АД. В связи с лучшей переносимостью лерканидипина 20 мг в сутки и низкодозовой комбинации лерканидипина 10 мг и дилтиазема 120 мг эти стратегии лечения можно рекомендовать для дальнейшего лечения пациентов с артериальной гипертензией мягкой и средней степени.
Introduction. Nowadays, the search for new methods to reduce cardiovascular risk in the population is widely discussed. Many randomized studies have proven the value of the arterial wall stiffness in worsening prognosis for cardiac patients. Therefore, based on these considerations, therapy that improves the elasticity of the arteries maybe have greater efficacy in preventing major cardiovascular events. Objective of this study — to compare the effectiveness of lerkanidipin and diltiazem combination in different doses among patients with mild to moderate hypertension based on the effect on central blood pressure (CBP) and viscoelastic properties of arteries. Materials and methods. The study involved 123 patients with mild to moderate hypertension, the average office systolic (SBP)/diastolic blood pressure (DBP) — 149.12/91.92 ± ± 1.42/0.93 mmHg. Average age of patients was 51.83 ± 0.86 years. All patients were divided into the groups of therapy. The first group of patients (n = 20) received diltiazem at a dose of 240 mg daily in two steps. The second one (n = 20) — lerkanidipin 20 mg once daily. The third one (n = 22) — nonfixed combination of lerkanidipin 20 mg and diltiazem 240 mg a day. The fourth one (n = 20) — nonfixed combination of lerkanidipin 10 mg and diltiazem240 mg daily. The fifth one (n = 21) — nonfixed combination of lerkanidipin 10 mg and diltiazem 120 mg a day. The sixth one (n = 20) — nonfixed combination of lerkanidipin 20 mg and diltiazem120 mg daily. All patients at the beginning and at end of treatment underwent the following studies: measurement of body weight and height, calculation of body mass index. The diagnosis of overweight or obesity was made according to the World Health Organization criteria (1997). Measurements of office SBP, DBP and heart rate (HR), ambulatory BP monitoring, determination of pulse wave velocity in elastic and muscle arteries, central SBP, biochemical blood assay which included determination of total cholesterol, triglycerides, high, low and very lowdensity lipoprotein cholesterol, atherogenic index were carried out. Duration of treatment was 1 month. Results. After analyzing all the data, it was found that parameters of office SBP and DBP decreased significantly in patients with both mild and moderate hypertension in all groups almost equally. CBP in all treatment groups decreased effectively and equally. In the group of 240 mg diltiazem, CBP significantly decreased by 10.95 mmHg, in group of lercanidipin 20 mg — by 12.18 mmHg, in the group of lercanidipin 20 mg and diltiazem 240 mg combination — by 14.13 mmHg, in the group of combination of lercanidipin 10 mg and diltiazem 240 mg — by 11.93 mmHg, in the group of lercanidipin 10 mg and diltiazem 120 mg combination — by 13.11 mmHg, in the group of combination of lercanidipin 20 mg and diltiazem 120 mg — by 14.82 mmHg. That is, all selected treatment regimens were equally effective in reducing CBP. There was no negative impact of all treatments on the level of blood lipids. Central SBP is associated with DBP level during daily monitoring and with the indicators of the viscoelastic properties of arteries, the level of cholesterol, intimamedia thickness of the carotid arteries. In different treatment groups we observed various factors that significantly correlated with the end CBP and the degree of its decline. In the combination therapy group, final CBP was associated with the level of end office SBP, office DBP, indicators of the viscoelastic properties of arteries. In the group of monotherapy, final central SBP was significantly inversely associated with the degree of reduction during the treatment of office HR and office SBP level at the end of treatment. The degree of СBP reduction in combination therapy group was significantly associated with indicators of viscoelastic properties of arteries, as well as with intimamedia thickness of the carotid arteries and the level of total cholesterol. All treatment regimens did not significantly affect the average values of indicators of the viscoelastic properties of the arteries (due to shortterm observation). Conclusion. Monotherapy and combination of lercanidipin and diltiazem were effective in reducing both office BP and BP with daily monitoring and CBP. In connection with the best tolerability of lercanidipin 20 mg daily and lowdose combination of lercanidipin10 mg and diltiazem 120 mg, these treatment strategies can be recommended for future treatment of patients with mild to moderate arterial hypertension.
артеріальна гіпертензія, лерканідипін, дилтіазем, центральний аортальний тиск, швидкість поширення пульсової хвилі.
артериальная гипертензия, лерканидипин, дилтиазем, центральное аортальное давление, скорость распространения пульсовой волны.
hypertension, lercanidipin, diltiazem, central aortic pressure, pulse wave velocity.
Статья опубликована на с. 78-91
Вступ
Важливість вивчення пружно–еластичних властивостей артерій була показана в дослідженні SHEP (Systolic Hypertension in the Elderly Program) 1991 р., в якому було виявлено позитивний зв’язок між підвищеним рівнем систолічного артеріального тиску (САТ) та збільшенням ризику виникнення несприятливих серцево–судинних подій, навіть якщо діастолічний артеріальний тиск (ДАТ) був нормальним або зниженим. До того ж зниження САТ під впливом антигіпертензивної терапії приводило до зменшення смертності від всіх серцево–судинних подій, включаючи фатальний інсульт та інфаркт міокарда [15]. Незважаючи на велику кількість методів дослідження пружно–еластичних властивостей артерій, тільки прямі методи, засновані на визначенні швидкості поширення пульсової хвилі (ШППХ), мають достатню точність, відтворюваність, не потребують складних діагностичних процедур та математичних розрахунків та можуть бути використані для обстеження великої кількості хворих. Визначення ШППХ для визначення жорсткості артерій як ураження органа–мішені у хворих з ізольованою систолічною гіпертензією похилого віку було включено в перелік методів дослідження для виявлення субклінічних уражень органів–мішеней в Рекомендаціях ЄТГ/ЄТК 2007 року [3]. У вищезгаданих рекомендаціях говориться, що визначення ШППХ дозволяє виконати повну неінвазивну оцінку жорсткості артерій, що є точною та простою у виконанні технікою. Також було зазначено, що результати цього дослідження можуть мати значення для прогнозу загальної смертності, серцево–судинної захворюваності, коронарних подій та інсультів у хворих на гіпертонічну хворобу (ГХ) без ускладнень. Установлено, що значення ШППХ більше ніж 12 м/с вважається надійним критерієм ураження судин у хворих на ГХ середнього віку.
Найбільшими прогностичними факторами конт–ролю за ефективністю антигіпертензивної терапії на сьогодні вважаються показники центрального пульсового АТ (цПАТ) і цСАТ. Як показали клінічні дослі–дження, саме цСАТ та цПАТ більшою мірою визначають прогноз, ніж АТ, виміряний на плечовій артерії [26–28, 35, 36]. Так, у дослідженні CAFЕ (Conduit Artery Function Evaluation) рівень цПАТ незалежно від інших факторів ризику асоціювався з гіршим перебігом хвороби [4]. Аналіз відмінностей між групами, у яких виникли серцево–судинні ускладнення або ж не виникли, у дослідженні SHS (Strong Heart Study) продемонстрував, що цПАТ > 50 мм рт.ст., але не ПАТ, виміряний на плечовій артерії, був незалежним предиктором виникнення кардіоваскулярних подій [18]. Супутні захворювання (ішемічна хвороба серця (ІХС), цукровий діабет, синдром обструктивного апное) та стани (дисліпідемія, куріння) супроводжуються збільшеним центральним АТ. Окрім судинних ускладнень, цПАТ і цСАТ асоціюються з ураженням органів–мішеней (гіпертрофія лівого шлуночка, товщина комплексу інтима–медія, діастолічна дисфункція лівого шлуночка, збільшення розміру лівого передсердя) та прогресуванням атеросклерозу.
Таким чином, вивчення впливу різнодозової комбінації дигідропіридинових і недигідропіридинових антагоністів кальцію лерканідипіну та дилтіазему на центральний АТ та пружно–еластичні властивості артерій є перспективним напрямком дослідження, що дозволить розробити підходити до вибору лікування АГ та максимально урахувати індивідуальний ризик пацієнта.
Матеріали
У дослідження були включені 123 пацієнти з м’якою та помірною АГ: середній рівень офісного САТ/ДАТ — 149,12/91,92 ± 1,42/0,93 мм рт.ст. Середній вік хворих становив 51,83 ± 0,86 року. Критеріями включення в дослідження були:
— чоловіки та жінки віком від 18 до 75 років;
— м’яка та помірна есенціальна артеріальна гіпертензія згідно з класифікацією ВООЗ, 1999 (Міжнародного товариства з вивчення артеріальної гіпертензії та Українського товариства кардіологів), за умови, що в кінці семиденного періоду відміни всіх антигіпертензивних препаратів середні значення артеріального тиску, виміряного в першій половині дня в положенні сидячи, такі: офісний систолічний артеріальний тиск (САТ >140 мм рт.ст., але < 180 мм рт.ст.), ДАТ > 90 мм
рт.ст., але < 110 мм рт.ст.);
— відсутність критеріїв виключення.
Критеріями виключення були: ангіоневротичний набряк в анамнезі, гіперкаліємія (> 5,5 ммоль/л) або гіпокаліємія (< 3,5 ммоль/л), гостра серцева недостатність, порушення серцевого ритму (хронічна фібриляція передсердь, часта екстрасистолічна аритмія, шлуночкові або надшлуночкова тахікардія, тахікардія (ЧСС більше ніж 100 уд за 1 хв), порушення АВ–про–
відності, або синусова брадикардія, або синдром слабкості синусового вузла), наявність вад серця, вагітність або лактація, злоякісний перебіг артеріальної гіпертензії, вторинна артеріальна гіпертензія, виражена артеріальна гіпотонія (САТ нижче за 90 мм рт.ст.), бронхіальна астма, декомпенсовані захворювання печінки (рівні АСТ, АЛТ вищі від верхньої границі норми в 3 рази), гостра або хронічна ниркова недостатність (рівень креатиніну сироватки крові > 133 мкмоль/л), серцева недостатність II і вище функціонального класу (згідно з Нью–Йоркською класифікацією), інфаркт міокарда в анамнезі строком менше ніж 6 місяців до моменту включення в дослідження, гостре порушення мозкового кровообігу в анамнезі, наявність стенокардії напруги ІІІ–IV функцонального класу або вазоспастичної стенокардії, інфекційні та онкологічні захворювання, стани, що супроводжуються ендогенною депресією (чи наявністю депресивних станів у сім’ї), цукровий діабет, ожиріння (ІМТ > 40 кг/м2), виражені захворювання периферичних судин, синдром Рейно, стан після хірургічного втручання (менше ніж один місяць), прийом стероїдних та нестероїдних протизапальних засобів, контрацептивів, значні психічні розлади, неможливість відмінити попередню антигіпертензивну терапію, участь в іншому дослідженні.
Після семиденного періоду відміни всіх медикаментозних засобів пацієнти проходили початкове обстеження та розподіл на групи методом сліпих конвертів, залежно від призначеної антигіпертензивної терапії. У кінці періоду відміни оцінювали повторно критерії включення в дослідження. Якщо пацієнт відповідав критеріям включення і не мав критеріїв виключення, то відбувалася рандомізація пацієнта за наведеною нижче схемою.
Перша група (n = 20): пацієнтам призначався дилтіазем (кардил виробництва компанії Orion, Фінляндія) у дозі 240 мг на добу у два прийоми.
Друга група (n = 20) — лерканідипін (леркамен виробництва компанії «Берлін–Хемі», Німеччина) у дозі 20 мг один раз на добу.
Третя група (n = 22) — нефіксована комбінація 20 мг лерканідипіну та 240 мг дилтіазему на добу (леркамен та кардил виробництва компаній «Берлін–Хемі», Німеччина, та Orion, Фінляндія).
Четверта група (n = 20) — нефіксована комбінація 10 мг лерканідипіну та 240 мг дилтіазему на добу (леркамен та кардил виробництва компаній «Берлін–Хемі», Німеччина, та Orion, Фінляндія).
П’ята група (n = 21) — нефіксована комбінація 10 мг лерканідипіну та 120 мг дилтіазему на добу (леркамен та кардил виробництва компаній «Берлін–Хемі», Німеччина, та Orion, Фінляндія).
Шоста група (n = 20) — нефіксована комбінація 20 мг лерканідипіну та 120 мг дилтіазему на добу (леркамен та кардил виробництва компаній «Берлін–Хемі», Німеччина, та Orion, Фінляндія).
Перший прийом ліків відбувався в офісі лікаря–дослідника. Оцінку антигіпертензивної ефективності проводили через місяць лікування. Курс лікування становив 1 місяць.
Із дослідження було виключено 21 пацієнта (17,07 %) у зв’язку з розвитком побічних реакцій. У групі монотерапії дилтіаземом була відміна у 2 пацієнтів (1,63 %) у зв’язку з розвитком головного болю. У групі монотерапії лерканідипіном була відміна в 3 пацієнтів (2,44 %): у 2 із них виникли серцебиття та почервоніння обличчя, в 1 — набряк нижніх кінцівок. У групі комбінації 20 мг лерканідипіну та 240 мг дилтіазему відміна спостерігалася в 6 пацієнтів (4,88 %): у 3 із них виникли головний біль та почервоніння обличчя, у 2 — набряки нижніх кінцівок, в 1 — свербіж шкіри. У групі комбінації 10 мг лерканідипіну та 240 мг дилтіазему відміна була в 5 пацієнтів (4,06 %): у 3 із них виникли головний біль та почервоніння обличчя, у 2 — набряки нижніх кінцівок і свербіж шкіри. У групі комбінації 10 мг лерканідипіну та 120 мг дилтіазему відміна спостерігалася у 2 пацієнтів (1,63 %): в обох пацієнтів виник головний біль. У групі комбінації 20 мг лерканідипіну та 120 мг дилтіазему відміна відмічалася в 3 пацієнтів (2,44 %): у них виникли головний біль, серцебиття та почервоніння обличчя.
Методи дослідження
Усім пацієнтам на початку та в кінці лікування проводили такі дослідження: вимірювання маси тіла та росту, розрахунок індексу маси тіла. Діагноз надлишкової маси тіла або ожиріння встановлювали відповідно до критеріїв ВООЗ (1997). Проводили вимірювання офісного САТ, ДАТ та ЧСС, добове моніторування АТ (ДМАТ), визначення швидкості поширення пульсової хвилі по артеріях еластичного (ШППХе) та м’язового (ШППХм) типів, цСАТ, проводили біохімічне дослідження крові, що включало визначення вмісту загального холестерину (ХС), тригліцеридів (ТГ), холестерину ліпопротеїнів високої (ХС ЛПВЩ), низької (ХС ЛПНЩ), дуже низької щільності (ХС ЛПДНЩ), індексу атерогенності (ІА).
Вимірювання САТ та ДАТ проводили на початку дослідження та в кінці лікування.
ДМАТ проводили за допомогою апаратів АВРМ–04М
(фірма «Медітек», Угорщина). Моніторування проводили в такому режимі: у денний час — кожні 15 хвилин, уночі (з 22:00 до 6:00 годин) — кожні 30 хвилин. Хворі вели звичайний спосіб життя, виконуючи побутові фізичні та психоемоційні навантаження. До того ж вивчали такі показники: середньодобовий, денний, нічний САТ, середньодобовий, денний, нічний ДАТ,
ЧСС.
Біохімічні аналізи виконувалися на автоматичному фотометрі Livia (Сormay, Польща). Визначали рівні креатиніну, електролітів (калію та натрію), глюкози, загального ХС, ТГ, ХС ЛПВЩ, ХС ЛПНЩ, ХС ЛПДНЩ сироватки крові. Кліренс креатиніну, що відображає швидкість клубочкової фільтрації, визначали розрахунково за формулою Cockroft — Gault.
ШППХ та центральний АТ визначалися на апараті Sphygmocor–PVx (AtCor Medical Pty Ltd, Австралія), з’єднаного з персональним комп’ютером, що дозволяє проводити аналіз форми пульсової хвилі та ви–
значати ШППХе та ШППХм. П’єзодатчики встановлювали на загальній правій артерії, стегновій артерії та радіальній артерії правого передпліччя під візуальним (на моніторі) та автоматичним контролем якості, що здійснювався за відповідної програми приладу. Час запізнювання пульсової хвилі та швидкість її поширення, центральний АТ визначалися автоматично за допомогою програмного забезпечення приладу після введення величини відстані між датчиками, що вимірювалася сантиметровою смужкою. Для оцінки пружно–еластичних властивостей артерій еластичного типу ШППХ визначали на сегменті «сонна артерія — стегнова артерія», для оцінки пружно–еластичних властивостей артерій м’язового типу — на сегменті «сонна артерія — радіальна артерія». Окрім ШППХ, визначали також центральний АТ за допомогою програмного забезпечення приладу на основі артеріального тиску на плечовій артерії та формі отриманої пульсової хвилі у висхідній аорті (формула визначена виробником, та проведена стандартизація при інтрааортальному вимірюванні артеріального тиску).
За даними літератури, проведення аналізу пульсової хвилі в пацієнтів із різними факторами ризику виявило, що незалежно від рівня АТ індекс приросту (AIx) підвищується з віком, у пацієнтів із цукровим діабетом першого типу та з гіперхолестеринемією [15, 35, 36]. У багатьох клінічних проспективних дослі–
дженнях (ASCOT, SEARCH, FIELD та інших) вивчалося прогностичне значення АІх. Виявилося, що приріст величини індексу на 10 % супроводжується збільшенням ризику виникнення серцево–судинних подій в 1,28 раза, незалежно від інших факторів [12]. До того ж у пацієнтів із кінцевою стадією ниркової недостатності вплив індексу приросту на прогноз не залежав від величини ШППХ [35].
Усі перераховані вище клінічні, лабораторні та функціонально–діагностичні обстеження проводили на початку дослідження та в кінці періоду лікування.
Клінічну ефективність лікування оцінювали шляхом порівняння динаміки клініко–лабораторних і функціонально–діагностичних показників у хворих шести груп.
Статистичну обробку результатів виконували після створення баз даних у системах Microsoft Excel. Усі статистичні розрахунки проводили за допомогою програми SPSS 12.0. Достовірність різниці середніх значень між групами визначалася методом незалежного t–тесту для середніх. Порівняння динаміки показників на етапах лікування проводили за допомогою парного двовибіркового t–тесту для середніх значень. Кореляційний аналіз проводили після визначення характеру розподілу за Spearman.
Результати та їх обговорення
Усього було 102 пацієнти (59 чоловіків, 43 жінки), які пройшли повне первинне та повторне обстеження на фоні терапії. Середній вік хворих становив 52,37 ± ± 0,97 року, середня тривалість АГ — 5,49 ± 0,30 року, ІМТ — 29,14 ± 0,36 кг/м2, маса тіла — 85,86 ± 1,20 кг. Термін спостереження — 30 днів. Показники ліпідного обміну загалом по групі (n = 102): холестерин — 6,22 ± ± 0,12 ммоль/л, тригліцериди — 1,77 ± 0,13 ммоль/л, ХС ЛПВЩ — 1,24 ± 0,02 ммоль/л, ХС ЛПНЩ — 4,14 ± ± 0,10 ммоль/л, ХС ЛПДНЩ — 0,80 ± 0,06 ммоль/л, ІА — 4,15 ± 0,15 ум.од.
Вплив призначеного лікування на біохімічні показники наведено в табл. 1. Як видно з табл. 1, під впливом призначеної терапії у всіх групах достовірних змін більшості показників, що вивчалися, не відбулося.
Зміни ТГ крові в групі комбінації лерканідипіну 10 мг та дилтіазему 240 мг, можливо, пов’язані зі зміною раціону харчування пацієнтів даної групи.
Оцінка впливу моно– та комбінованої антигіпертензивної терапії на пружно–еластичні властивості артерій та центральний артеріальний тиск у досліджуваних хворих
Артеріальний тиск, виміряний на плечовій артерії за допомогою сфігмоманометра, є важливим предиктором виникнення кардіоваскулярних подій [2, 12–15]. Дані багатьох епідеміологічних і клінічних спостережень показали, що систолічний, діастолічний і пульсовий АТ змінюються протягом життя людини [1, 4, 16, 17, 19, 20, 22, 23, 35, 36]. ДАТ, що в основному визначається периферичним опором, збільшується до досягнення людиною середнього віку, а потім дещо знижується. САТ та ПАТ, що визначаються більшою мірою жорсткістю великих артерій, периферичним відбиванням пульсової хвилі та функцією лівого шлуночка, підвищуються з віком постійно. Зміни жорсткості великих артерій (аорти та її основних гілок) в основному й обумовлюють зміни САТ, ДАТ та ПАТ після 50 років. Хоча ДАТ традиційно знаходився у фокусі лікування артеріальної гіпертензії, в останні роки почали наголошувати, що саме САТ та ПАТ мають більше значення для визначення прогнозу в пацієнтів, а особливо в осіб похилого віку. Завдяки виникненню нових технологічних можливостей спостерігається підвищений інтерес дослідників до вивчення зв’язку між жорсткістю артерій і кардіоваскулярною захворюваністю. Це пов’язано з декількома причинами. По–перше, доведено, що САТ справляє більш сильний вплив, ніж ДАТ, на частоту виникнення ІХС в осіб віком понад 60 років [24, 25, 29–32, 34, 36]. По–друге, ПАТ має незалежне значення в прогнозі пацієнтів старшого віку та в пацієнтів із повторним інфарктом міокарда та серцевою недостатністю. Його зміни під впливом терапії також можуть мати клінічне значення. По–третє, частота виникнення ізольованої систолічної АГ збільшується з віком та є основним фактором ризику виникнення інсульту, ІХС та кардіоваскулярної смерті [20, 37, 38]. Формування ізольованої систолічної гіпертензії тісно пов’язано із зміною жорсткості артерій. По–четверте, численні спостереження показали, зниження як САТ, так і ДАТ забезпечує зменшення ризику розвитку серцево–судинних ускладнень. У той же час клінічна практика доводить, що адекватний контроль САТ може бути досягнутий набагато рідше, ніж ДАТ. По–п’яте, із віком спостерігається тенденція до зниження фракції викиду лівого шлуночка і жорсткість артерій стає основною детермінантою підвищення САТ і ПАТ.
Еластичність судин залежить від структури стінки та від тиску розтягування, що в основному визначається середнім АТ. Чим вищим є середній АТ, тим більше розтягнуті артерії і тим менша в них можливість розтягуватися ще більше під час серцевого викиду. Серцевий викид крові ініціює пульсову хвилю, що поширюється в напрямку на периферію. У місці, де опір найбільший, а це частіше в артеріолах, пульсова хвиля відбивається і починає рухатися в зворотному напрямку до серця, зустрічається з прямою хвилею. Сумація двох хвиль, прямої та зворотної, становить форму результуючої хвилі. Еластичність артерій, амплітуда і час серцевого викиду та умови відбивання пульсової хвилі (час поширення в прямому та зворотному напрямках, місце відбивання) обумовлюють форму результуючої пульсової хвилі. Чим більші час поширення пульсової хвилі та еластичність судин, тим пізніше пряма та зворотна хвиля зустрічаються.
У зв’язку з тим, що рівень САТ частково залежить від відбиття пульсової хвилі [33], він може бути різним у різних місцях артеріального дерева. Тому центральний (аортальний) САТ може відрізнятися від САТ, що був виміряний на плечовій артерії. Ця різниця може коливатися від 1 до 33 мм рт.ст. До того ж через сумацію (у літературі вона має назву «ампліфікація») у молодих та високих людей рівень периферичного САТ може бути вищим за норму, тоді як центральний САТ може бути нормальним. Це може призвести до гіпердіагностики артеріальної гіпертензії та вплинути на вибір професії або подальшу кар’єру цих молодих людей. У людей похилого віку, навпаки, ступінь зниження АТ на плечовій артерії під впливом терапії може не збігатися із зниженням центрального АТ. При однаковому досягнутому рівні АТ на плечовій артерії цСАТ може значно відрізнятися, що призводить до недооцінки кардіоваскулярного ризику при збереженні цСАТ високим.
Як показали клінічні дослідження, саме цСАТ і цПАТ більшою мірою визначають прогноз, ніж АТ, виміряний на плечовій артерії. Так, у дослідженні CAFЕ рівень цПАТ незалежно від інших факторів ризику асоціювався із гіршим перебігом захворювання [35]. Аналіз відмінностей між групами, у яких виникли серцево–судинні ускладнення або ж не виникли, у дослідженні продемонстрував, що цПАТ > 50 мм рт.ст., але не ПАТ, виміряний на плечовій артерії, був незалежним. Окрім судинних ускладнень, цПАТ і цСАТ визначають ураження інших органів–мішеней, а саме: гіпертрофію лівого шлуночка, товщину комплексу інтима–медія, діастолічну дисфункцію лівого шлуночка, збільшення розміру лівого передсердя та прогресування атеросклерозу. Супутні захворювання (ІХС, цукровий діабет, синдром обструктивного апное) та стани (дисліпідемія, куріння) супроводжуються збільшеним центральним АТ. Існують також расові відмінності: у чорних молодих людей центральний АТ вищий, ніж у білих, що може пояснювати деякі відмінності у частоті виникнення тих або інших серцево–судинних подій.
У декількох дослідженнях останнього десятиріччя було показано, що різні антигіпертензивні препарати при однаковому зниженні АТ на плечовій артерії мають різний вплив на частоту виникнення серцево–судинних ускладнень [4, 12, 20, 35, 36]. Одночасно висловлювалася думка, що переваги деяких препаратів пов’язані з їх артеріальний тиск–незалежними ефектами. Але з багатьох короткострокових досліджень відомо, що різні класи антигіпертензивних препаратів по–різному впливають на вигляд (морфологію) пульсової хвилі та, відповідно, на параметри центральної гемодинаміки при однаковому впливі на АТ на плечовій артерії. І саме недостатня кількість даних у широкомасштабних дослідженнях щодо впливу різних препаратів на центральний АТ й породила багато дискусій щодо унікальності деяких із них. Ці дискусії стали значно меншими після того, як завдяки застосуванню валідної неінвазивної методики оцінки центрального АТ з’явилися результати дослідження CAFЕ. Це дослідження було частиною великого дослідження ASCOT, і в ньому вперше продемонстровано, що різниця у впливі на прогноз двох режимів лікування (на основі атенололу та амлодипіну) була пов’язана із різним впливом на центральний АТ та морфологію пульсової хвилі. Окрім дослідження CAFЕ, з’явилися дані декількох інших рандомізованих спостережень, в яких продемонстровано переваги одних препаратів над іншими в зниженні саме цСАТ і цПАТ. Навіть більш детальний аналіз результатів дослідження LIFE показав, що між групами лікування існувала різниця в зниженні ПАТ на користь лозартану [11]. А при порівнянні раміприлу та атенололу в дослідженні К. Hirata виявилося, що раміприл на 5 мм рт.ст. більше знижував аортальний АТ, ніж атенолол, що ставить під сумніви висновок дослідження НОРЕ — існування позитивного впливу раміприлу, крім його властивостей знижувати АТ [6–8].
У дослідженні REASON [25] було показано, що вплив антигіпертензивної терапії на рівень САТ залежить від багатьох факторів, у тому числі і від пружно–еластичних властивостей артерій: ШППХ виявилася незалежним фактором. ШППХ в основному пов’язана із структурою стінок артерій та середнім АТ (тиск розтягування). При більшій швидкості поширення пульсова хвиля повертається з периферії до серця скоріше, у систолу, що обумовлює збільшення цСАТ та навантаження на серце. Тому зменшення ШППХ повинно асоціюватися із зменшенням цСАТ.
САТ і ДАТ є піком та впадиною («коритом») пульсової хвилі. Тиск приросту — це додатковий тиск, що виникає при поверненні відбитої пульсової хвилі в систолу. Індекс приросту — це співвідношення між тиском приросту та цПАТ. Дихротична виїмка представляє закриття клапанів аорти та використовується для розрахунку часу вигнання (ED). Час до відбиття пульсової хвилі розраховується від точки початку ви–
гнання до виникнення відбитої пульсової хвилі. Відбита пульсова хвиля призводить до додаткового збільшення пульсової хвилі в систолі.
ШППХ тісно пов’язана із такими факторами серцево–судинного ризику, як вік, паління, підвищений рівень холестерину, цукровий діабет, АГ та малорухливий спосіб життя [6–8, 11]. При АГ ШППХ є незалежним фактором ризику кардіоваскулярної та загальної смерті [20, 35]. Збільшення ШППХ по артеріях еластичного типу на 5 м/с відповідає зростанню ризику загальної смерті в 1,34 раза та серцево–судинної смерті в 1,51 раза. Проте слід зазначити, що зміна ШППХ на 5 м/с — це дуже значне коливання, адже відомо, що в здорових осіб віком від 24 до 62 років ШППХ у середньому коливається в межах від 6 до 10 м/с [6–8].
У гіпертензивних пацієнтів навіть без інших ознак кардіоваскулярних захворювань ШППХ виявилася предиктором розвитку несприятливих подій. Тобто є класичним фактором ризику, незалежним від інших. До того ж особливо поганим є прогноз у пацієнтів із величиною ШППX більше ніж 12 та 20 м/с [3]. У пацієнтів із цукровим діабетом при одному й тому ж рівні САТ кількість смертей була більшою серед осіб, у яких ШППХ була більшою за середню в популяції [6–8, 33, 36]. У хворих із нирковою недостатністю, як відомо, дуже високий ризик виникнення серцево–судинних подій та загальної смерті. Одночасно в дослідженні J. Blacher з співавт. [9, 10] виявилося, що зменшення ШППХ в обстежених хворих на 1 м/с під впливом терапії призводило до зменшення загальної смерті на 29 %.
Таким чином, вивчення впливу антигіпертензивної терапії на центральний АТ та пружно–еластичні властивості артерій є перспективним напрямком дослі–дження, що дозволить розробити підходи до вибору лікування АГ та максимально урахувати індивідуальний ризик пацієнта.
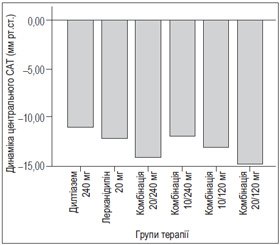
Динаміка параметрів, що вивчалися, наведена в табл. 2. Як видно із табл. 2, у всіх хворих, включених у дослідження, спостерігалося достовірне зниження лише ЦАТ, що в середньому становило 12,84 ± 1,38 мм рт.ст. (р < 0,01). Достовірної різниці між групами в зниженні центрального АТ не було (рис. 1). Незважаючи на зниження АТ за даними усіх методів вимірювання (офісне, добове, апланаційна тонометрія), ми не спостерігали в нашому дослідженні як у групах окремо, так і в загальній когорті пацієнтів, які лікувалися, ні достовірного зменшення ШППХ, ні змін індексу приросту Аіх (рис. 2). Це може бути пов’язане, по–перше, з невеликою кількістю пацієнтів у групах, по–друге, з коротким терміном лікування — 1 місяць. Більшість подібних досліджень включали хворих, у яких достовірні позитивні зміни ШППХ з’являлися лише на 3–6–му місяці лікування.
Таким чином, будь–яке ефективне, за даними вимірювання АТ на плечовій артерії, лікування АГ супроводжувалося достовірним зниженням ЦАТ.
Для визначення факторів, що пов’язані з ЦАТ та ступенем його зниження в загальній групі обстежених, нами проведено кореляційний аналіз за Spearman (табл. 3).
З табл. 3 видно, що на початку дослідження ЦАТ значною мірою достовірно корелював із рівнем ДСАТ до лікування, офісним САТ та офісним ДАТ до лікування та після лікування: чим вищими були показники офісного САТ та ДАТ, тим вищим був і ЦАТ. ЦАТ корелював із рівнем ШППХе та індексом приросту Аіх. ШППХе більшою мірою характеризує саме еластичні властивості стінки артерій та залежить від тиску розтягування. Тому, з одного боку, більш високий ЦАТ означає більш високий тиск розтягування та, відповідно, більшу ШППХе, з іншого — більш висока ШППХе означає більш швидке повернення пульсової хвилі та, відповідно, ранню сумацію прямої та відбитої хвилі та збільшення ЦАТ. Це підтверджується і тим, що ЦАТ прямо корелював з АIх. Також прямою та високодостовірною була кореляція ЦАТ із товщиною комплексу інтима–медіа сонних артерій.
ЦАТ у кінці дослідження корелював із показниками, що характеризують пружно–еластичні властивості артерій — із ШППХе на початку дослідження та з АIх у кінці дослідження.
Ступінь зниження ЦАТ (ЦАТ) достовірно обернено корелював із рівнем ДАТ 24 на початку дослідження: чим більшим був ДАТ 24 на початку, тим меншим було зниження ЦАТ. Товщина комплексу інтима–медіа сонних артерій, а також рівень холестерину та ХС ЛПНЩ до початку лікування достовірно та обернено корелювали із ЦАТ: чим більшим були ТІМ, ХС та ХС ЛПНЩ до початку лікування, тим менше знижувався ЦАТ на фоні лікування.
Ми також проаналізували, з чим були пов’язані зміни ЦАТ залежно від призначеного лікування. Ми поділили групи на монотерапію та на комбіновану терапію. Динаміка показників у групах наведена в табл. 4. Офісний АТ, АТ при добовому моніторуванні, ЦАТ однаково та достовірно зменшилися як у групі монотерапії, так і в групі комбінованої терапії. Варіабельность сердечного ритма, ЧСС достовірно не змінилися як в монотерапії, так і в комбінованій терапії. ΔЦАТ в монотерапії не виявив кореляційних зв’язків (табл. 5), тоді як у групі комбінованої терапії виявив прямий кореляційний зв’язок із ΔШППХе (r = 0,256, p = 0,038), тобто чим більшим було зниження ШППХе, тим більшим було зменшення ЦАТ у групі комбінованої терапії. Також прямий кореляційний зв’язок виявлено в ΔЦАТ із ΔАix (r = 0,363, p = 0,003), тобто чим більшим було зменшення Аix на фоні комбінованої терапії, тим більше знижувався ЦАТ. ΔЦАТ також обернено корелював із товщиною комплексу інтима–медіа сонних артерій зліва (r = –0,251, p = 0,041) та рівнем холестерину (r = –0,286, p = 0,019) на початку дослідження в групі комбінованої терапії. Чим більшою була ТІМ та вищим рівень ХС на початку дослідження, тим менше знижувався ЦАТ.
ЦАТ у групі монотерапії на початку лікування корелював з офісним САТ після, ШППХе до лікування, ТІМ справа і зліва. ЦАТ у групі комбінованої терапії на початку лікування прямо корелював з офісним САТ, офісним ДАТ до лікування, Аix до лікування, ШППХе до лікування та обернено із ШППХе: чим більш жорсткими були артерії за еластичним типом до початку лікування, тим вищим був ЦАТ до початку лікування в групі комбінованої терапії.
ЦАТ у кінці лікування в групі монотерапії корелював з офісним САТ після, офісним САТ та обернено — з офісною ЧСС. Чим більшим було зниження офісної ЧСС, тим менше знижувався ЦАТ у кінці лікування. Такі наші результати підтверджуються даними літератури про те, що зниження ЧСС негативно впливає на показники центрального АТ. Так, небіволол через меншу брадикардію в поєднанні з периферійною вазодилатацією краще впливав на ЦАТ, ніж атенолол [9]. У дослідженні SENIORS у хворих із серцевою недостатністю небіволол порівняно з плацебо показав переваги щодо впливу на первинні кінцеві точки, такі як зниження загальної смертності та випадків госпіталізації з приводу серцево–судинних подій [36]. ЦАТ у кінці лікування в групі комбінованої терапії корелював з офісним ДАТ до та після лікування, офісним САТ після лікування. Нами відмічено, що ЦАТ після лікування в групі комбінованої терапії мав більше кореляційних зв’язків із показниками пружно–еластичних властивостей артерій. Так, ЦАТ після корелював із ШППХе до, Аix до, Аix та обернено корелював з ED після лікування.
Як уже зазначалося, у дослідженні ASCOT також було показано, що лікування на основі амлодипіну забезпечувало однакове з атенололом зниження АТ на плечовій артерії, але достовірно менший рівень ЦАТ (на 4 мм рт.ст.) та цПАТ. У цьому дослідженні виявлено, що рівень ЦАТ на фоні лікування пов’язаний із ЧСС: чим меншою була ЧСС, тим більшим був ЦАТ. Це й стало одним із пояснень, чому бета–адреноблокатори менше знижують ЦАТ — адже вони більше зменшують ЧСС. При зменшенні ЧСС, згідно з дослідженням ASCOT, на 10 уд. ЦАТ знижувався на 3 мм рт.ст. та Аіх — на 2,5 % [12]. Причинами цього є три основні фактори. По–перше, зменшення ЧСС призводить до подовження систоли та відбита пульсова хвиля повертається в систолу із прямою хвилею і збільшує ЦАТ. По–друге, бета–блокатори можуть викликати периферичний опір, сприяючи більш ранньому поверненню пульсової хвилі. Окрім того, підвищення резистивності судин збільшує амплітуду пульсової хвилі. По–третє, згідно з законом Пуазеля, АТ = серцевий викид периферичний опір, де серцевий викид = ударний об’єм х ЧСС. Коли ЧСС знижується під випливом терапії, середній АТ підтримується за рахунок збільшення ударного об’єму. Цей феномен часто спостерігається в пацієнтів із повною атріовентрикулярною блокадою. У більш молодих пацієнтів з еластичними ємкісними судинами підвищення ударного об’єму не викликає суттєвого збільшення АТ, адже ємкісні судини здатні значно розтягуватися. У людей більш старшого віку та тих, хто страждає від АГ або атеросклерозу, зменшення ЧСС також призводить до збільшення ударного об’єму, але воно не компенсується розтягуванням ємкісних судин (через вікові та патологічні зміни у стінках), що призводить до збільшення ЦАТ та ПАТ. Іншими словами, можно зробити висновок, що будь–який препарат, що зменшує ЧСС, може бути менш ефективним щодо зниження центрального АТ. Проте є дані, що бета–блокатори з вазодилатуючими властивостями більш ефективні щодо зниження ЦАТ, ніж представники даної групи, але без таких властивостей. Окрім того, у дослідженні Y. Matsui зі співавторами під впливом лікування комбінацією олмезартан + азелнідипін спостерігалося більш виражене зниження ЦАТ при більшому зниженні ЧСС порівняно з комбінацією олмезартан + гідрохлортіазид [21]. Автори пояснювали це більш вираженим позитивним впливом першої комбінації на периферичний опір та ШППХ. Тобто, можливо, існують додаткові позитивні ефекти антигіпертензивних препаратів (вплив на еластичні властивості ємкісних судин та функції ендотелію, зменшення периферичного опору судин), що невілюють ефект зменшення ЧСС.
Таким чином, більш низька ЧСС на фоні лікування асоціювалася із вищим ЦАТ лише в групі монотерапії.
Ми проаналізували, що впливало на ступінь зниження АТ при добовому моніторуванні. Так, був виявлений достовірний кореляційний зв’язок ЧСС та ED із САТ 24. На ступінь зниження САТ 24 у групі дилтіазему впливав початковий рівень ED ( = –0,406, р = 0,037), а в групі лерканідипіну — початковий рівень ЧСС ( = 0,515, р = 0,005). У групі комбінованої терапії ступінь зниження САТ при добовому моніторуванні не залежав від ЧСС та ED. Тобто ефективність комбінованої терапії не залежить від ЧСС та ED.
Оцінка переносимості моно–та комбінованої терапії у хворих із м’якою та помірною артеріальною гіпертензією
Як було зазначено вище, із дослідження було виключено 21 пацієнта (17,07 %) у зв’язку з розвитком побічних реакцій. У групі монотерапії дилтіаземом була відміна у 2 пацієнтів (1,63 %) у зв’язку з розвитком головного болю. У групі монотерапії лерканідипіном була відміна у 3 пацієнтів (2,44 %): у 2 із них виникли серцебиття та почервоніння обличчя, в 1 — набряк нижніх кінцівок. У групі комбінації 20 мг лерканідипіну та 240 мг дилтіазему відміна спостерігалася в 6 пацієнтів (4,88 %): у 3 із них виникли головний біль і почервоніння обличчя, у 2 — набряки нижніх кінцівок, в 1 — свербіж шкіри. У групі комбінації 10 мг лерканідипіну та 240 мг дилтіазему відміна спостерігалась у 5 пацієнтів (4,06 %): у 3 із них виникли головний біль та почервоніння обличчя, у 2 — набряки нижніх кінцівок та свербіж шкіри. У групі комбінації 10 мг лерканідипіну та 120 мг дилтіазему відміна відмічалась у 2 пацієнтів (1,63 %): в обох пацієнтів виник головний біль. У групі комбінації 20 мг лерканідипіну та 120 мг дилтіазему відміна спостерігалась у 3 пацієнтів (2,44 %): у них виникли головний біль, серцебиття та почервоніння обличчя.
Після 1 місяця лікування частина пацієнтів була переведена на іншу антигіпертензивну терапію у зв’язку з не досить задовільною переносимістю терапії. Так, у групі дилтіазему 240 мг 3 пацієнти були переведені на прийом бісопрололу в дозі 10 мг на добу у зв’язку з головним болем, що не потребував відміни протягом першого місяця лікування, але не досить добре переносився пацієнтами. У групі лерканідипіну подальшої відміни препарату не було, пацієнти продовжили призначену терапію. У групі комбінації лерканідипіну 20 мг та дилтіазему 240 мг подальша відміна дилтіазему спостерігалася в 5 пацієнтів у зв’язку з незначним, але постійним головним болеем, і було рекомендовано приєднання бісопрололу в дозі 5–10 мг на добу. У групі лерканідипіну 10 мг та дилтіазему 240 мг подальша зміна терапії була в 3 пацієнтів: одному було замінено дилтіазем на бісопролол 10 мг, а інших двох переведено на прийом інгібітору АПФ периндоприл у дозі 8 мг на добу. У групі комбінації 10 мг лерканідипіну та 120 мг дилтіазему подальшої відміни не було. У групі 20 мг лерканідипіну та 120 мг дилтіазему подальша зміна терапії була в 3 хворих: пацієнти були переведені на прийом блокатора рецепторів до АТII валсартану у дозі 160 мг на добу у зв’язку з головним болем на прийом комбінації.
Таким чином, ми можемо зробити висновок, що як монотерапія, так і комбінація лерканідипіну та дилтіазему була ефективною в плані зниження як офісного АТ, так і АТ при добовому моніторуванні та центрального АТ. У зв’язку з найкращою переносимістю лерканідипіну 20 мг на добу та низькодозової комбінації лерканідипін 10 мг та дилтіазем 120 мг ці стратегії лікування можна рекомендувати для подальшого лікування пацієнтів з артеріальною гіпертензією м’якого та помірного ступеня.
Висновки
1. Центральний артеріальний тиск у всіх групах лікування знизився ефективно та однаково. У групі дилтіазему 240 мг ЦАТ достовірно знизився на 10,95 мм рт.ст., у групі лерканідипіну 20 мг — на 12,18 мм рт.ст., у групі комбінації лерканідипін 20 мг та дилтіазем 240 мг — на 14,13 мм рт.ст., у групі комбінації лерканідипін 10 мг та дилтіазем 240 мг — на 11,93 мм рт.ст., у групі комбінації лерканідипін 10 мг та дилтіазем 120 мг — на 13,11 мм рт.ст., у групі комбінації лерканідипін 20 мг та дилтіазем 120 мг — на 14,82 мм рт.ст. Тобто всі вибрані схеми лікування були однаково ефективними в плані зниження центрального АТ.
2. Не спостерігалося негативного впливу всіх схем лікування на рівень ліпідного спектра крові.
3. Центральний САТ пов’язаний із рівнем ДАТ при добовому моніторуванні та з показниками, що характеризують пружно–еластичні властивості артерій, рівнем холестерину, товщиною комплексу інтима–медіа сонних артерій. У різних групах лікування спостерігалися різні фактори, що достовірно корелювали із кінцевим ЦАТ і ступенем його зниження. У групі комбінованої терапії кінцевий ЦАТ був пов’язаний із рівнем кінцевих офісного САТ, офісного ДАТ, показниками, що характеризують пружно–еластичні властивості артерій. У групі монотерапії кінцевий ЦАТ був достовірно обернено пов’язаний із ступенем зниження на фоні лікування офісної ЧСС та рівнем офісного САТ у кінці лікування. Ступінь зниження ЦАТ у групі комбінованої терапії достовірно був пов’язаний із показниками пружно–еластичних властивостей артерій, а також із товщиною комплексу інтима–медіа сонних артерій і рівнем загального холестерину.
4. Усі схеми лікування достовірно не впливали на середні величини показників, що характеризують пружно–еластичні властивості артерій (у зв’язку з коротким терміном спостереження).
5. Призначене лікування найбільш ефективно переносилося хворими, які приймали монотерапію лерканідипіном 20 мг та низькодозову комбінацію лерканідипіну 10 мг та дилтіазему 120 мг.
1. Радченко Г.Д., Міхєєва К.В., Сіренко Ю.М., Кушнір С.М., Пономарьова Г.В. Ефективність лікування на основі препарату Лоріста-НД — лозартан 100 мг + гідрохлортіазид 25 мг — порівняно з комбінацією бісопролол 10 мг + гідрохлортіазид 25 мг у пацієнтів з помірною та тяжкою артеріальною гіпертензією: дослідження ЕЛІЗА (результати 6-місячного спостереження) // Артеріальна гіпертензія. — 2010. — № 6. — С. 23-35.
2. Хвороби системи кровообігу як медико-соціальна і суспільно-політична проблема. Аналітично-статистич. посібн. / За ред. В.М. Коваленка, В.М. Корнацького. — К., 2014. — 115 с.
3. 2007 European Society of Hypertension — European Society of Cardiology guidelines for management of arterial hypertension // J. Hypertension. — 2007. — Vol. 25. — P. 1105-1187.
4. Asmar R. Effect of antihypertensive agents on arterial stiffness as evaluated by pulse wave velocity: clinical implications // Am. J. Cardiovasc. Drugs. — 2001. — Vol. 1(5). — P. 387-397.
5. Barrios V., Navarro A., Esteras A. at al. Investigators of ELYPSE Study. Antihypertensive efficacy and tolerability of lercanidipine in daily clinical practice. The ELYPSE Study // Blood Press. — 2002. — Vol. 11(2). — P. 95-100.
6. Blacher J., Asmar R., Djane S., London G.M., Safar M.E. Aortic pulse wave velocity as a marker of cardiovascular risk in hypertensive patients // Hypertension. — 1999. — Vol. 33. — P. 1111-1117.
7. Blacher J., Guerin A.P., Pannier B. et al. Arterial calcifications, arterial stiffness, and cardiovascular risk in end-stage renal disease // Hypertension. — 2001. — Vol. 38. — P. 938-942.
8. Blacher J., Pannier B., Guerin A.P. et al. Carotid arterial stiffness as a predictor of cardiovascular and all-cause mortality in end-stage renal disease // Hypertension. — 1998. — Vol. 32. — P. 570-574.
9. Boutouyrie P., Achouba A., Trunet P. et al. for the EXPLOR Trialist Group. Amlodipine-Valsartan Combination Decreases Central Systolic Blood Pressure More Effectively Than the Amlodipine-Ate-nolol Combination The EXPLOR Study // Hypertension. — 2010. — Vol. 55. — P. 1314-1322.
10. Cohn J. Is it the blood pressure or the blood vessel? // Journal of American Society of Hypertension. — 2007. — Vol. 1. — P. 5-16.
11. Dahlof B., Devereux R.B., Kjeldsen S.E. et al. LIFE Study Group Cardiovascular morbidity and mortality in the Losartan Intervention for Endpoint reduction in hypertension study (LIFE): a randomized trial against atenolol // Lancet. — 2002. — Vol. 359. — P. 995-1003.
12. De Ciuceis C., Salvetti M., Rossini C. at al. Effect of antihypertensive treatment on microvascular structure, central blood pressure and oxidative stress in patients with mild essential hypertension // J. Hypertens. — 2014. — Vol. 32(3). — P. 565-574.
13. Fumiharu Togo and Masaya Takahashi. Heart Rate Variability in Occupational Health — A Systematic Review // Industrial Health. — 2009. — Vol. 47. — P. 589-602.
14. Horwitz L.D., Weinberger H.D., Clegg L. Comparison of amlodipine and long-acting diltiazem in the treatment of mild or mo-derate hypertension // Am. J. Hypertens. — 1997. — Vol. 10(11). — P. 1263-1269.
15. Hulley S.B., Furberg C.D., Gurland B., McDonald R., Per-
ry H.M., Schnaper H.W., Schoenberger J.A., Smith W.M., Vogt T.M. Systolic Hypertension in the Elderly Program (SHEP): antihypertensive efficacy of chlorthalidone // Am. J. Cardiol. — 1985. —
Vol. 56(15). — P. 913-920.
16. Kawano Y., Makino Y., Okuda N., Takishita S., Omae T. Effects of diltiazem retard on ambulatory blood pressure and heart rate variability in patients with essential hypertension // Blood Press. Monit. — 2000 — Vol. 5(3). — P. 181-185.
17. Li L.X., Tang W., Chen B.J., Wang T. Cross-sectional study of relation between blood pressure and heart rate variability in patients with peritoneal dialysis // Beijing Da Xue Xue Bao. — 2011. — Vol. 43(6). — P. 849-854.
18. Lindsay R.S., Resnick H.E., Zhu J., Tun M.L., Howard B.V., Zhang Y., Yeh J., Best L.G. Adiponectin and coronary heart disease: the Strong Heart Study // Arterioscler. Thromb. Vasc. Biol. — 2005. — Vol. 25(3). — P. 15-16.
19. Luk J.H., Walsh B., Yasbin P. Safety and efficacy of prehospital diltiazem // West J. Emerg. Med. — 2013. — Vol. 14(3). — P. 296-300.
20. Mackenzie I.S., McEniery C.M., Dhakam Z., Brown M.J., Cockcroft J.R., Wilkinson I.B.Comparison of the effects of antihypertensive agents on central blood pressure and arterial stiffness in isolated systolic hypertension // Hypertension. — 2009. — Vol. 54(2). — P. 409-413.
21. Matsui Y., Eguchi K., O’Rourke M. Et al. Differential Effects Between a Calcium Channel Blocker and a Diuretic When Used in Combination With Angiotensin II Receptor Blocker on Central Aortic Pressure in Hypertensive Patients // Hypertension. — 2009. — Vol. 54. — P. 716-723.
22. Nayler W.G. Review of preclinical data of calcium channel blockers and atherosclerosis // J. Cardiovasc. Pharmacol. — 1999. — Vol. 2. — P. 7-11.
23. Paoletti R., Bernini F., Corsini A., Soma M.R. The antiatherosclerotic effects of calcium antagonists // J. Cardiovasc. Pharmacol. — 1995. — Vol. 3. — P. 6-10.
24. Piccirillo G., Fimognari F.L., Munizzi M.R., Bucca C., Cacciafesta M., Marigliano V. Age-depended influence on heart rate variability in salt-sensitive hypertensive subjects // J. Am. Geriatr. Soc. — 1996. — Vol. 44(5). — P. 530-538.
25. Protogerou A., Blacher J., Stergiou G.S., Achimastos A., Safar M.E. Blood pressure response under chronic antihypertensive drug therapy: the role of aortic stiffness in the REASON (Preterax in Regression of Arterial Stiffness in a Controlled Double-Blind) study // J. Am. Coll. Cardiol. — 2009. — Vol. 53(5). — P. 445-451.
26. Raicu M., Pojoga L., Simionescu N., Simionescu M. Differential effect of two calcium channel blockers nifedipine and diltiazem on atherogenesis in hypercholesterolemic hamster // J. Submicrosc. Cytol. Pathol. — 1996. — Vol. 28(2). — P. 265-275.
27. Raicu M., Pojoga L., Simionescu N., Simionescu M. The effect of ACE inhibitors on atheroma formation is potentiated by association with a calcium channel blocker. A biochemical and ultrastructural study // J. Submicrosc. Cytol. Pathol. — 1997. — Vol. 29(3). — P. 317-328.
28. Richard S. Vascular effects of calcium channel antagonists: new evidence // Drugs. — 2005. — Vol. 65(2). — P. 1-10.
29. Safar M., Protogerou A., Blacher J. Central blood pressure under angiotensin and calcium channel blockade // Hypertension. — 2009. — Vol. 54. — P. 704-706.
30. Sakurai-Yamashita Y., Harada N., Niwa M. Lercanidipine rescues hippocampus pyramidal neurons from mild ischemia-induced delayed neuronal death in SHRSP // Cell. Mol. Neurobiol. — 2011. — Vol. 31(4). — P. 561-567.
31. Salo T.M., Viikari J.S., Antila K.J., Voipio-Pulkki L.M., Jalonen J.O., Valimaki I.A. Antihypertensive treatment and hert rate variability in diabetic patients: role of cardiac autonomic neuropathy // J. Auton. Nerv. Syst. — 1996, Aug 27. — Vol. 60(1–2). — P. 61-70.
32. Scholze J.E.Differential therapy with calcium antagonists // Herz. — 2003. — Vol. 28(8). — P. 754-763.
33. Sutton-Tyrrell K., Mackey R.H., Holubkov R. еt al. Measurement variation of aortic pulse wave velocity in the elderly // Am. J. Hypertens. — 2001. — Vol. 14. — P. 463-468.
34. Wang H.B., Shi Q., Zhang C. Effects of heart rate variabi-lity and smoothness index on reversal of hypertensive left ventricular hypertrophy // Zhonghua Yi Xue Za Zhi. — 2011. — Vol. 91(12). — P. 832-835.
35. Williams B., Lacy P., Cruickshank J. et al. Impact of Statin Therapy on Central Aortic Pressures and Hemodynamics Principal Results of the Conduit Artery Function Williams B., Lacy P., Cruickshank J. et al. Impact of Statin Therapy on Central Aortic Pressures and Hemodynamics Principal Results of the Conduit Artery Function Evaluation-Lipid-Lowering Arm (CAFE-LLA) Study // Circulation. — 2009. — Vol. 119. — P. 53-61.
36. Woźnicka-Leśkiewicz L., Posadzy-Małaczyńska A., Jusz-kat R. The impact of ankle brachial index and pulse wave velocity on cardiovascular risk according to SCORE and Framingham scales and sex differences // J. Hum. Hypertens. — 2014. — 25. — doi: 10.1038/jhh.2014.80.
37. Wright J.T. Jr, Sica D.A., Gana T.J., Bohannon K., Pascual L.G., Albert K.S. Antihypertensive efficacy of night-time graded-release diltiazem versus morning amlodipine in African Americans // Am. J. Hypertens. — 2004. — Vol. 17(9). — P. 734-742.
38. Zanchetti A., Bond M.G., Hennig M. at al. European Lacidipine Study on Atherosclerosis investigators. Calcium antagonist lacidipine slows down progression of asymptomatic carotid atherosclerosis: principal results of the European Lacidipine Study on Atherosclerosis (ELSA), a randomized, double-blind, long-term trial // Circulation. — 2002. — Vol. 106(19). — P. 2422-2427.

/82/82.jpg)
/84/84-1.jpg)
/84/84-2.jpg)
/85/85.jpg)