Журнал «» 3 (41) 2015
Вернуться к номеру
Нейрогуморальний вплив артеріальної гіпертензії та хронічної хвороби нирок на гострий інфаркт міокарда: патогенетичні взаємодії ремоделювання серця з використанням антагоністів альдостерону
Авторы: Тащук В.К., Полянська О.С., Гулага О.І., Гінгуляк О.М. - Кафедра внутрішньої медицини, фізичної реабілітації та спортивної медицини Буковинського державного медичного університету, м. Чернівці
Рубрики: Кардиология
Разделы: Справочник специалиста
Версия для печати
Перебіг гострого Q-інфаркту міокарда при наявній артеріальній гіпертензії супроводжується надмірною активацією ренін-ангіотензин-альдостеронової системи, втратою скорочувальної здатності гладком’язових клітин, розширенням передсердь, а зменшення рівня нейропептиду вазопресину при використанні антагоністів альдостерону забезпечує функціонуючий захист від розвитку серцевої недостатності. Еплеренон порівняно зі спіронолактоном сприяє більш вираженому зниженню концентрації альдостерону, особливо у хворих із хронічною хворобою нирок ІІ стадії. Рівні передсердного натрійуретичного пептиду, ангіотензинперетворювального ферменту та фактора Віллебранда у таких хворих при застосуванні спіронолактону мали статистично вірогідну тенденцію до зростання, а при використанні еплеренону спостерігалося вірогідне зниження їх концентрації. Параметри нейрогуморальних показників служать не тільки діагностичними маркерами перебігу захворювання, окремі з них є незалежними предикторами розвитку та прогресування кардіоваскулярних катастроф.
Течение острого Qинфаркта миокарда при артериальной гипертензии проявляется чрезмерной активацией ренинангиотензинальдостероновой системы, потерей сократительной способности гладкомышечных клеток, расширением предсердий, а уменьшение нейропептида вазопрессина при использовании антагонистов альдостерона обеспечивает функционирующую защиту от развития сердечной недостаточности. Эплеренон по сравнению со спиронолактоном способствует более выраженному снижению концентрации альдостерона, особенно у больных с хронической болезнью почек II стадии. Уровни предсердного натрийуретического пептида, ангиотензинпревращающего фермента и фактора Виллебранда у таких больных при применении спиронолактона имели статистически достоверную тенденцию к росту, а при использовании эплеренона наблюдалось достоверное снижение их концентрации. Параметры нейрогуморальных показателей служат не только диагностическими маркерами течения заболевания, некоторые из них являются независимыми предикторами развития и прогрессирования кардиоваскулярных катастроф.
The course of acute Q-myocardial infarction with existing hypertension is associated with excessive activation of renin-angiotensin-aldosterone system, loss of contractility in smooth muscle cells, atrial enlargement, and reduced level of neuropeptide vasopressin, when using aldosterone antagonists, provides functional protection against heart failure. Eplerenone compared to spironolactone contributes to a significant reduction in aldosterone concentration, especially in patients with chronic kidney disease stage II. The levels of atrial natriuretic peptide, angiotensin-converting enzyme and von Willebrand factor in these patients, when using spironolactone, had a statistically significant upward trend, and when using eplerenone, there was a statistically significant decrease in their concentration. Neurohormonal parameters are not only diagnostic markers of the disease course, some of them are independent predictors of cardiovascular accidents progression.
інфаркт міокарда, артеріальна гіпертензія, хронічна хвороба нирок, серцева недостатність, антагоністи альдостерону.
инфаркт миокарда, артериальная гипертензия, сердечная недостаточность, хроническая болезнь почек, антагонисты альдостерона.
myocardial infarction, hypertension, chronic kidney disease, heart failure, aldosterone antagonists.
Статья опубликована на с. 61-65
Вступ
Проблема надання медичної допомоги пацієнтам із супутньою та поєднаною патологією активно обговорюється у сучасній науковій літературі. Значна кількість пацієнтів має одночасне порушення функції серця та нирок, первинне порушення одного з цих органів може викликати дисфункцію іншого, що викликає необхідність довготривалого лікування. Одним із важливих завдань лікування хворих на гострий інфаркт міокарда (ГІМ) залежно від наявної артеріальної гіпертензії (АГ) та хронічної хвороби нирок (ХХН) є не тільки ліквідація проявів захворювання, запобігання його прогресуванню, стабілізація функціональної спроможності, а й запобігання розвитку змін, що в подальшому можуть призвести до погіршення якості життя пацієнта [3, 5]. Також відомо, що зниження функції нирок негативно впливає на прогноз серцево–судинних захворювань. У багатьох клінічних обстеженнях була встановлена щільна асоціація між тяжкістю ниркової дисфункції та ризиком загальної смертності і виникненням кардіоваскулярних подій, включаючи ГІМ, раптову смерть, мозковий ішемічний інсульт. За даними дослідження HOPE, легка дисфункція нирок (креатинін 124–
200 мкмоль/л), незалежно від інших факторів ризику та лікування, супроводжувалася збільшенням на 40 % серцево–судинних ускладнень. Зниження швидкості клубочкової фільтрації (ШКФ) менше 60 мл/хв уже пов’язане з підвищенням серцево–судинної смертності на 50 % [3–5]. Відомо [7, 8], що порушення функції нирок суттєво впливає на активність нейрогуморальних чинників, що беруть участь у регуляції серцево–судинної системи, реалізації компенсаторно–пристосувальних реакцій при ГІМ. У зв’язку з цим нами проведено аналіз динаміки вазоактивних речовин у хворих на ГІМ із/без АГ і ХХН при застосуванні антагоністів альдостерону (АА).
Мета дослідження: вивчити вплив антагоністів альдостерону на нейрогуморальні порушення при гострому інфаркті міокарда на тлі артеріальної гіпертензії, хронічної хвороби нирок та виникнення і прогресування серцевої недостатності.
Матеріал і методи дослідження
Групу дослідження становили 106 пацієнтів, які знаходилися на стаціонарному лікуванні з приводу гострого Q–інфаркту міокарда. Діагноз верифіковано згідно із стандартами Української асоціації кардіологів. Середній вік хворих становив 51,50 ± 3,94 року. Пацієнти розподілені залежно від коливань артеріального тиску (АТ) — </≥ 140/90 мм рт.ст.; групи без ознак АГ і з визначеним діагнозом АГ за рівнем систолічного АТ розрізнялися вірогідно (117,6 ± 2,7 і 156,2 ± 2,7 мм рт.ст.,
р < 0,001). Формулювання діагнозу та розподіл на стадії ХХН було здійснено згідно з рекомендаціями Української асоціації нефрологів (2011 р.) за параметрами ШКФ на тлі хронічного пієлонефриту у фазі ремісії. Хворі були поділені на 2 групи залежно від рівня ШКФ (визначали за формулою Кокрофта — Голта): 1–шу групу становили хворі з рівнем ШКФ ≤ 90 мл/хв,
2–гу групу — з рівнем ШКФ > –адреноблокатори, інгібітори ангіотензинперетворювального ферменту, статини й один з АА (спіронолактон або еплеренон)). Статистична обробка результатів досліджень проводилася з використанням електронних таблиць Microsoftb90 мл/хв. Окрім загальноклінічних та інструментальних обстежень, у всіх хворих імуноферментним методом визначали рівні гормонів: альдостерону (Альдо), натрійуретичного пептиду (НУП), ангіотензинперетворювального фермента (АПФ), вазопресину (Вп) та фактора Віллебранда (ФВб) — вихідні і при лікуванні згідно з рекомендаціями Української асоціації кардіологів [3] (антикоагулянти, дезагреганти, нітрати пролонгованої дії, ® Office Excel (build 11.5612.5703), програми для статистичної обробки Statgraphics Plus 5.1 Enterprise edition (®Statistical Graphics corp., 2001).
Результати дослідження та їх обговорення
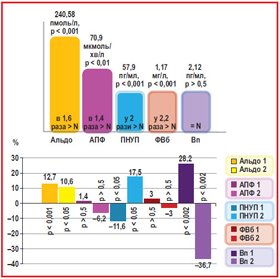
Власні результати в розподілі пацієнтів із Q–ГІМ на групи залежно від наявної/відсутньої АГ свідчили про переважання у хворих на Q–ГІМ вмісту альдостерону в 1,6 раза більше за контрольний показник, що становило 240,58 пмоль/л (р < 0,001), до того ж вихідний рівень Альдо на 12,7 % (р < 0,05) був більшим у групі з АГ порівняно з групою з нормальним АТ, що зберігалось і при лікуванні (10,6 %, р < 0,05), оскільки гіперпродукція альдостерону є відображенням надмірної активації ренін–ангіотензин–альдостеронової системи (РААС).
У пацієнтів із Q–ГІМ визначено збільшення рівнів АПФ (70,9 мкмоль/хв/л) в 1,4 раза проти контрольної групи (р < 0,01), аналіз яких свідчив про відсутність вірогідних змін показника на виході у разі наявної АГ проти відсутньої АГ (1,4% переважання, р > 0,5) при тенденції до переважання цього показника при лікуванні (–6,2 %, р > 0,5), як наведено на рис. 1, а отже, такий зв’язок може пояснюватися патогенною дією АПФ при Q–ІМ із/без АГ у разі перетворення ангіотензину І в ангіотензин ІІ і активації скорочення гладком’язових клітин (ГМК).
Фізіологічним антагоністом активації РААС є перед–сердний НУП (ПНУП), концентрація якого (57,9 пг/мл,
р < 0,001) при Q–ГІМ у 2 рази перевищувала показник контрольної групи, а залежно від наявної/відсутньої АГ (рис. 1) зареєстроване вихідне зменшення показника за наявної АГ (на 11,6 %, р < 0,05), що свідчить про протилежне спрямування лікування (+ 7,5, р < 0,05) і є проявом активації ендокринної функції серця у відповідь на розширення передсердь через зростання об’єму циркулюючої крові.
Показник вмісту ФВб у плазмі крові при Q–ГІМ був у 2,2 раза вищим (рис. 1) за контрольний (1,17 мг/л, р < 0,001), що є доказом надмірної активації в обстежених пацієнтів коагуляційного потенціалу через виражену ендотеліальну дисфункцію, однак при наявній/відсутній АГ його коливання були в межах ±5 % і були невірогідні в обох групах.
Дослідження вазоконстрикторного нейропептиду Вп (рис. 1) має важливе значення переважно в розвитку серцевої недостатності. Визначений при Q–ГІМ його вміст 2,12 пг/мл відповідав нормативному показнику — 2 пг/мл, однак суттєво переважав при наявності АГ (28,2 %, р < 0,002) і суттєво зменшувався при лікуванні якраз у групі з АГ порівняно з групою без АГ (–36,7 %, р < 0,002). Отже, вазоконстрикторний нейропептид Вп суттєво переважає при наявності АГ та зменшується при лікуванні, що свідчить про профілактику СН.
/62/62.jpg)
Наслідком Q–ІМ є вихідна активація РААС із патогенною дією АПФ і активація коагуляційного потенціалу, а отже, активація скорочення ГМК випереджає СН, що підтверджує вихідний вазопресин. В обстежених хворих на Q–ІМ з АГ спостерігається надмірна активація РААС, що проявляється в зростанні концентрації альдостерону та АПФ, стимуляції ендокринної функції серця, залежно від змін ПНУП та проявів ендотеліальної дисфункції, вазоспазму та гіперкоагуляції, відображенням чого є зростання концентрації Вп і ФВб, яке супроводжується втратою скоротливості ГМК, розширенням передсердь і втручанням заакцептованого лікування (АА) зі зменшенням нейропептиду Вп, що забезпечує функціонуючий захист від розвит–
ку СН.
Також обстежені хворі були поділені на 2 групи залежно від стадій ХХН [1]: до першої групи увійшли 52 хворі, яким до лікування було включено неселективний АА спіронолактон (реєстраційний № 011953/01 від 02.09.05 p.), добова доза становила [3] 25 мг, упродовж 28 діб (розподіл пацієнтів із ХХН у цій групі:
із ІІ ст. — 18 осіб, із І ст. — 34); другу групу становили 54 пацієнти, у яких медикаментозна терапія була доповнена селективним АА еплереноном (реєстраційні свідоцтва № UA/3752/0101, UA/3752/01/02 від 09.11.2005 р.), доза препарату [6] — 25 мг на добу, упродовж 28 діб (розподіл пацієнтів із ХХН у цій групі:
із ІІ ст. — 19 осіб, із І ст. — 35).
Однією з провідних причин виникнення та прогресування ГІМ із ХХН можуть слугувати нейроендокринні та нейрогуморальні порушення — зміни концентрації А, АПФ, ПНУП та ФВб, що сприяють розвитку структурних змін ішемізованого міокарда.
При застосуванні спіронолактону встановлено вірогідне зниження концентрації в плазмі крові рівня Альдо у хворих на ГІМ із ХХН ІІ ст. (з 245,08 ± 17,38 до 195,15 ± 13,82 пмоль/л; р < 0,05). У пацієнтів із ХХН І ст. концентрація Альдо хоч і знижувалася, однак відмінності були статистично невірогідні.
Серед хворих, які отримували еплеренон, виявлено вірогідне зниження концентрації Альдо як у пацієнтів із ХХН ІІ ст. (з 275,59 ± 23,43 до 169,37 ± 24,46 пмоль/л; р < 0,001), так і в пацієнтів із ХХН І ст. (з 229,77 ± 13,76 до 156,76 ± 5,76 пмоль/л; р < 0,05).
При порівняльному аналізі впливу спіронолактону та еплеренону на концентрацію Альдо у хворих на ГІМ із різними стадіями ХХН виявлені певні відмінності, що, з нашого погляду, мають практичне значення. Так, застосування АА в пацієнтів із ХХН ІІ ст. сприяло більш вираженому зниженню рівня Альдо порівняно з пацієнтами з ХХН І ст. До того ж процентне зниження (∆%) Альдо в пацієнтів із ХХН ІІ ст. при прийомі спіронолактону становило –20,4 %, а в групі еплеренону — –38,6 %. Серед пацієнтів із ХХН І ст. у І групі процентне зниження А становило –15,6 %, а в ІІ групі — –31,8 %.
Звертає на себе увагу більш виражене зниження концентрації А у хворих із ХХН ІІ ст., це зумовлено дещо вищим вихідним рівнем його концентрації, що є свідченням вагомого впливу цього гормона на порушення функції нирок при розвитку ГІМ [6, 9].
Концентрація ПНУП у пацієнтів із ХХН ІІ ст. І групи практично не змінювалася, а в ІІ групі хворих знижувалася з 66,31 ± 8,79 до 30,17 ± 4,53 пг/мл (р < 0,01). Серед хворих із ХХН І ст. концентрація ПНУП у плазмі крові знижувалася в групі спіронолактону з 60,60 ± 5,71 до 43,16 ± 4,90 пг/мл (р < 0,05), а в групі еплеренону — з 55,99 ± 5,80 до 31,24 ± 3,59 пг/мл (р < 0,05).
Показники динаміки рівня ПНУП (∆%) у хворих на ІМ із різними стадіями ХХН при прийомі спіронолактону та еплеренону суттєво відрізнялися. При використанні еплеренону процентне зниження (∆%) рівня ПНУП у пацієнтів із ХХН ІІ ст. було –54,5 %, а при застосуванні спіронолактону відмічалося процентне збільшення (∆%) — + 0,6 %. Серед пацієнтів із ХХН І ст. динаміка рівня ПНУП у І групі становила –34,6 %, а в ІІ групі — –44,3 %.
Активність АПФ у хворих, які приймали спіронолактон, із ХХН ІІ ст. мала тенденцію до невірогідного зростання, а в групі еплеренону високовірогідно знижувалася (з 81,33 ± 4,06 до 55,47 ± 4,41 ммоль/хв/л; р < 0,001). У пацієнтів із ХХН І ст. активність АПФ у І групі знижувалася з 74,01 ± 4,87 до 65,17 ± 2,62 ммоль/хв/л
(р < 0,05), а в групі ІІ — з 68,08 ± 2,95 до 52,86 ± ± 2,31 ммоль/хв/л (р < 0,05).
Показники відношення динаміки активності АПФ (∆%) у хворих на ІМ із різними стадіями ниркової дисфункції при застосуванні спіронолактону та еплеренону також суттєво відрізнялися. Так, серед хворих, які приймали спіронолактон, процентні зміни (∆%) концентрації АПФ у пацієнтів із ХХН ІІ ст. становили
+6,6 %, а в групі хворих, які отримували еплеренон — –31,8 %. У пацієнтів із ХХН І ст. ∆% АПФ при використанні спіронолактону становили –11,9 %, а при при–йомі еплеренону — –32,3 %.
Серед хворих із ХХН ІІ ст. концентрація ФВб невірогідно зростала (з 0,99 ± 0,13 до 1,13 ± 0,06 мг/л) у плазмі крові осіб І групі, а в групі ІІ вірогідно знижувалася (з 1,29 ± 0,19 до 0,71 ± 0,14; р < 0,05). У хворих із ХХН І ст., які приймали спіронолактон, концентрація ФВб знижувалася невірогідно (з 1,22 ± 0,13 до 1,03 ± ± 0,06 мг/л), а при застосуванні еплеренону — з 1,14 ± ± 0,09 до 0,79 ± 0,08 (р < 0,05).
При цьому спостерігалися відмінності відношення динаміки зміни концентрації ФВб (∆%) у хворих на ІМ із різними стадіями ниркової дисфункції. Так, у пацієнтів із ХХН ІІ ст. при застосуванні спіронолактону ∆% ФВб становила 14,1 %, а при використанні еплеренону була –44,9 %. У пацієнтів із ХХН І ст. цей показник у І групі становив –5,6 %, а в ІІ групі пацієнтів — –31 %.
Активація ренін–ангіотензин–альдостеронової сис–
–теми, що виникає внаслідок ГІМ, призводить до каскадної реакції наростання концентрації нейрогуморальних месенджерів. Надмірний синтез Альдо через затримку нирками натрію та води призводить до збільшення об’єму циркулюючої крові, зменшення серцевого викиду та прогресування СН [9, 11], а через зростання активності АПФ сприяє збільшенню рівня ангіотензину ІІ, що завдяки вазоконстрикції та ендотеліальній дисфункції є фактором пошкодження при ГІМ. Ініціація альдостероном синтезу ПНУП, що має протилежну біологічну дію, призводить до нейрогуморального дисбалансу, порушень регуляції різних органів і систем. При ГІМ на тлі ХХН виявляються підвищена активність симпатоадреналової системи, ендотеліальна дисфункція, системна прозапальна та нейрогуморальна активація, що призводить до формування та прогресування СН [1, 2, 10]. Використання еплеренону у хворих на ГІМ при ренокардіальному синдромі з урахуванням стадії ХХН дає можливість впливати на виникнення та прогресування СН.
Висновки
1. Перебіг гострого Q–інфаркту міокарда з наявною артеріальною гіпертензією супроводжується надмірною активацією ренін–ангіотензин–альдостеронової системи, втратою скорочувальної здатності гладком’язових клітин, розширенням передсердь, а зменшення нейропептиду вазопресину при використанні антагоністів альдостерону забезпечує функціонуючий захист від розвитку серцевої недостатності.
2. Використання спіронолактону у хворих на гострий інфаркт міокарда з хронічною хворобою нирок ІІ ст. призводить до зниження рівня альдостерону (р < 0,05), а в пацієнтів із ХХН І ст. — до зменшення рівня передсердного натрійуретичного пептиду
(р < 0,05) та ангіотензинперетворювального ферменту (р < 0,05).
3. У групі хворих на гострий інфаркт міокарда з ХХН ІІ ст., які приймали еплеренон, виявлено вірогідне зниження концентрації альдостерону (р < 0,001), передсердного натрійуретичного пептиду (р < 0,01), ангіотензинперетворювального ферменту (р < 0,001) та фактора Віллебранда (р < 0,05), а у хворих із ХХН І ст. спостерігалося вірогідне зниження концентрації альдостерону (р < 0,05), передсердного натрійуретичного пептиду (р < 0,05), ангіотензинперетворювального ферменту (р < 0,05) та фактора Віллебранда (р < 0,05).
1. Іванов Д.Д. Настанови KDIGO для клінічної практики з регулювання артеріального тиску при хронічному захворюванні нирок / Д.Д. Іванов, Л.А. Пиріг, М.Д. Іванова // Почки. — 2013. — Т. 1, ч. 3. — Режим доступу: http://www.mif-ua.com/archive/article/35096
2. Коваленко В.Н. Ренин-ангиотензиновая система в кардиальной патологии. Часть 2 / В.Н. Коваленко, Т.В. Талаева, В.В. Братусь // Укр. кардіол. журн. — 2012. — № 4. —
С. 68-84.
3. Проект. Клінічні рекомендації з діагностики та лікування гострої серцевої недостатності: оновлення 2012 року / О.М. Пархоменко, К.М. Амосова, Г.В. Дзяк [та ін.] // 2012. — Режим доступу: http://www.strazhesko.org.ua/inc/materials/gsn_recommend_2012_final.doc
4. Вauersachs J. Pre-clinical data on involvement of mineralocorticoid receptor activation in healing and remodeling post-myocardial infarction / J. Bauersachs, D. Fraccarolo // Eur. Heart J. Suppl. — 2012. — Vol. 13. — Suppl. B. — В10-В14.
5. Bosch J. Ultrafiltration in heart failure with cardiorenal syndrome / J. Bosch, L.A. Rios-Nogales Garces // N. Engl. J. Med. — 2013. — V. 368, № 12. — P. 1158.
6. Costanzo M.R. Ultrafiltration in heart failure with cardiorenal syndrome / M.R. Costanzo, G.C. Fonarow, G.S. Filippatos // N. Engl. J. Med. — 2013. — V. 368, № 12. — P. 1158-1159.
7. Cruz D.N. Cardiorenal syndrome in critical care: the acute cardiorenal and renocardiac syndromes / D.N. Cruz // Adv. Chronic Kidney Dis. — 2013. — V. 20, № 1. — P. 56-66.
8. Declining in-hospital mortality and increasing heart failure incidence in elderly patients with first myocardial infarction / J. Ezekowitz, P. Kaul, J. Bakal [et al.] // J. Amer. Coll. Cardiology. — 2012. — Vol. 53, № 1. — P. 13-20.
9. Lee S.R. Novel Biomarkers for Cardio-renal Syndrome / S.R. Lee, K.H. Jeong // Electrolyte Blood Press. — 2012. — V. 10, № 1. — P. 7-12.
10. McMuray J. ESC Guideilnes for the diagnosis and treatment of acute and chronic heart failure 2012 / J. McMuray, S. Adaumopolous // Europ. Heart J. — 2012. — V. 12, № 33. — Р. 1787-1847.
11. Messaoudi S. Aldosterone and the mineralocorticoid receptor / S. Messaoudi, F. Jaisser // Eur. Heart J. Suppl. — 2012. — Vol. 13. — Suppl. B. — B4-B9.
12. Prosek J. Cardiorenal syndrome and the role of ultrafiltration in heart failure / J. Prosek, A. Agarwal, S.V. Parikh // Curr. Heart. Fail. Rep. — 2013. — V. 10, № 1. — P. 81-88.