Журнал «Актуальная инфектология» 1 (6) 2015
Вернуться к номеру
Вивчення причин вірусологічної неефективності АРТ на ранніх строках лікування ВІЛ-інфікованих пацієнтів
Авторы: Люльчук М.Г. — ДУ «Інститут епідеміології та інфекційних хвороб ім. Л.В. Громашевського НАМН України», м. Київ
Рубрики: Инфекционные заболевания
Разделы: Клинические исследования
Версия для печати
Обстежено 556 пацієнтів, інфікованих вірусом імунодефіциту людини (ВІЛ), які приймали антиретровірусну терапію (АРТ) протягом 6 місяців, на рівень вірусного навантаження ВІЛ. У 5,92 % випадків виявлено рівень вірусного навантаження понад 1000 РНК-копій/мл, що свідчило про вірусологічну неефективність АРТ. На основі молекулярно-генетичного аналізу геному ВІЛ встановлено, що серед факторів, які впливають на формування вірусологічної неефективності АРТ на ранніх строках лікування, одне з головних місць займає порушення пацієнтами режиму прийому антиретровірусних препаратів (низька прихильність до терапії).
Обследовано 556 пациентов, инфицированных вирусом иммунодефицита человека (ВИЧ), которые принимали антиретровирусную терапию (АРТ) в течение 6 месяцев, на уровень вирусной нагрузки ВИЧ. В 5,92 % случаев выявлен уровень вирусной нагрузки более 1000 РНК-копий/мл, что свидетельствовало о вирусологической неэффективности АРТ. На основе молекулярно-генетического анализа генома ВИЧ установлено, что среди факторов, которые влияют на формирование вирусологической неэффективности АРТ на ранних сроках лечения, одно из главных мест занимает нарушение пациентами режима приема антиретровирусных препаратов (низкая приверженность к терапии).
556 HIV-infected patients who received antiretroviral therapy (ART) for 6 months were examined for the level of HIV viral load. In 5.92 % of cases we diagnosed viral load above 1,000 RNA copies/ml that indicated virologic failure of ART. On the basis of molecular genetic analysis of the HIV genome, it was found that among the factors influencing the formation of virologic failure of ART in the early stages, one of the most important is noncompliance of antiretroviral drug therapy in patients (low adherence to therapy).
ВІЛ, рівень вірусного навантаження ВІЛ, АРТ, вірусологічна ефективність АРТ, мутації резистентності ВІЛ.
ВИЧ, уровень вирусной нагрузки ВИЧ, АРТ, вирусологическая эффективность АРТ, мутации резистентности ВИЧ.
HIV, level of HIV viral load, antiretroviral therapy, virologic efficiency of antiretroviral therapy, mutation of HIV resistance.
Статья опубликована на с. 40-44
Вступ
Одним із показників ефективності антиретровірусної терапії (АРТ) є рівень вірусного навантаження (ВН) вірусу імунодефіциту людини (ВІЛ). Це найперший індикатор успіху або невдачі АРТ на ранніх строках лікування. Встановлено, що при низькому рівні ВН ВІЛ (менше 40–50 РНК-копій/мл) формування резистентних штамів вірусу не відбувається — це найбільш вагомий аргумент на користь підтримки ВН ВІЛ на низькому рівні впродовж тривалого часу [1]. Ознакою ефективної терапії протягом перших 4 тижнів є швидке зниження рівня ВН ВІЛ (aльфа-спад) внаслідок дії антиретровірусних (АРВ) препаратів на вільні віріони ВІЛ у плазмі крові та на ВІЛ в інфікованих СD4-лімфоцитах. Надалі відбувається наступне зниження ВН ВІЛ (бета-спад) за рахунок противірусної дії препаратів на уражені вірусом макрофаги та інші резервуари ВІЛ, включаючи дендритні клітини лімфатичних фолікулів. Бета-спад є більш тривалим та менш вираженим. Максимальний противірусний ефект у цьому випадку очікується через 4–6 місяців [2]. З огляду на цей факт «Клінічним протоколом антиретровірусної терапії ВІЛ-інфекції у дорослих та підлітків», затвердженим Наказом МОЗ України № 551 від 12.07.2010 р., регламентовано, що для встановлення вірусологічної ефективності лікування рівень ВН ВІЛ у пацієнтів, які отримують АРТ, має визначатися кожні 6 місяців [3].
Неможливість зменшення ВН ВІЛ до невизначального рівня (нижче 40–50 копій/мл) може свідчити про вірусологічну невдачу АРТ. Причиною зростання рівня ВН ВІЛ може бути формування стійкості вірусу до певних препаратів (виявити це можна за допомогою методу секвенування геному ВІЛ) або тимчасові порушення пацієнтами режиму прийому препаратів (недотримання часу та дози прийому АРВ-препаратів або взагалі відмова від терапії). Вказані порушення прийнято об’єднувати в термін «низька прихильність пацієнта до АРТ» [1, 2].
Метою роботи було вивчити причини вірусологічної неефективності антиретровірусної терапії ВІЛ-інфікованих пацієнтів на ранніх строках лікування.
Матеріали та методи
Дослідження проводились у рамках співробітництва між ДУ «Інститут епідеміології та інфекційних хвороб ім. Л.В. Громашевського НАМНУ», ДУ «Український центр контролю за соцхворобами МОЗ України» та ФДУ «НДІ вірусології ім. Д.І. Івановського» (м. Москва, Росія).
Секвенування геному ВІЛ проводили на базі лабораторії вірусів лейкозів ФДУ «НДІ вірусології ім. Д.І. Івановського» (м. Москва, Росія) з використанням тест-системи ViroSeqTM Genotyping System v.2.1 (фірма Abbott, США) згідно з інструкцією виробника.
Результати та їх обговорення
Були організовані когортні дослідження з визначення частоти та характеру мутацій резистентності ВІЛ до АРВ-препаратів у ВІЛ-інфікованих пацієнтів, які знаходилися під диспансерним наглядом у Кримському республіканському, Донецькому, Дніпропетровському, Миколаївському, Одеському обласних та Київському міському центрах профілактики і боротьби з синдромом набутого імунодефіциту (СНІД).
У кожному регіоні послідовно відбиралося не менше 100 зразків крові від ВІЛ-позитивних осіб, які відповідали критеріям відбору учасників дослідження: підтверджений діагноз ВІЛ-інфекції; відсутність в анамнезі досвіду прийому АРВ-препаратів; наявність показань до призначення АРТ; інформована згода щодо участі у дослідженнях. Всього до групи дослідження було залучено 676 ВІЛ-інфікованих пацієнтів. Проаналізовано дані щодо віку, статі пацієнтів, шляху інфікування, дати початку та схеми високоактивної антиретровірусної терапії. Вказані пацієнти протягом 2009 року розпочали прийом АРТ. У тому ж році з групи дослідження стали вибувати перші пацієнти.
Пацієнти вибували, якщо вони самостійно переривали лікування, переводилися на схему АРТ другого ряду чи помирали. Всього до листопада 2011 року з групи дослідження вибуло 174 пацієнти. Найчастіше (в 50,6 % випадків) пацієнти вибували з групи дослідження внаслідок низької прихильності до лікування: нерегулярного прийому або відмови від АРТ (31,61 ± 3,52 %), неявки на 2-й та 3-й прийом до лікаря (18,97 ± 2,97).
Разом із тим привернув увагу той факт, що у майже третині випадків (32,76 ± 3,56 %) причиною вибуття стала смерть пацієнтів. Аналіз даних показав, що в 42,11 % випадків пацієнти померли від ВІЛ-асоційованого туберкульозу, у 14,04 % — від злоякісних пухлин, у 10,5 % — від менінгоенцефалітів різної етіології.
З метою визначення вірусологічної ефективності АРТ пацієнти групи дослідження були обстежені на рівень ВН ВІЛ через 6 місяців після початку лікування. На момент обстеження із 676 пацієнтів АРТ протягом не менше 6 місяців приймали 556 осіб (табл. 1).
Встановлено, що в переважної більшості (70,02 ± 1,94 %) ВІЛ-інфікованих пацієнтів, які знаходились на АРВ-терапії понад 6 місяців, рівень ВН ВІЛ-1 не перевищував 40 РНК-копій/мл. У той же час у 33 (5,92 ± 1,00 %) пацієнтів через 6 місяців від початку терапії виявлено рівень ВН ВІЛ у плазмі крові понад 1000 РНК-копій/мл, що вказувало на вірусологічну неефективність застосованих схем АРТ.
Для встановлення причин вірусологічної неефективності лікування зразки плазми крові пацієнтів із рівнем вірусного навантаження понад 2000 РНК-копій/мл було підготовлено для проведення молекулярно-генетичного аналізу геному ВІЛ (тестувалися зразки крові з рівнем ВН ВІЛ понад 2000 РНК-копій/мл, оскільки чутливість тест-системи ViroSeqTM Genotyping System v.2.1 становить 2000 РНК-копій/мл).
Аналіз на наявність мутацій резистентності ВІЛ до антиретровірусних препаратів було проведено у 21 зразку плазми крові ВІЛ-інфікованих пацієнтів із вірусологічною неефективністю АРТ через 6 місяців лікування.
Результати тестування цих зразків показали, що в Україні відбувається формування резистентності ВІЛ, проте далеко не в усіх випадках саме резистентність вірусу стає причиною зростання рівня ВН ВІЛ.
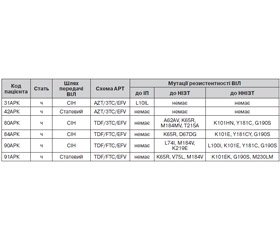
Так, із 6 протестованих зразків крові ВІЛ-інфікованих пацієнтів Кримського республіканського центру СНІДу з вірусологічною неефективністю лікування (табл. 2) мутації резистентності ВІЛ виявлено в 4 зразках (у пацієнта 42АРК мутацій резистентності ВІЛ не виявлено взагалі, у пацієнта 31АРК виявлено так звану «мінорну» мутацію резистентності ВІЛ (L10IL), що безпосередньо не впливає на стійкість вірусу до АРВ-препаратів) [1, 4].
У більшості зразків крові виявлено мутацію резистентності М184V, яка в гені зворотної транскриптази найчастіше з’являється однією з перших та закріплюється на тлі недостатньої вірусологічної відповіді на більшість схем, що складаються з нуклеозидних інгібіторів зворотної транскриптази (НІЗТ): ламівудину (3ТС) та емтрицитабіну (FTC) (чутливість вірусу до цих препаратів знижується більше ніж у 100 разів). Крім того, мутація М184V дещо знижує чутливість вірусу до абакавіру (ABC) і диданозину (ddI) (таке зниження не має клінічного значення за відсутності інших мутацій резистентності) [5, 6]. Разом із тим мутація М184V значно підвищує чутливість вірусу до азидотимідину (AZT), ставудину (d4T), тенофовіру (TDF), що в ряді випадків обумовлює доцільність збереження штамів з цією мутацією на домінуючому рівні (тому препарати 3ТС і FTC, у відповідь на які сформувалася мутація резистентності М184V, як правило, залишають у складі схем АРТ) [5, 6].
Ще одна мутація — K65R — викликає резистентність середнього рівня до ABC, ddI, 3ТС, FTC, низького рівня — до d4T, призводить до гіперчутливості до AZT. Комбінація мутацій M184МV та K65R посилює резистентність вірусу до ABC і ddI, проте значно підвищує чутливість ВІЛ до AZT. Слід відзначити, що, згідно з літературними даними, комбінація препаратів TDF/3TC або TDF/FTC найчастіше призводить до закріплення у вірусу мутацій K65R та M184V [6]. У наших дослідженнях вказану комбінацію мутацій виявлено в 3 із 4 зразків крові пацієнтів, які отримували схеми терапії з TDF/3TC або TDF/FTC. В одному зразку крові визначено мутацію A62А, що може призвести до формування резистентності вірусу до НІЗТ тільки у присутності мутацій комплексу Q151M (що сприяють розвитку мультирезистентності ВІЛ до НІЗТ).
Що стосується ненуклеозидних інгібіторів зворотної транскриптази (ННІЗТ), то з табл. 2 видно, що в усіх зразках крові виявлено мутацію G190S, яка викликає резистентність високого рівня до ефавірензу (EFV) і невірапіну (NVP) [7–11]. За наявності мутації G190S терапію препаратом групи ННІЗТ, до якого виникла стійкість вірусу, необхідно припинити, оскільки продовження прийому такого препарату на тлі недостатньої вірусологічної відповіді вірусу на терапію з досить значною вірогідністю призведе до зростання кількості мутацій резистентності ВІЛ до всього переліку ННІЗТ (у тому числі до препаратів із групи ННІЗТ, які ще знаходяться на стадії розробки). Аналогічна ситуація з мутаціями резистентності K101E/H/N, Y181CY [7–11].
Результати тестування зразків крові ВІЛ-інфікованих пацієнтів Миколаївського та Одеського обласних центрів СНІДу, які знаходились на лікуванні 6 місяців, показали схожі дані. З двох центрів протестовано 10 зразків крові (по 5 із кожного), мутації резистентності виявлено тільки в чотирьох (Ник12, Ник96 — у Миколаївському центрі та 15Од та 81Од — в Одеському) (табл. 3 і 4).
У решти пацієнтів (Ник7, Ник14, Ник27, 47Од, 50Од, 64Од) мутацій резистентності не виявлено взагалі або виявлені мутації поліморфізму (що не викликають стійкості вірусу до АРВ-препаратів за відсутності основних мутацій).
Привернув увагу такий результат: у зразку крові пацієнтки 81Од (дівчинка, 2007 р.н., інфікування шляхом вертикальної трансмісії ВІЛ) виявлено M184V-, а також E138A-мутацію поліморфізму, що не викликає суттєвого зниження чутливості ВІЛ. На момент обстеження дитина приймала схему AZT/3TC/Lpv/r протягом 10 місяців, проте вірусне навантаження ВІЛ (57428 РНК-копій/мл) вказувало на наявність вірусологічної неефективності лікування. Детальний аналіз показав, що зростання рівня ВН ВІЛ пов’язано не з мутаціями резистентності: незважаючи на стійкість вірусу до 3ТС, мутація M184V призводить до гіперчутливості ВІЛ до AZT (тобто повинна спостерігатися ефективність першої частини схеми: AZT/3TC), до Lpv/r також повинна бути збережена чутливість ВІЛ, оскільки стійкості вірусу до інгібіторів протеази (ІП) не виявлено взагалі. Дитина, скоріше за все, не отримувала призначену схему АРТ внаслідок низької прихильності батьків до її лікування. Змінювати схему терапії в даному випадку недоцільно.
У Київському міському центрі СНІДу із 6 зразків крові мутації резистентності ВІЛ до АРВ-препаратів виявлено лише в 1 зразку (табл. 5). У решти пацієнтів рівень ВН ВІЛ зріс унаслідок порушення ними режиму прийому АРТ.
Аналогічна ситуація щодо порушень режиму АРТ склалася з 2 пацієнтами Донецького обласного центру СНІДу з вірусологічною неефективністю терапії, у чиїх зразках крові не виявлено основних мутацій резистентності ВІЛ.
Загалом мутації резистентності ВІЛ стали причиною зростання рівня ВН ВІЛ у ВІЛ-інфікованих пацієнтів групи дослідження тільки у 8 (38,1 %) випадках із 21. У решти 13 (61,9 %) пацієнтів рівень ВН ВІЛ зріс унаслідок порушення ними режиму прийому терапії.
Висновки
1. Вперше в Україні проведено комплексне дослідження щодо виявлення частоти та характеру мутацій резистентності ВІЛ, асоційованих зі стійкістю до антиретровірусних препаратів, у пацієнтів, які отримують АРТ.
2. Виявлено вірусологічну неефективність антиретровірусної терапії у 5,92 % пацієнтів, які приймали АРВ-препарати впродовж 6 місяців, що могло бути ознакою формування стійкості вірусу до антиретровірусної терапії.
3. Встановлено, що серед факторів, які впливають на формування вірусологічної неефективності АРТ на ранніх строках лікування, одне з головних місць займає низький рівень прихильності ВІЛ-інфікованих пацієнтів до АРТ.
1. Бартлет Дж. Клинические аспекты ВИЧ-инфекции: Пер. с англ. / Бартлет Дж., Галант Дж. — М.: EnRus, 2007. — 557 c.
2. Хоффман К. Лечение ВИЧ-инфекции / Хоффман К., Рокштро Ю.К. — М., 2012. — 736 с.
3. Клінічний протокол антиретровірусної терапії ВІЛ-інфекції у дорослих та підлітків. Затверджений Наказом МОЗ України № 551 від 12.07.2010 р.
4. Wagner T.A. Clinical significance of HIV-1 Drug Resistance Mutations / T.A. Wagner, L.M. Frencel // Lab. Med. — 2006. — Vol. 37(9). — P. 554–561.
5. Castagna A. E-184V. Pilot study to evaluate immunological response to lamivudine monotherapy treatment interruption in failing HIV-1 infected subjects, harbouring the M184V mutation / A. Castagna, A. Danise, E. Carini [et al.] // 15th International Conference on AIDS, 2004, July 11–16. Abst. WeOrB 1286.
6. Clavel F. HIV drug resistance / Clavel F., Hance A. // N. Engl. J. Med. — 2004. — 350, № 10. — P. 1023–1035.
7. Paolucci S. NNRTI-selected mutations at codon 190 of human immunodeficiency virus type 1 reverse transcriptase decrease susceptibility to stavudine and zidovudine / Paolucci S., Baldanti F., Campanini G. [et al.] // Antiviral. Res. — 2007. — Vol. 76. — P. 99–103.
8. Nikolenko G.N. A Novel Molecular Mechanism of Dual Resistance to NRTIs and NNRTIs / G. Nikolenko, K. Delviks-Frankenberry, V. Pathak // J. Virol. — 2010. — Vol. 84. — P. 5238–5249.
9. Sluis-Cremer N. Mechanisms of inhibition of HIV replication by non-nucleoside reverse transcriptase inhibitors / N. Sluis-Cremer, G. Tachedjian // Virus Res. — 2008. — Vol. 134. — P. 147–156.
10. Hang J.Q. Substrate-dependent inhibition or stimulation of HIV RNase H activity by non-nucleoside reverse transcriptase inhibitors (NNRTIs) / Hang J.Q., Li Y., Yang Y. [et al.] // Biochem. Biophys. Res. Commun. — 2007. — Vol. 352. — P. 341–350.
11. Tachedjian G. Efavirenz enhances the proteolytic processing of an HIV-1 pol polyprotein precursor and reverse transcriptase homodimer formation / G. Tachedjian, K.L. Moore [et al.] // FEBS Lett. — 2005. — Vol. 579. — P. 379–384.

/41/41.jpg)
/42/42.jpg)
/43/43.jpg)