Международный неврологический журнал 1 (71) 2015
Вернуться к номеру
Кардиогенные инсульты. Клинико-патогенетические, терапевтические и профилактические особенности
Авторы: Григорова И.А., Тесленко О.А., Григоров С.Н. - Харьковский национальный медицинский университет
Рубрики: Неврология
Разделы: Справочник специалиста
Версия для печати
Украина занимает одно из первых мест в Европе по показателям заболеваемости острыми нарушениями мозгового кровообращения и смертности от инсульта, что создает большую нагрузку на систему здравоохранения, социального обеспечения, экономику и все общество. Современные достижения ангионеврологии свидетельствуют об этиологической гетерогенности ишемического инсульта. Поэтому на протяжении последних 20 лет совместными усилиями неврологов и кардиологов активно развивается кардионеврология как междисциплинарная область исследований. Именно ее достижения и совместное усовершенствование патогенетически обоснованного и метаболически адаптированного лечения и профилактики кардиогенных инсультов с использованием современных полифакторных препаратов дают возможность повлиять на течение и прогноз цереброваскулярных заболеваний.
Україна посідає одне з перших місць у Європі за показниками захворюваності на гострі порушення мозкового кровообігу та смертності від інсульту, що створює велике навантаження на систему охорони здоров’я, соціального забезпечення, економіку та все суспільство. Сучасні досягнення ангіоневрології свідчать про етіологічну гетерогенність ішемічного інсульту. Тому впродовж останніх 20 років спільними зусиллями неврологів і кардіологів активно розвивається кардіоневрологія як міждисциплінарна галузь досліджень. Саме її досягнення і сумісне удосконалення патогенетично обгрунтованого і метаболічно адаптованого лікування і профілактики кардіогенних інсультів із використанням сучасних поліфакторних препаратів дають можливість вплинути на перебіг і прогноз цереброваскулярних захворювань.
Ukraine is at one of the first places in Europe in terms of the incidence of acute cerebrovascular diseases and mortality from stroke, which creates a great burden on the health care system, social security system, economics and the entire society. Recent advances in angioneurology indicate etiological heterogeneity of ischemic stroke. Therefore, over the past 20 years, by the joint efforts of neurologists and cardiologists, cardioneurology as an interdisciplinary field of researches is actively developing. Its achievements and joint improvement of pathogenetically substantiated and metabolically adapted treatment and prevention of cardiogenic strokes, with the use of modern polyfactorial drugs, give an opportunity to influence the course and prognosis of cerebrovascular diseases.
кардиогенный инсульт, кардионеврология, терапия.
кардіогенний інсульт, кардіоневрологія, терапія.
cardiogenic stroke, cardioneurology, therapy.
Статья опубликована на с. 132-140
На протяжении последних десятилетий самая высокая доля в структуре заболеваемости приходится на сердечно–сосудистую патологию, обусловливающую прогрессирующее повышение летальности и инвалидизации среди населения разных возрастных групп. Инсульт, деменцию, эпилепсию и болезнь Паркинсона выделяют как наиболее значимые заболевания, которые определяют смертность и заболеваемость населения земного шара [1, 2]. К доинсультному образу жизни и труду возвращаются не более 6 % больных, примерно половина стойко утрачивают трудоспособность, поэтому инсульт является основной причиной долговременной физической, когнитивной, эмоциональной, социальной и трудовой инвалидности [3, 4].
В большинстве случаев сосудистое поражение головного мозга, так же как поражение сердца и сосудов другой локализации, является мультифакторным, обусловленным сочетанием ряда однотипных факторов риска. Церебральный инсульт чаще всего является последней точкой прогрессирования разных видов сердечно–сосудистой патологии. По данным литературы и нашему клиническому опыту, даже после тщательного обследования причину ишемического инсульта (ИИ) не удается установить в 40 % случаев. Более того, у многих пациентов имеются сочетанные заболевания, каждое из которых может быть причиной инсульта (например, стеноз сонной артерии и мерцательная аритмия у больного с эмболическим инсультом в системе сонной артерии). Взгляды на патогенез инсульта во взаимосвязи с кардиальной патологией формировались постепенно. Поэтому на протяжении последних 20 лет активно развивается кардионеврология как междисциплинарная область исследований [5].
Широко известно, что патогенез ИИ неразрывно связан с сердечной патологией, выявляющейся у большинства пациентов с цереброваскулярными заболеваниями. Так, у 90 % больных ИИ имеется артериальная гипертензия, разнообразную кардиальную патологию диагностируют у 75 % больных с ИИ [5]. Также стало очевидным, что отдельные заболевания сердца имеют более существенное значение в развитии нарушений кровоснабжения мозга. Именно современные достижения ангионеврологии свидетельствуют об этиологической гетерогенности ишемического инсульта. Внедрение во второй половине XX века в ангионеврологию кардиологических методов диагностики привело к тому, что существенно расширился перечень нозологических форм и конкретных видов кардиальных нарушений, сопряженных с эмболическими и гемодинамическими мозговыми осложнениями. Соответственно этому изменились представления о частоте кардиогенных церебральных расстройств. На сегодняшний день описано более 20 кардиальных источников церебральных эмболий, наиболее значимыми из которых являются неревматическая фибрилляция предсердий (ФП), приобретенные пороки сердца и постинфарктные изменения миокарда. Не менее актуальной проблемой остаются нарушения церебральной перфузии, составляющей основу гемодинамического инсульта [6].
Из семи разновидностей инсульта (атеротромботический, артерио–артериальный, кардиоэмболический, тромботический, лакунарный, гемодинамический и гемореологический) выделяют три основных патогенетических подтипа ИИ: атеротромботический, кардиоэмболический и лакунарный, среди которых существенно стал преобладать кардиоэмболический инсульт [7, 8].
Известно, что патофизиология острого инфаркта головного мозга и транзиторных ишемических атак определяется множеством неблагоприятных факторов. Среди них выделяют два наиболее важных, последовательно развивающихся процесса: 1) сосудистые (изменения эндотелия сосудов), гематологические (количество, состав и свойства крови), кардиологические (расстройства, ослабление насосной функции сердца) нарушения, которые вызывают начальный дефицит локального мозгового кровообращения и определяют развитие церебральной ишемии; 2) реакции последующего развития ишемического каскада, что ведет либо к восстановлению функции нейронов ишемизированной ткани при своевременном и адекватном лечении, либо к гибели клеток. Именно поэтому терапия острых церебральных ишемий должна базироваться на контроле за показателями состояния системы кровообращения (артериальное давление (АД), электрокардиограмма (ЭКГ), ультразвуковая диагностика), лабораторных тестов (показатели гликемии, липидов, водно–электролитного обмена и др.). Непременно необходимо учитывать этио–патогенетические механизмы подтипов ишемических инсультов, время от начала его развития, выявления его осложнений.
Выделяют 2 основных патогенетических механизма развития инсульта при патологии сердца, которые объединяют понятием «кардиогенные»: кардиоэмболический (при постоянных или пароксизмальных нарушениях ритма сердца) и гемодинамический. Кардиоэмболический инсульт происходит вследствие окклюзии церебрального сосуда фрагментом тромба или иного эмбологенного субстрата, образовавшегося в полостях сердца или на его клапанах. Гемодинамический инсульт может развиться у больного со стенозирующим поражением магистральных артерий головы при наличии состояний, приводящих к уменьшению сердечного выброса и минутного объема крови, таких как острый инфаркт миокарда или тяжелый приступ стенокардии, а также пароксизмы мерцательной тахиаритмии, нередко сопровождающейся значительными колебаниями уровня АД; нарушения проводимости, ведущие к брадиаритмии, и эпизоды «немой» транзиторной ишемии миокарда.
Частота кардиогенной эмболии, по данным исследований, проведенных в разных странах, колеблется от 17 до 38 % (рис. 1). В последние годы существенно стал преобладать кардиоэмболический инсульт [7, 9, 10]. Так, по критериям TOAST (Trail of ORG 10172 in Acute Stroke Treatment, Grau et al., 2001), среди этиологических факторов ишемического инсульта кардиогенные эмболии занимают 25,6 % инсультов [3, 4, 7, 10].
/133/133.jpg)
К источникам кардиогенной эмболии относят: левое и правое предсердия, митральный и аортальный клапаны, шунтирование из правых отделов сердца в левые (парадоксальные эмболии из венозной системы). По данным, систематизированным D.G. Sherman (1991), особенно высок риск развития кардиоэмболического инсульта у больных с инфекционным эндокардитом, кардиомиопатией, ревматическим стенозом митрального клапана с мерцательной аритмией, крупноочаговым инфарктом передней стенки левого желудочка. Однако указанные выше состояния отмечаются в популяции достаточно редко [4]. По существующим данным [10], примерно в половине случаев в анамнезе у больных с кардиоэмболическим инсультом имеется неклапанная фибрилляция предсердий, клапанные поражения сердца — в 25 %, сведения о пристеночных тромбах левого желудочка — почти в трети случаев; 60 % эмболов, исходящих из левого желудочка, ассоциируются с острым инфарктом миокарда [11]. В то же время мерцательная аритмия при хронических формах ишемической болезни сердца (ИБС), хотя и относится к заболеваниям с умеренным риском церебральной эмболии, выявляется у значительной части населения старшего возраста, и с ней связывают развитие около половины всех случаев кардиоэмболического инсульта.
Сердечные эмболы могут быть различной структуры. При мерцательной аритмии они преимущественно содержат фибрин, при пролапсе створки митрального клапана — преимущественно тромбоциты, при кальцинации митрального клапана — кальций, при опухоли — компоненты миксомы, а при инфекционном эндокардите — вегетации.
Достоверных, надежных и стандартизированных критериев диагностики эмболических транзиторных ишемических атак и ИИ не существует. Считают, что с наибольшей вероятностью ИИ вызван кардиоэмболией, если: 1) известен источник кардиоэмболии, в частности с высоким риском эмболии; 2) обнаружено эмболическое поражение других органов (сетчатки, почки) или ишемия возникла более чем в одном сосудистом бассейне; 3) нет клинических или инструментальных данных о признаках поражения магистральных артерий шеи; 4) отсутствуют сосудистые факторы риска [12]. Кроме того, данные современных клинических и инструментальных методов диагностики могут косвенно свидетельствовать об эмболической природе заболевания. Дифференциальная диагностика эмболического инфаркта мозга проводится с другими типами инфарктов, с первичным внутримозговым кровоизлиянием, осложненной формой мигрени, патологическими состояниями, сопровождающимися первичным судорожным синдромом, и функциональными нарушениями.
Многофакторный анализ Фремингемского исследования за 40–летний период (1948–1991) показал, что мерцательная аритмия является не только существенным фактором развития инсульта, но и инсульт при этом виде патологии по течению и исходам оказывается значительно более тяжелым. Исследователи в Копенгагене выявили компьютерно–томографические сходства у лиц с мерцательной аритмией: у них чаще развивается ишемический, чем геморрагический инсульт; инфаркт обычно более крупный и преимущественно кортикальный. Инсульт у лиц с мерцательной аритмией обычно более тяжелый, и восстановления нарушений функций чаще оказывается недостаточно (Lorgensen H.S., 1996) [4]. С неклапанной фибрилляцией предсердий связывают 15 % всех ишемических инсультов и 45 % всех кардиоэмболических инсультов. Ее распространенность среди населения значительно увеличивается с возрастом, составляя у лиц старше 65 лет 5–6 %, и она патогенетически чаще связана с ИБС. Мерцательная аритмия способствует стазу крови, возникающему вследствие утраты эффективной способности сокращения предсердий, развивается застой в полостях сердца, что наряду с нарушениями гемостаза создает предпосылки к внутрисердечному тромбообразованию, особенно в ушке левого предсердия. Риск возникновения инсульта существует как при постоянной, так и при пароксизмальной фибрилляции предсердий, хотя при постоянной форме он выше. Мерцательная аритмия при хронических формах ИБС, хотя и относится к заболеваниям с умеренным риском церебральной эмболии, выявляется у значительной части населения старшего возраста, и с ней связывают развитие около половины всех случаев кардиоэмболического инсульта [4, 10].
Инсульт является нередким осложнением острого инфаркта миокарда, особенно осложненного тромбозом левого желудочка, и развивается у 3–12 % этих больных [10, 12]. Риск развития инсульта высокий. Вероятность эмболии более высока в течение периода активного образования тромба в первые 1–3 месяца, хотя ее риск остается значительным даже вне острой фазы у пациентов с продолжающейся миокардиальной дисфункцией, сердечной недостаточностью или ФП. Так, пристеночные тромбы остаются эхокардиографически очевидными спустя год после инфаркта миокарда у трети пациентов, у которых он был диагностирован. Свежие пристеночные тромбы более рыхлые, и их тромбогенный потенциал выше. Повышение уровня фибриногена и симпатической активации при инфаркте миокарда способствует образованию тромбов в аорте и церебральных артериях. Застойная сердечная недостаточность и снижение сердечного выброса (менее 30 %) также увеличивают риск возникновения ишемического инсульта. По данным литературы, частота развития инсульта после инфаркта миокарда составляет от 1,8 до 10,9 % случаев. В целом наличие ИБС увеличивает риск развития инсульта в 2 раза, вероятность острого нарушения мозгового кровообращения становится еще более высокой при гипертрофии миокарда левого желудочка, особенно при развитии сердечной недостаточности [4, 12].
Инфекционный эндокардит также принадлежит к заболеваниям с высоким риском развития ИИ. В основе патогенетических механизмов лежит эмболия сосудов бактериальными клапанными вегетациями у 20 % больных. При врожденных пороках сердца механизм парадоксальной эмболии связан с наличием межпредсердного сообщения при врожденных пороках. Тромбы при этом формируются в венозной системе в правых отделах сердца и через дефекты перегородок попадают в левые отделы, аорту и сосуды мозга.
Особенно высок риск развития кардиоэмболического инсульта в молодом возрасте у больных с приобретенными пороками сердца вследствие инфекционного эндокардита, ревматизма, у больных с протезами сердечных клапанов. Патогенетическим механизмом при этом является повышение давления крови в левом предсердии, его дилатация, снижение сократительной способности и тромбоз, кальцификация митрального клапана. По литературным данным [10, 13, 14], пластика митрального клапана не устраняет риска тромбоэмболизма. Аортальные пороки осложняются инсультом значительно реже (в 4 % случаев).
Наиболее высоким риском развития кардиоэмболического ИИ среди приобретенных пороков обладает митральный стеноз (в 79 % случаев). Протезирование митральных клапанов сопровождается высоким риском развития церебральной эмболии. Это связывают с тромбозом протеза. Риск возникновения инсульта в большой мере зависит от вида протеза и материала, из которого он сделан (риск выше при механических протезах). Следует учитывать, что при наличии искусственных клапанов риск развития инфекционного эндокардита всегда высокий. Длительная антикоагулянтная терапия показана больным с любым видом протезов. При хирургических методах реваскуляризации миокарда (аортокоронарное шунтирование) риск возникновения ишемического инсульта небольшой и составляет 2 % [10].
При кардиомиопатиях риск развития инсульта высокий. Когда систолическая функция левого желудочка нарушена, сниженный ударный объем создает условия относительного стаза в полости левого желудочка. Это может активировать коагуляционный процесс и повышать риск тромбоэмболических событий. Причиной кардиомиопатии могут быть как ишемия или инфаркт вследствие пораженных коронарных артерий, так и неишемические процессы как результат генетических или приобретенных дефектов структуры клеток миокарда или его метаболизма. Хотя не установлена связь частоты инсульта со степенью тяжести сердечной недостаточности, однако обнаружено, что частота инсульта находится в обратной зависимости от величины фракции выброса [15, 16]. У пациентов с неишемической дилатационной кардиомиопатией частота появления инсульта такая же, как и при кардиомиопатии, вызванной ИБС. Патогенетическим механизмом является уменьшение сердечного выброса до 30 % и менее от нормы или наличие эхокардиографически (ЭхоКГ) верифицированного внутрисердечного тромба.
В клинической практике для диагностики ишемического кардиогенного инсульта следует остановиться на следующих моментах. Кардиогенный инсульт развивается внезапно (даже на протяжении нескольких секунд), без каких–либо предшественников в 90 % случаев. Начало развития инсульта в 70,3 % случаев происходит в дневное время на фоне обычной активности; в 20 % случаев — в утреннее время, но не сразу после сна; вечером или ночью — у 9 % больных. Характерно отсутствие постепенного нарастания очаговых симптомов в течение нескольких часов или суток. Максимальная выраженность неврологического дефицита характерна на момент возникновения симптомов. Возможно угнетение сознания, невыраженная головная боль. Транзиторные ишемические атаки или инсульт в анамнезе наблюдают у 20 % больных. В целом кардиальные эмболии, как правило, приводят к развитию завершенного инсульта, а не преходящего неврологического дефицита. При соматическом обследовании следует обратить внимание на наличие в анамнезе заболеваний сердца, которые позволяют допустить кардиоэмболический характер инсульта. По нашим данным, примерно 15 % больных не знают о наличии у них мерцательной аритмии. В таком случае следует ориентироваться на результаты соматического осмотра: «митральный румянец», пальцы в виде барабанных палочек, сердечная аритмия, шумы в области сердца, признаки застойной сердечной недостаточности.
Чаще (80 % случаев) в процесс вовлекается бассейн средней мозговой артерии (СМА), особенно у больных с неклапанной ФП. Ее закупорка может возникнуть на различных уровнях, что и обусловливает клиническую картину инфаркта в каждом конкретном случае заболевания. При этом инфаркты в левой СМА развиваются в 2 раза чаще. Клинически такие инфаркты проявляются грубыми двигательными нарушениями (в зависимости от распространенности) — гемиплегией или гемипарезом с синдромами коркового дефицита (афазия, анозогнозия, дефекты полей зрения). Наиболее частым вариантом поражения корковых ветвей является окклюзия передних ветвей (более 50 % поражений СМА). Поражение глубоких перфорирующих артерий с развитием стриатокапсулярных инфарктов или глубинных лакунарных инфарктов наблюдается редко. В вертебробазилярном бассейне инфаркты наблюдают в 10 % случаев. Эмболия мозговых сосудов кардиогенного происхождения характеризуется одновременным или последовательным возникновением инфарктов в различных артериальных бассейнах: в обеих СМА, в СМА и артериях мозжечка, задней мозговой артерии и артериях мозжечка. Для инсульта кардиогенного происхождения характерны наличие ранней реканализации интракраниального сосуда, в случае поздней реперфузии (более 6 часов от начала развития инфаркта) — развитие геморрагической трансформации инфаркта [12, 17, 18]. Геморрагическая трансформация инфаркта мозга является одним из характерных признаков кардиоэмболического инсульта, чаще всего она возникает в первые трое суток. Эмболия мозговых сосудов кардиогенного происхождения характеризуется быстрым регрессом очаговых симптомов, одновременным или последовательным возникновением инфарктов в различных артериальных бассейнах.
Клинические особенности развития кардиогенного инсульта заставляют врачей дифференцировать кардио–эмболический инсульт прежде всего с внутримозговым кровоизлиянием. Это позволяет сделать нейровизуализационные методы обследования — компьютерную и магнитно–резонансную томографию (КТ, МРТ) головного мозга. ЭКГ позволяет диагностировать фибрилляцию предсердий и инфаркт миокарда, явления желудочковой и предсердной аритмии, признаки расстройства реполяризации, трофики и другие признаки нарушения коронарного кровообращения. Эхокардиография считается ключевым методом для диагностики потенциального источника кардиогенной эмболии. Она позволяет визуализировать тромбы с использованием транскраниальной ЭхоКГ и чреспищеводной ЭхоКГ. Ее показатели позволяют оценить сократительную способность миокарда и состояние внутрисердечной гемодинамики, фракции выброса левого желудочка, которые являются важным критерием, определяющим степень риска развития инсульта. Это способствует выбору тактики превентивного лечения.
Необходимый современный критерий обследования больных с ИИ — показатели комплекса биохимических обследований. Острая ишемия головного мозга является сложным сочетанием патобиохимических процессов с четкой временной последовательностью включения патофизиологических механизмов. В течение первых 3 часов достигает максимума энергетический дефицит ткани мозга; в последующие 3 часа — глутаматная эк–сайтотоксичность, нарушение кальциевого гомеостаза и лактат–ацидоз. Отдаленные последствия ишемии, начинающиеся формироваться уже в течение первых 3 часов, достигают наивысшего уровня через 12–36 часов (оксидантный стресс и локальное воспаление) или на 2–е — 3–и сутки (апоптоз).
Церебральный ишемический каскад, развивающийся при инсульте очень быстро (за часы, минуты), а при хронической ишемии на фоне сердечно–сосудистой патологии — достаточно медленно (на протяжении месяцев, лет), все равно имеет общие патофизиологические механизмы, приводящие к функциональным и морфологическим повреждениям вещества мозга за счет снижения кровотока, нарушений нейронального энергетического метаболизма, гиперпродукции глутамата и свободных радикалов, депрессии нейротрансмиттерной активности.
В нашей многолетней работе комплексно обследовано 200 пациентов с острым нарушением мозгового кровообращения по ишемическому типу. В 41 % случаев (82 больных) от всего числа больных инсульты имели кардиогенный патогенетический механизм развития. Из них кардиоэмболический диагностировали у 65 (80 %) больных, гемодинамический — у 17 (20 %) больных с кардиогенным инсультом. Исследования проводили в острый период ишемического инсульта. Возраст обследованных варьировал от 33 до 82 лет. В результате проведенного исследования были установлены клинико–диагностические особенности кардиогенных инсультов, направленные на оптимизацию диагностических, прогностических и терапевтических мероприятий.
Анализ характера развития неврологической симптоматики показал, что практически у всех больных (99,3 %) наблюдали внезапное развитие инсульта без каких–либо предшественников, чаще на фоне психоэмоциональной или физической нагрузки в предутренние часы. В клинической картине очаговые симптомы возникали внезапно и сочетались с общемозговыми симптомами. Очаговые неврологические симптомы были максимально выраженными в момент развития инсульта, а постепенного нарастания неврологического дефицита не наблюдали. У 12 % пациентов в анамнезе до начала заболевания отмечали однократные и повторные транзиторные ишемические атаки, симптоматика которых соответствовала определенному сосудистому бассейну и его латерализации. В анамнезе более половины больных отмечали признаки неоднократного предшествующего лакунарного инсульта с различными очаговыми преходящими симптомами.
Наиболее частым механизмом развития кардиогенных инсультов была кардиогенная эмболия. Ее причинами являлись неклапанная фибрилляция предсердий, ревматическое поражение сердечных клапанов, перенесенный инфаркт миокарда, кардиомиопатия. Нарушение сердечного ритма в виде ФП наблюдали у большинства больных, при этом этиологическим фактором ФП предсердия были ИБС, ревмокардит, постинфарктный кардиосклероз, кардиомиопатия. У 32 % больных перед развитием ИИ выявляли нарушение сердечного ритма, а у 25 % — учащение приступов стенокардии. При этом около 40 % пациентов не знали о существовании у них аритмии. Цифры АД были в пределах нормы у 68 % больных или повышались до 160/90–220/120 мм рт.ст. (у 32 % больных). На ЭКГ у больных (89,7 %) выявлены явления желудочковой и предсердной аритмии, признаки расстройства реполяризации, трофики и другие признаки нарушения коронарного кровообращения. При этом наиболее постоянными ЭКГ признаками были: депрессия сегмента ST с одновременным увеличением сегмента Q–ST. По данным ультразвукового сканирования экстракраниальных отделов магистральных отделов головного мозга только у 18 % больных обнаруживали морфологически нестабильную атеросклеротическую бляшку. По данным эхокардиографии у более чем 2/3 пациентов с кардиогенным инсультом диагностировано облигатное наличие подклапанных тромбов и потенциальных кардиогенных источников эмболии. Консультантом–кардиологом у всех пациентов диагностированы заболевания сердца со значительным преобладанием в структуре (57 %) фибрилляций предсердий. По данным литературы, аритмия является проявлением именно сердечной патологии, а не следствием острого нарушения мозгового кровообращения [19]. Гемодинамический инсульт развивался у больных при верифицированных стенозирующих поражениях магистральных артерий головы на фоне пароксизмов мерцательной тахиаритмии, которая сопровождалась значительными колебаниями уровня АД, в трех случаях — на фоне «немой» транзиторной ишемии миокарда.
Инфаркты мозга чаще всего локализовались в бассейне СМА (84 %), при этом левая СМА вовлекалась в патологический процесс в 1,7 раза чаще. Типичным и преобладающим вариантом было развитие инфаркта на территории кровоснабжения корковых ветвей СМА (56 %), у 17 % наблюдали тотальные инфаркты в бассейне СМА, глубокие стриатокапсулярные инфаркты развиваются значительно реже (11 %). При развитии инсульта в вертебробазилярном бассейне (12 % случаев) локализация инфарктов отличалась значительным полиморфизмом и клиническая симптоматика не всегда укладывалась в классические синдромы. У 11 % больных с кардиоэмболическим инсультом наблюдали геморрагическую трансформацию инфаркта мозга. Развитие геморрагической трансформации ухудшало течение и прогноз заболевания. Одной из особенностей кардиоэмболического инсульта было одновременное поражение различных сосудистых бассейнов — сосуды вертебробазилярного бассейна и СМА или в обеих СМА. Такие многоочаговые поражения наблюдали у 4 % больных, они являются следствием множественной эмболии.
Изучение отдельных звеньев биохимических нарушений позволило нам выделить некоторые особенности дисметаболизма кардиогенного инсульта. Выявленные нарушения позволяют в стратегию лечения и профилактики кардиогенных инсультов добавить ряд препаратов, непосредственное действие которых направлено на их коррекцию.
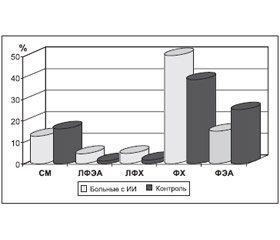
Еще в середине 80–х годов прошлого века было показано, что в условиях гипоксии первыми поражаются биологические мембраны. Это требует проведения мероприятий для восстановления их целостности и обеспечения восстановления функции нейрона, межнейрональных взаимодействий и мозга в целом. Результаты процентного содержания фракций фосфолипидных мембран эритроцитов (сфингомиелина (СМ), лизофосфатидилэтаноламида (ЛФЭА), лизофосфатидилхолина (ЛФХ), фосфатидилхолина (ФХ), фосфатидилэтаноламина (ФЭА)) у больных с кардиогенным инсультом по сравнению с контрольной группой представлены на рис. 2. Наибольшие изменения проявлялись в увеличении их лизоформ, таких как ЛФЭА и ЛФХ.
/137/137.jpg)
Нарушение процентного содержание фосфолипидов мембран свидетельствуют об истощении антиоксидантной системы организма и развившейся мембранной патологии, проявившейся в изменении состава фосфолипидов эритроцитарных мембран, связанных с изменением биомембранной проницаемости с последующим нарушением клеточных функций в результате окислительного стресса у больных.
Проведенные исследования содержания аминокислот выявили наличие дисбаланса между возбуждающими и тормозными нейромедиаторными аминокислотами. Независимо от заболевания сердца наблюдали общие закономерности, которые состояли в тенденции к снижению возбуждающих аминокислот — глутамата и аспартата, что сопровождалось повышением –аминомасляной кислоты (ГАМК). Во все периоды наблюдения отмечено снижение коэффициента глутамат/ГАМК, что свидетельствует о преобладании в организме тормозной аминокислоты ГАМК по сравнению с возбуждающими (преимущественно глутамат). У больных ишемическим кардиогенным инсультом наличие дисбаланса между тормозными и возбуждающими нейромедиаторами отображает степень тяжести клинических проявлений инсульта.
Связь повышенного уровня холестерина и кардио–генного инсульта, по–видимому, опосредована через развитие стенозирующего процесса в магистральных и крупных внутримозговых артериях, а также с развитием атеросклероза коронарных артерий, приводящего к ИБС.
Нами предложен способ оценки риска развития тромботических осложнений при ишемическом инсульте головного мозга. Он основан на определении липидов и липопротеидов различных классов в плазме крови и сравнении полученных показателей с нормой [20]. Исследование проводится в 2 этапа. Первый этап — определение общего холестерина (ОХ), холестерина липопротеидов низкой плотности (ХС ЛПНП), холестерина липопротеидов высокой плотности (ХС ЛПВП), триглицеридов (ТГ) и коэффициента атерогенности (КА). Второй этап — интерпретация показателей: повышение уровня ОХ на 24 % и более, ХС ЛПНП — на 70 % и более, КА — на 150 % и более при одновременном снижении ТГ на 60 % и ниже, ХС ЛПВП — на 70 % и ниже, холестерина липопротеидов очень низкой плотности (ХС ЛПОНП) на 60 % и ниже; у больных ишемическим инсультом головного мозга наблюдают развитие тромботических осложнений, причем ХС ЛПОНП определяют по формуле: ХС ЛПОНП = ТГ / 5; КА = (ХС ЛПНП + + ХС ЛПОНП) / ХС ЛПВП.
Сравнение изменений содержания липидов, холестерина, липопротеидов и КА (в %) у больных с ИИ головного мозга с тромботическими осложнениями и у больных с церебральным ИИ без тромботических осложнений по сравнению с контрольной группой представлено в табл. 1.
Полученная характеристика изменений липидов и липопротеидов в плазме крови у больных с ИИ высокоинформативна и может быть использована в качестве надежного метода определения риска развития тромботических осложнений. Помимо этого, определение комплекса липидов и содержания ХС липопротеидов различных классов имеет важное лечебно–профилактическое значение, так как включение вышеописанного метода исследования в комплекс традиционных пара–клинических исследований больных с церебральным ИИ позволит существенно улучшить диагностику риска развития тромбогенных осложнений и их предотвратить.
Для первичной и вторичной профилактики кардиогенных ишемических инсультов является необходимым курсовое назначение статинов. По нашим данным и данным других исследователей, наиболее неблагоприятны для прогрессирования атеросклероза высокие уровни липопротеидов низкой плотности. Поэтому прием статинов (липримар, статези) является патогенетически обоснованным. Комплексный современный препарат кадуэт (аторвастатин + амлодипин) можно активно использовать при наличии артериальной гипертензии.
Общая стратегия лечения кардиоэмболического инсульта в острый период развития заболевания имеет те же направления, что и при всех подтипах ИИ: 1) реперфузионная терапия, направленная на восстановление сосудистого русла; 2) нормализация сердечной деятельности и параметров гемостаза (поддержание синусового ритма — профилактика пароксизмов фибрилляции предсердий; поддержание нормальной частоты сердечных сокращений при постоянной фибрилляции предсердий; лечение сердечной недостаточности); 3) нейропротекция; 4) восстановительная терапия. К особенностям лечения гемодинамического инсульта следует отнести следующие мероприятия: 1) неотложная нормализация системной гемодинамики: общего периферического сопротивления (препараты вазопрессорного действия), минутного объема сердца (препараты с положительным инотропным действием, антиаритмическая терапия и др.), объема циркулирующей крови (низкомолекулярные декстраны и др.); 2) гемангиокоррекция; 3) нейропротекция; 4) медикаментозный тромболизис; 5) прямые антикоагулянты (стандартный гепарин, низкомолекулярные гепарины). Невзирая на доказанную эффективность в крупных многоцентровых исследованиях, тромболизис применяется в странах Европы лишь у 1–7 % больных с ИИ, что связано с жесткими критериями отбора больных для проведения этого метода лечения. Назначение прямых антикоагулянтов остается актуальным в терапии больных с кардиоэмболическим инсультом, особенно с высоким риском повторной эмболизации. В рандомизированных исследованиях показана их достоверная эффективность по предотвращению тромбоза глубоких вен и повторных эмболий. Однако установлено также увеличение риска развития геморрагической трансформации и кровоизлияния в эмболический инфаркт, что ухудшает течение инсульта. Риск возникновения геморрагических осложнений при назначении гепаринов является дозозависимым. Таким образом, прямые антикоагулянты рекомендованы больным с кардиоэмболическим инсультом не ранее 48 часов после развития инсульта и после проведения КТ, МРТ головного мозга в низких дозах (стандартный гепарин, низкомолекулярный гепарин).
Итоги многочисленных контролируемых профилактических исследований показали, что назначение больным с нарушением ритма сердца антикоагулянтов непрямого действия (варфарин) или антиагрегантов (аспирин) существенно уменьшает (на 60–70 %) у них риск развития кардиоэмболического инсульта [10]. Причем у лиц с высоким риском церебральной эмболии целесообразнее назначение антикоагулянтов, а лицам с умеренным риском назначают антиагреганты. Таким образом, данное направление предупреждения инсульта является одним из важнейших наряду с контролем артериальной гипертензии в работе врача общей практики. Следует учитывать, что примерно у 20 % больных с кардиоэмболическим инсультом происходит спонтанная геморрагическая трансформация инфаркта мозга. Опасность особенно велика в первые 48 часов развития инсульта, при больших размерах инфаркта и при сопутствующей артериальной гипертензии. Поэтому перед профилактическим назначением антикоагулянтов больным с кардиоэмболическим инсультом необходимо проведение КТ головного мозга, желательно в срок от 36 до 48 часов с момента развития заболевания, поскольку около 85 % всех случаев геморрагической трансформации инфарктов мозга происходит именно в этот период. Антикоагулянты безопаснее назначать с 10–14–го дня развития этого подтипа ишемического инсульта.
И все же с учетом определенных ограничений прямой антикоагулянтной терапии при лечении кардиогенных инсультов использование цитопротекторных препаратов является важнейшим направлением. Назначение препаратов нейропротекторного и нейротрофического действия (цераксон, кортексин, тиоцетам), нейромодуляторов (глицин, семакс), корректоров энергетического метаболизма (актовегин, мексидол, тиотриазолин) продолжает быть целесообразным. По–видимому, в связи с разнообразными механизмами, участвующими в ишемическом повреждении, ни одно лекарственное средство не может обеспечить полную нейропротекцию. Накопленный нами клинический опыт показывает, что одним из оптимальных приемов терапии неврологического дефицита при острой церебральной ишемии является сочетание полифакторных препаратов с метаболическим, нейромодуляторным эффектом — актовегина и цитиколина (цераксона).
Начиная с 1980 года проведено множество клинических исследований применения цитиколина при инсультах. Он является единственным нейропротекторным средством, в отношении которого был продемонстрирован частичный положительный результат во всех отдельно взятых рандомизированных двойных слепых испытаниях, а также терапевтическая эффективность при проведении метаанализа с предварительно установленной первичной конечной точкой. Цитиколин способствует процессам нейропластичности и вносит вклад в восстановление сенсомоторной функции после инсульта в экспериментах. Установлены его преимущественные эффекты: прямая репарация нейрональных мембран; уменьшение дегенерации свободных жирных кислот; восстановление поврежденных холинергических нейронов за счет интенсификации производства ацетилхолина; способность ингибировать глутаматиндуцированный апоптоз и усиливать механизмы нейропластичности как фундаментального биологического процесса, направленного на различные патофизиологические механизмы повреждения. Цитиколин продемонстрировал способность восстанавливать постишемические уровни сфингомиелина и кардиолипина — фосфолипидного компонента внутренней митохондриальной мембраны, а его продолжительный прием обеспечивает возрастание концентраций фосфатидилхолина, фосфатидил–этаноламина и фосфатидилсерина — трех основных фосфолипидов в клеточной мембране.
В наших терапевтических мероприятиях у больных с кардиогенными инсультами цитиколин (цераксон) также продемонстрировал свою высокую эффективность, особенно при назначении его в первые 24 часа с момента появления симптоматики инсульта. Наиболее выраженный терапевтический эффект отмечали при приеме цераксона в дозе 1000–2000 мг/сут. Это выражалось в улучшении общего состояния больного и способствовало раннему восстановлению двигательной и когнитивной функции. При средней и тяжелой степени тяжести ИИ увеличивалась возможность полного восстановления неврологического дефицита в 3–месячный срок.
Актовегин пользуется широкой популярностью не только в неврологии, но и в клинической практике в целом в силу трех основных достоинств: широта клинико–фармакологического спектра действия, эффективность, безопасность. Актовегин — современный нейропротектор, обладающий полифакторным воздействием: увеличивает транспорт глюкозы и кислорода в клетки; активирует антиоксидантный фермент супероксиддисмутазу; тормозит перекисное окисление липидов; стабилизирует мембраны клеток; предотвращает развитие ацидоза; улучшает обмен нейромедиаторов благодаря содержанию Mg; активирует местный фибринолиз, уменьшает вязкость крови. Таким образом, актовегин действует как своеобразный универсальный биоэнергостабилизатор клеточного (в первую очередь нейронального) метаболизма. В этом заключается принципиальное отличие его действия от такового прочих ноотропных и вазотропных средств, влияющих, как правило, на какое–то конкретное звено энергообеспечения клетки или несколько звеньев, но не на весь этот процесс в целом. Эффективность применения высоких доз актовегина 10–20% (во флаконах) по 1000–2000 мг/сут в/в капельно в остром периоде инсульта, в том числе и у пациентов с тяжелым течением заболевания, показана в наших и других исследованиях. Причем более раннее начало лечения (до 6 ч от появления первых симптомов) позволяло в 2 раза снизить летальность при сравнении с отсроченным началом терапии (более суток от момента инсульта). Цераксон и актовегин хорошо переносятся пациентами, поэтому являются реальными препаратами выбора для применения в составе комбинированной терапии кардиогенного ишемического инсульта.
Роль врача общей практики на всех этапах профилактики и лечения инсульта, невролога и кардиолога изменяется и расширяется по мере появления новых концепций профилактики и лечения инсульта. Благодаря значительным успехам в понимании патогенеза инсульта, внедрению новых неинвазивных методов диагностики возможно определение эффективных методов лечения. Наука об инсульте заняла лидирующее положение мультидисциплинарной специальности. Именно ее достижения в виде совместного усовершенствования патогенетически обоснованной и метаболически адаптированной терапии, профилактики кардиогенных инсультов с использованием современных полифакторных препаратов дают возможность повлиять на течение и прогноз цереброваскулярных заболеваний в Украине.
1. Сосудистые заболевания головного мозга / З.А. Суслина, Ю.Я. Варакин, Н.В. Верещагин. — М.: Медпресс–информ, 2009. — 352 с.
2. Lloyd–Jones D., Adams R.J., Brown T.M. et al. Heart disease and stroke statistics–2010 update: a report from the American Heart Association // Circulation. — 2010. — № 121. — Р. 46–215.
3. Сучасні принципи діагностики та лікування хворих із гострими порушеннями мозкового кровообігу. Методичні рекомендації / Ю.П. Зозуля, П.В. Волошин, Т.С. Міщенко, Л.А. Дзяк та ін. — К., 2005. — 66 с.
4. Сосудистые заболевания головного мозга: Эпидемиология. Основы профилактики / З.А. Суслина, Ю.Я. Варакин, Н.В. Верещагин. — М.: Медпресс–информ, 2006. — 256 с.
5. Практическая кардионеврология / З.А. Суслина, А.В. Фонякин А.В. — М.: ИМА–ПРЕСС, 2010. — 304 с.
6. Суслина З.А., Фонякин А.В., Пирадов М.А. Современное состояние и перспективы кардионеврологии // Анналы клинической и экспериментальной неврологии. — 2009. — № 1. — С. 51–57.
7. Суслина З.А. Ишемический инсульт: сосуды, сердце, кровь // Журнал неврологии и психиатрии им. С.С. Корсакова. — 2007. — С. 250–259.
8. Doufekias E., Segal A., Kizer J. Cardiogenic and aortogenic brain embolism // J. Am. Cardiol. — 2008. — Vol. 51. — P. 1049–59.
9. Фонякин А.В. Современная концепция кардионеврологии // Практична ангіологія. — 2006. — № 2(3). — С. 31–35.
10. A Statement for Healthcare Professionals From the American Heart Association/American Stroke Association Council on Stroke: Co–Sponsored by the Council on Cardiovascular Radiology and Intervention: The American Academy of Neurology affirms the value of this guideline // Stroke. — 2006. — № 37. — Р. 577–617.
11. Cardiogenic brain embolism: the second report of the Cerebral Embolism Task Force // Arch. Neurol. — 1989. — № 46. — Р. 727–743.
12. Виберс Д., Фейгин В., Браун Р. Инсульт. Клиническое руководство: Пер. с англ. — 2–е изд., испр. и дополн. — М.: БИНОМ; СПб.: Диалект, 2005. — 608 с.
13. Deverall P.B., Olley P.M., Smith D.R., Watson D.A., Whitaker W. Incidence of systemic embolism before and after mitral valvotomy // Thorax. — 1968. — № 23. — Р. 530–536. Abstract/FREE Full Text.
14. Coulshed N., Epstein E.J., McKendrick C.S., Galloway R.W., Walker E. Systemic embolism in mitral valve disease // Br. Heart J. — 1970. — № 32. — Р. 26–34.
15. Pfeffer M.A., Braunwald E., Moye L.A., Basta L., Brown E.J. Jr, Cuddy T.E., Davis B.R., Geltman E.M., Goldman S., Flaker G.C. et al. Effect of captopril on mortality and morbidity in patients with left ventricular dysfunction after myocardial infarction: results of the survival and ventricular enlargement trial: the SAVE Investigators // N. Engl. J. Med. — 1992. — № 327. — Р. 669–677. Medline.
16. Loh E., Sutton M.S., Wun C.C., Rouleau J.L., Flaker G.C., Gottlieb S.S., Lamas G.A., Moye L.A., Goldhaber S.Z., Pfeffer M.A. Ventricular dysfunction and the risk of stroke after myocardial infarction // N. Engl. J. Med. — 1997. — № 336. — Р. 251–257.
17. Григорова І.А. Системне вивчення атерогенезу і патогенетичних механізмів ішемічного інсульту головного мозку: Автореф. дис… на здобуття наукового ступеня доктора медичних наук. — Харків, 1997. — 33 с.
18. Віничук С.М., Прокопів М.М. Гострий ішемічний інсульт. — К.: Наукова думка, 2006. — 286 с.
19. Henriques I.L., Barata S., Gondar P. et al. Stroke as first as manifestation of cardiac disease // Cerebrovasc. Dis. — 2008. — Vol. 13(Suppl. 3). — P. 34–44.
20. Пат. 8279А Україна. Спосіб оцінки риску розвитку тромботичних ускладнень при ішемічному інсульті головного мозку / І.А. Григорова, О.А. Броше, А.А. Баленко; Патент на винахід, виданий Державним патентним відомством України 29 березня 1996 року. Бюлетень ВАК № 1, 29.03.96.

/138/138.jpg)