Журнал «» 5 (31) 2013
Вернуться к номеру
Генетичні аспекти артеріальної гіпертензії у хворих на ішемічну хворобу серця
Авторы: Целуйко В.Й., Яковлева Л.М. - Харківська медична академія післядипломної освіти
Рубрики: Семейная медицина/Терапия, Кардиология
Разделы: Клинические исследования
Версия для печати
Метою дослідження було вивчення генетичних факторів, пов’язаних із розвитком артеріальної гіпертензії (АГ) у хворих на ішемічну хворобу серця (ІХС) мешканців Харківської області.
Обстежено 120 хворих на ІХС, із них 25 — без АГ (І група) та 95 — із АГ (ІІ група). Групу контролю становили 35 здорових осіб. Дослідження алельного поліморфізму Т-786С промотора гена ендотеліальної NO-синтази (еNOs), інсерційно-делеційного (I/D) поліморфізму гена ангіотензинперетворюючого ферменту (АПФ) та поліморфізму А1166С гена рецептора ангіотензину-2 типу 1 (АT2R1) проводили методом полімеразної ланцюгової реакції з електрофоретичною схемою детекції результату.
Виявлений позитивний зв’язок між наявністю СС-генотипу поліморфізму Т-786С промотора гена еNOs, D-алелі поліморфного сайту I/D гена АПФ та підвищеною вірогідністю розвитку АГ у хворих на ІХС мешканців Харківської області. При порівняльному аналізі розподілу частот алелей і генотипів поліморфізму А1166С гена АT2R1 в групах обстежених хворих і в групі контролю статистично вірогідних відмінностей не встановлено.
Целью исследования было изучение генетических факторов, связанных с развитием артериальной гипертензии (АГ) у больных ишемической болезнью сердца (ИБС) жителей Харьковской области.
Обследованы 120 больных ИБС, из них 25 — без АГ (І группа) и 95 — с АГ (ІІ группа). Группу контроля составили 35 здоровых человек. Исследование аллельного полиморфизма Т-786С промотора гена эндотелиальной NO-синтазы (еNOs), инсерционно-делеционного (I/D) полиморфизма гена ангиотензинпревращающего фермента (АПФ) и полиморфизма А1166С гена рецептора ангиотензина-2 типа 1 (АT2R1) проводили методом полимеразной цепной реакции с электрофоретической схемой детекции результата.
Обнаружена положительная связь между наличием СС-генотипа полиморфизма Т-786С гена еNOS, D-аллели полиморфного сайта I/D гена АПФ и повышенной вероятностью развития АГ у больных ИБС жителей Харьковской области. При сравнительном анализе распределения частот аллелей и генотипов полиморфизма А1166С гена АT2R1 в группах обследованных больных и в группе контроля статистически достоверных различий не установлено.
The aim of the study was to investigate the genetic factors associated with the development of arterial hypertension (AH) in patients with coronary heart disease (CHD), residents of Kharkiv region.
120 patients with coronary artery disease, 25 of them — without AH (I group) and 95 — with AH (II group) were examined. The control group included 35 healthy persons. Study of the allelic polymorphisms T-786C of endothelial NO-synthase (eNOS) promoter gene, insertion-deletion (I/D) polymorphism of the angiotensin-converting enzyme (ACE) gene and polymorphism A1166C of angiotensin 2 receptor type 1 gene (AT2R1) was carried out by polymerase chain reaction with electrophoresis pattern of results detection.
There was found positive association between the CC-genotype of T-786C eNOS gene polymorphism, D-allele of I/D polymorphic site of ACE gene and increased likelihood of AH development among patients with CHD, residents of Kharkiv region. Comparative analysis didn’t reveal statistically significant differences in the distribution of allele and genotype frequencies of gene AT2R1 polymorphism A1166S for groups of examined patients and in control group.
артеріальна гіпертензія, генетичний поліморфізм.
артериальная гипертензия, генетический полиморфизм.
arterial hypertension, genetic polymorphism.
У численних епідеміологічних та рандомізованих клінічних дослідженнях доведено, що артеріальна гіпертензія (АГ) є незалежним та одним із найбільш потужних факторів ризику (ФР) розвитку багатьох серцевосудинних захворювань (ССЗ), у тому числі ішемічної хвороби серця (ІХС), і призводить до таких грізних ускладнень, як порушення мозкового кровообігу (ПМК) та інфаркт міокарда (ІМ) [3].
Сьогодні накопичено багато даних, які вказують на те, що генетичні чинники можуть відігравати суттєву роль у розвитку АГ [4, 8]. У той самий час спроби пов’язати розвиток АГ із мутацією унікального гена або декількох генів не були успішними. Доведено, що успадкуванню АГ притаманний ряд особливостей, що підтверджують його полігенний характер [1, 8]. Саме тому в останні роки значна кількість досліджень присвячена пошуку так званих генівкандидатів, продукти експресії яких (фермент, рецептор, структурний або транспортний білок) можуть модулювати внесок тієї чи іншої ланки патогенезу і прямо або опосередковано впливати на розвиток АГ та клінічні прояви патогенетично пов’язаних із нею ССЗ.
У багатьох дослідженнях доведено, що розбіжності у розподілі генотипів можуть суттєво коливатися у різних етнічних групах, тому асоціація тих або інших поліморфних маркерів із розвитком АГ не завжди збігається в різних популяціях, що робить дослідження для кожної етнічної та популяційної групи значущими [14].
Мета дослідження: вивчити генетичні фактори, пов’язані з розвитком АГ у хворих на ІХС мешканців Харківської області.
Матеріали та методи дослідження
Обстежено 120 хворих на ІХС, які перебували на лікуванні в Харківській міській клінічній лікарні № 8. Критеріями включення до дослідження були стабільна стенокардія напруження ІІ–ІІІ функціональних класів за класифікацією Канадського серцевосудинного суспільства (1974) та наявність гемодинамічно значимих стенозів коронарних артерій (КА) за даними селективної коронарної ангіографії (СКВГ). Критеріями виключення були хронічна серцева недостатність (ХСН) більш ніж ІІА стадії за класифікацією В.Х. Василенка та М.Д. Стражеска. До дослідження не включали осіб, вік яких був меншим за 45 років, хворих із тяжкою супутньою патологією (онкологічні захворювання, хронічна ниркова недостатність ІІ стадії, тяжкий перебіг цукрового діабету ІІ типу (ЦД) та інші).
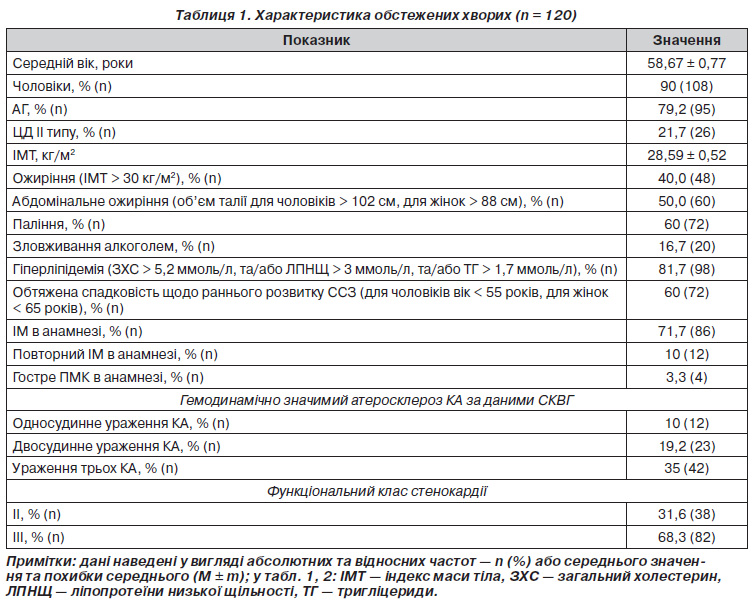
Клінікоанамнестична характеристика обстежених хворих наведена в табл. 1. У 95 (79,2 %) обстежених була діагностована АГ.
Групу контролю становили 35 осіб (середній вік 57,7 ± 2,2 року), які не мали в анамнезі АГ та в яких під час обстеження з різних причин результат навантажувального тесту був негативним, при проведенні СКВГ не було виявлено атеросклеротичних та морфологічних змін КА.
Дослідження алельного поліморфізму Т786С промотора гена ендотеліальної NOсинтази (еNOs), інсерційноделеційного поліморфізму гена ангіотензинперетворюючого ферменту (АПФ) та поліморфізму А1166С гена рецептора ангіотензину2 типу 1 (АT2R1) проводили методом полімеразної ланцюгової реакції (ПЛР) з електрофоретичною схемою детекції результату з використанням наборів реактивів «SNPЭкспресс» виробництва ООО НПФ «Литех» (Росія). Виділення ДНК із букального епітелію здійснювали за допомогою реагента «ДНКЭкспресс» виробництва ООО НПФ «Литех» (Росія) за інструкцією. Правильність розподілу частот генотипів визначалася за відповідністю рівноваги Харді — Вайнберга (pi2 + 2pipj + pj2 = 1). Відповідно до Гельсінської декларації всі пацієнти були поінформовані про проведення клінічного дослідження і дали згоду на визначення поліморфізму досліджуваних генів.
Статистична обробка отриманих даних проведена за допомогою пакета статистичних програм Statistica 8.0 (StatSoft Inc., США), Microsoft Office Exсel2003. Для порівняння розподілу частот алелей та генотипів між групами використовували критерії Х2 Пірсона. Відносний ризик (RR — Relative Risk) розраховували за формулою:
RR = (a/c)/(b/d),
де a — кількість хворих на ІХС з АГ із наявністю та b — відсутністю даної алелі або генотипу, c та d — кількість хворих на ІХС без АГ із наявністю та відсутністю даної алелі або генотипу.
При RR = 1 асоціації немає, RR > 1 розглядали як позитивну асоціацію з алеллю або генотипом, RR < 1 — як негативну асоціацію. Для всіх видів аналізу статистично значимими вважали р < 0,05.
Результати та обговорення
З метою дослідження зв’язку поліморфізму генів, що вивчалися, з розвитком АГ у хворих на ІХС обстежені нами хворі були розподілені на дві групи (табл. 2). До І групи увійшли 25 (20,8 %) хворих на ІХС без АГ в анамнезі, ІІ групу становили 95 (79,1 %) осіб із АГ. У 86 (80,5 %) осіб ІІ групи була діагностована гіпертонічна хвороба ІІІ стадії, у 9 (9,5 %) — ІІ стадії.
Поліморфізм T786C (rs2070744) у промоторній ділянці гена — найбільш важливий для регулювання експресії гена eNOS [2]. В експериментальних дослідженнях доведено, що у носіїв Салелі відбувається зниження експресії гена eNOs і, як наслідок, зменшення продукції оксиду азоту, що відіграє значну роль у регуляції судинного тонусу, кровообігу та артеріального тиску [13]. У метааналізі, що узагальнив результати генотипування поліморфізму Т786С промотора гена еNOs більше ніж в 11 тисяч осіб в європейській популяції, доведено суттєве зростання ризику розвитку АГ за наявності Cалелі [11, 12].
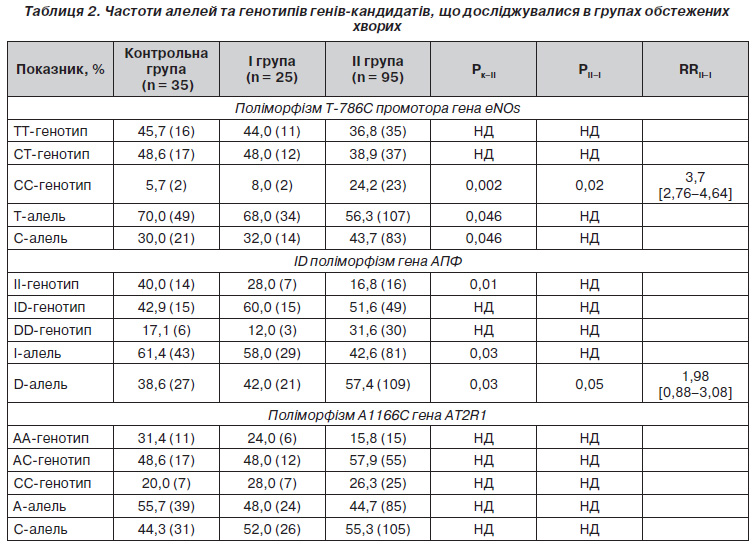
При генотипуванні поліморфізму Т786С промотора гена еNOs у контрольній групі встановлено таке співвідношення гомозигот ТТ, гетерозигот ТС і патологічних гомозигот СС: 45,7; 48,6 та 5,7 % відповідно. В українській популяції співвідношення ТТ, ТС і ССгенотипів суттєво не відрізняється і становить 48,2; 45,8 та 6,0 % відповідно [2]. Співвідношення ТТ, СТ та ССгенотипів у І групі обстежених хворих становило 44,0; 48,0 та 8,0 %, у ІІ групі — 36,8; 38,9 та 24,2 % відповідно.
Аналіз поліморфізму Т786С промотора гена еNOs виявив, що у ІІ групі хворих частота патологічного CC генотипу була вищою, ніж у групі контролю (24,2 % проти 5,7 %, Х2 = 5,63, р = 0,002) та в І групі (24,2 % проти 8,0 %, Х2 = 3,17, p = 0,02). Розраховані значення відносного ризику (RRІІ–І = 3,7 [2,76–4,64]) свідчать про наявність позитивної асоціації СС генотипу з вірогідністю розвитку АГ.
У хворих ІІ групи зустрічальність Талелі була меншою, ніж у групі контролю (56,3 %, проти 70,0 %, Х2 = 3,99, p = 0,046), а мутантної Салелі — більшою (43,8 % проти 30,0 %, Х2 = 3,99, p = 0,046). Однак у нашому дослідженні не отримано вірогідної різниці між частотою Т та Салелей у І та ІІ групах, що не дозволяє розглядати їх як фактор опірності та фактор ризику щодо розвитку АГ у хворих на ІХС.
Серед великої кількості відомих мутацій гена АПФ найбільш впливовою щодо змін активності ферменту АПФ є наявність інерції (І) або делеції (D) фрагмента з 287 нуклеотидів у 16му інтроні гена. Цей поліморфізм не обумовлює структурних змін АПФ, але впливає на ступінь експресії гена [9]. У клінічних дослідженнях доведено, що в осіб із DDгенотипом рівень АПФ у крові вдвічі вищій, ніж у II гомозигот, а у гетерозигот рівень ферменту має проміжне значення [5, 10].
Натепер накопичено багато даних щодо асоціації зазначеного поліморфізму гена АПФ із розвитком АГ [1, 4, 8]. Так, наприклад, під час Фремінгемського дослідження було встановлено, що наявність Dалелі гена АПФ асоціюється з більшим рівнем діастолічного артеріального тиску (АТ) у чоловіків. Є також свідчення про те, що у хворих на АГ носіїв Dалелі, в яких немає інших ФР, рівень АТ та пульсовий тиск є більш високими, ніж у хворих із протективною І алеллю. У той же час в інших роботах, у яких досліджувалися більш неоднорідні групи хворих на АГ — з іншими ФР, супутньою АГ, які вже отримували антигіпертензивну терапію, подібні закономірності встановлені не були.
У популяції Харківського регіону співвідношення ІІ, ІD і DDгенотипів поліморфізму гена АПФ становить 29, 43, та 28 % відповідно [5]. У нашому дослідженні розподіл генотипів у групі контролю відрізняється від популяції Харківського регіону. Так, співвідношення гомозигот ІІ, гетерозигот ІD та гомозигот DD становило 40, 42,9 та 17,1 % відповідно, що може бути пояснено включенням до контрольної групи практично здорових осіб.
При дослідженні інсерційноделеційного поліморфізму гена АПФ встановлено, що питома вага генотипів із домінантною Dделецією у хворих на ІХС із АГ (ІІ група) становила 57,4 %, що вірогідно більше, ніж у групі контролю — 38,6 % (Х2 = 4,67, p = 0,03) та ніж у І групі — 42,0 % (Х2 = 3,77, p = 0,05). Наявність позитивного асоціативного зв’язку (RRІІ–І = 1,98 [0,88–3,08]) дозволяє розглядати Dалель інсерційноделеційного поліморфізму гена АПФ як генетичний маркер підвищеного ризику розвитку АГ.
Уперше поліморфізм А1166С гена АТ2R1 описаний у роботі Bonnardeaux та співавт., у якій розподіл частот алелей означеного поліморфізму був проаналізований в європейській популяції [7]. У дослідженні доведено, що у хворих на АГ та осіб із обтяженою спадковістю щодо її розвитку патологічна Салель зустрічалася вірогідно частіше, ніж у здорових осіб. Асоціація ССгенотипу з розвитком АГ доведена також для китайської популяції [16]. В інших роботах наявність кореляції АГ із поліморфізмом А1166С гена АТ2Р1 не підтверджена [6, 15].
У групі контролю розподіл генотипів поліморфізму А1166С гена АT2R1 становив: АА — 31,4 %, АС — 48,6 %, СС — 20,0 %. При проведенні порівняльного аналізу розподілу частот алелей і генотипів означеного поліморфізму гена АT2R1 поміж груп обстежених хворих і контрольною групою статистично вірогідних відмінностей не виявлено.
Таким чином, із досліджених нами генівкандидатів лише поліморфізм Т786С промотора гена еNOs та інсерційноделеційний поліморфізм гена АПФ пов’язані з розвитком АГ у хворих на ІХС мешканців Харківської області.
Висновки
1. Ризик розвитку АГ у хворих на ІХС, які є мешканцями Харківської області, асоційований з носійством поліморфної Dалелі гена АПФ та наявністю ССгенотипу поліморфізму Т786С промотора гена еNOs.
2. Поліморфізм А1166С гена АT2R1 не впливає на ризик розвитку АГ у хворих на ІХС, які є мешканцями Харківської області.
1. Дзяк Г.В. Генотипические «ансамбли» полиморфных маркеров генов ренинангиотензиновой системы у больных с гипертонической болезнью / Г.В. Дзяк, Т.В. Колесник // Украинский кардиологический журнал. — 2008. — № 4. — С. 3439.
2. Allelic polymorphism of endothelial NOsynthase gene and its functional manifestations / V.E. Dosenko, V.Yu. Zagoriy, N.V. Haytovich et al. // Acta Biochem. Pol. — 2006. — Vol. 53, № 2. — P. 299302
3. Сіренко Ю.М. Гіпертонічна хвороба і артеріальні гіпертензії: монографія / Ю.М. Сіренко. — Донецьк: Видавець Заславський О.Ю., 2011. — 304 с.
4. Целуйко В.И. Генетика артериальной гипертензии / В.И. Целуйко, Чернышов В.А. // Журнал АМН Украины. — 2000. — Т. 6, № 4. — С. 666676.
5. Целуйко В.Й. Влияние инсерционноделеционного полиморфизма гена ангиотензинпревращающего фермента на развитие и течение атеросклеротического процесса / В.Й. Целуйко, І.В. Кузнецов, О.П. Медведь // Междунар. мед. журн. — 2008. — Т. 14, № 2. — С. 3640
6. ACE and AT1R gene polymorphisms and hypertension in Indian population / T.F. Ashavaid, K.K. Shalia, K.G. Nair, J.J. Dalal // J. Clin. Lab. Anal. — 2000. — Vol. 14(5). — P. 230237.
7. Angiotensin II type 1 receptor gene polymorphisms in human essential hypertension / A. Bonnardeaux, E. Davies, X. Jeunemaitre et al. // Hypertension. — 1994. — Vol. 24(1). — P. 6369.
8. Butler M.G. Genetics of hypertension. Current status / M.G. Butler // J. Med. Liban. –2010. — Vol. 58(3). — P. 175178.
9. Niu T. Angiotensin converting enzyme gene insertion/deletion polymorphism and cardiovascular disease: therapeutic implications / T. Niu, X. Chen, X. Xu // Drugs. — 2002. — Vol. 62(7). — P. 977993.
10. Review: association between angiotensin converting enzyme G2350A polymorphism and hypertension risk: a metaanalysis / W. Niu, Y. Qi, P. Gao, D. Zhu // J. Renin. Angiotensin. Aldosterone Syst. — 2011. — Vol. 12(1). — P. 814. doi: 10.1177/1470320310375859.
11. Niu W. An updated metaanalysis of endothelial nitric oxide synthase gene: three wellcharacterized polymorphisms with hypertension / W. Niu, Y. Qi // PLoS One. — 2011. — Vol. 6(9). — P. e24266.
12. The T786C endothelial nitric oxide synthase genotype is a novel risk factor for coronary artery disease in Caucasian patients of the GENICA study / G.P. Rossi, M. Cesari, M. Zanchetta et al. // J. Am. Coll. Cardiol. — 2003. — Vol. 41(6). — P. 930937.
13. Association of plasma nitric oxide concentration and endothelial nitric oxide synthase T786C gene polymorphism in coronary artery disease / S. Salimi, A. Naghavi, M. Firoozrai et al. // Pathophysiology. — 2012. — Vol. 19(3). — P. 157162.
14. Genetic variability in the reninangiotensin system: prevalence of alleles and genotypes / J.A. Staessen, G. Ginocchio, J.G. Wang et al. // J. Cardiovasc. Risk. — 1997. — Vol. 4(5–6). — P. 401422.
15. Angiotensin II type 1 receptor gene polymorphism is associated with increase of left ventricular mass but not with hypertension / S. Takami, T. Katsuya, H. Rakugi et al. // Am. J. Hypertens. — 1998. — Vol. 11(3 Pt 1). — P. 316321
16. Angiotensin II type 1 receptor gene A1166C polymorphism and essential hypertension in Chinese: a metaanalysis / J.L. Wang, X. Li, P.P. Hao et al. // J. Renin Angiotensin Aldosterone Syst. — 2010. — Vol. 11(2). — P. 12735. doi: 10.1177/1470320310364181.