Журнал «» 3 (29) 2013
Вернуться к номеру
Документ експертного консенсусу Європейского товариства кардіологів по катетерній денервації ниркових артерій. European Heart Journal Advance Access published April 25, 2013
Авторы: Felix Mahfoud 1, Thomas Felix Lüscher 2, Bert Andersson 3, Iris Baumgartner 4, Renata Cifkova 5, Carlo DiMario 6, Pieter Doevendans 7, Robert Fagard 8, Jean Fajadet 9, Michel Komajda 10, Thierry Le Fèvre 11, Chaim Lotan 12, Horst Sievert 13, Massimo Volpe 14, 15, Petr Widimsky 16, William Wijns 17, Bryan Williams 18, Stephan Windecker 19, Adam Witkowski 20, Thomas Zeller 21 та Michael Böhm1,
1Klinik für Innere Medizin III, Universitätsklinikum des Saarlandes, Homburg, Saar, Germany; 2Department of Cardiology, Cardiovascular Center, University Hospital, Zurich, Switzerland; 3Deptartment of Cardiology, Sahlgrenska University Hospital, Gothenburg, Sweden; 4Swiss Cardiovascular Center, Clinical and Interventional Angiology, University and University Hospital Bern, Bern, Switzerland; 5Center for Cardiovascular Prevention, Charles University Medical School I and Thomayer Hospital, Prague, Czech Republic; 6NIHR Cardiovascular BRU, Royal Brompton & Harefield NHS Trust, London, UK; 7Department of Cardiology, UMCU Utrecht the Netherlands and ICIN Utrecht, Utrecht, the Netherlands; 8Department of Cardiovascular Diseases, KU Leuven University, Leuven, Belgium; 9Interventional Cardiology Unit, Clinique Pasteur, Toulouse, France; 10Pitie Salpetriere Hospital, Department of Cardiology, University Pierre et Marie Curie, Paris, France; 11Institut Cardiovasculaire Paris Sud, Hopital Jacques Cartier, Massy, France; 12Heart Institute, Hadassah-Hebrew University Medical Center, Jerusalem, Israel; 13CardioVascular Center Frankfurt, Sankt Katharinen, Frankfurt, Germany; 14Division of Cardiology, Department of Clinical and Molecular Medicine, University of Rome Sapienza, Sant’Andrea Hospital, Rome, Italy; 15IRCCS Neuromed, Pozzilli (IS), Italy; 16Cardiocenter, Charles University, Hospital ‘Royal Vineyards’, Prague, Czech Republic; 17Cardiovascular Centre Aalst, Aalst, Belgium; 18Institute of Cardiovascular Science, University College London, London, UK; 19Klinik für Kardiologie, University and University Hospital Bern, Bern, Switzerland; 20Department of Interventional Cardiology and Angiology, Institute of Cardiology,Warsaw, Poland; and 21Klinik für Kardiologie und Angiologie II, Universitäts-Herzzentrum Freiburg — Bad Krozingen, Bad Krozingen, Germany
Рубрики: Кардиология
Разделы: Справочник специалиста
Версия для печати
Вступ
Гіпертонічна хвороба — одне з найбільш поширених і найбільш частих хронічних захворювань у всьому світі [1]. Було висловлено припущення, що протягом найближчих двох десятиліть у 50 % дорослого населення буде діагностовано артеріальну гіпертензію (АГ) за чинними стандартними критеріями [1]. Незважаючи на наявність багатьох безпечних та ефективних антигіпертензивних препаратів, частота досягнення цільового артеріального тиску залишається низькою [2]. Приблизно 5–10 % усіх пацієнтів із підвищеним артеріальним тиском, що визначається як > 140/90 мм рт.ст., або > 130–139/80–85 мм рт.ст. у хворих із цукровим діабетом, або > 130/80 мм рт.ст. у хворих із хронічними захворюваннями нирок, залишаються резистентними до антигіпертензивної терапії трьома і більше препаратами різних класів (одним із яких є діуретик) у максимальних або максимально переносимих дозах [3]. Резистентна артеріальна гіпертензія асоціюється з підвищеним ризиком серцевосудинних подій [4]. Поточне неінвазивне терапевтичне лікування в основному базується на зміні способу життя й медикаментозному лікуванні, у тому числі антагоністами альдостерону [3]. Донедавна можливості лікування пацієнтів із резистентною АГ були обмеженими. Сьогодні лікування за допомогою катетерної ниркової денервації є новим підходом, в основі якого лежить вплив на ниркові симпатичні нерви. Дійсно, методика, що була запропонована, дозволяє знизити симпатичну активність [5], рівень норадреналіну [6], а також артеріальний тиск [7–9] у пацієнтів із резистентною АГ. Нещодавно були опубліковані декілька національних [10–13] і міжнародних [14] експертних документів різних товариств, у створенні яких брали участь лікаріінтервенціоналісти. Ці експертні документи підсумовують думку групи експертів Європейського товариства кардіологів та Європейської асоціації серцевосудинних інтервенційних кардіологів, містять нові рекомендації щодо відповідного відбору пацієнтів, ефективності, безпеки, обмежень щодо проведення ниркової денервації для практикуючих лікарів, лікарівінтервенціоналістів, соціальних працівників.
Патофізіологія
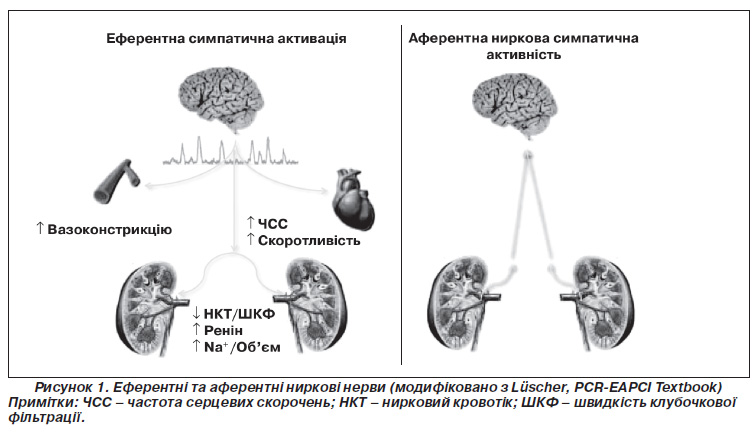
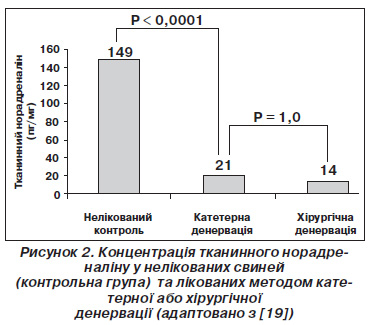
Етіологія резистентної АГ є багатофакторною. Однак існує велика кількість доказів, які вказують на ключову роль симпатичної нервової системи у формуванні артеріальної гіпертензії й інших серцевосудинних захворювань, таких як серцева недостатність, хронічна хвороба нирок та метаболічний синдром [15, 16]. Аферентні і еферентні, хіміо та барорецепторні нервові волокна утворюють нейронну мережу в адвентиції ниркових артерій (рис. 1) [17]. Ниркові аферентні нерви з’єднують нирки з гіпоталамусом і активуються при нирковій ішемії та при високій локальній концентрації аденозину [18]. Нирковий аферентний нервовий імпульс робить внесок у підтримку центральної симпатичної активності, що генерується в одиночному шляху і ядрах. Еферентні нерви іннервують ниркові судини, тубулярний сегмент нефрона і гранулярні клітини юкстагломерулярного апарату, які продукують ренін і тим самим підвищують затримку натрію і води, стимулюють вивільнення реніну і зміни ниркового кровообігу [16]. Ці ефекти впливають на короткострокове та довгострокове регулювання артеріального тиску. Зручне розташування еферентних та аферентних волокон у нирковій адвентиції артерій означає, що вони можуть бути мішенями для катетерних методик, завдяки яким можна змінювати ниркову регуляцію артеріального тиску. Катетерна радіочастотна абляція була такою ж ефективною, як і хірургічна денервація, з точки зору зниження вмісту норадреналіну в нирках свиней (рис. 2) [19].
Процедура
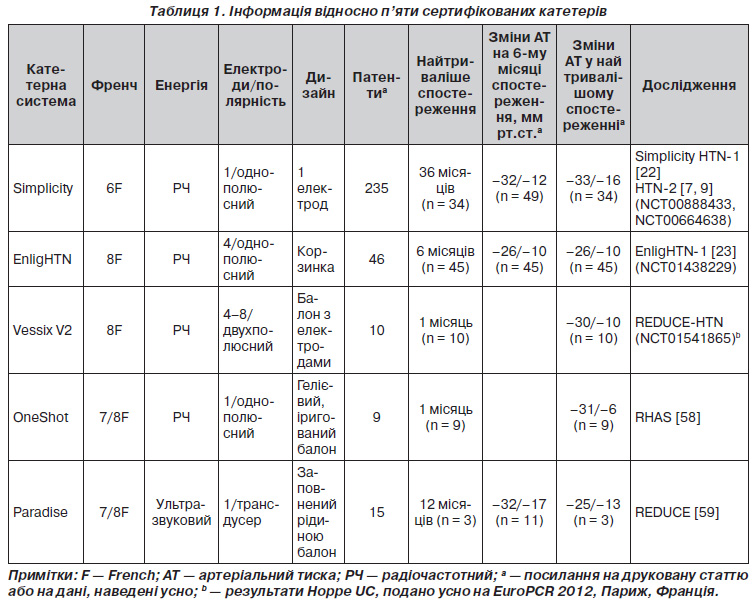
Численні нові черезшкірні системи для абляції ниркових нервів нині проходять випробування і скоро будуть випущені на ринок. До цих пір на європейському ринку наявні п’ять систем для ниркової денервації з використанням різних стратегій, доступні з них такі: Symplicity system компанії Medtronic, St. Jude’s EnligHTN system, Vessix’s V2 system, Covidien’s One Shot system, і Recor’s Раradise system (табл. 1). Більшість із цих систем використовують радіочастотну енергію для ураження ниркових симпатичних нервів, за винятком Recor’s Раradise system на основі ультразвуку. Усі пристрої встановлюються підшкірно через стегновий доступ, а також під рентгеноскопічним контролем. Проте анатомічна придатність ниркових артерій для цієї процедури повинна бути встановлена заздалегідь: в ідеалі довжина ниркової артерії має бути > 20 мм і діаметр — > 4 мм. Відносними протипоказаннями для проведення процедури ниркової денервації є видимий стеноз артерій (із кальцифікацією або атеросклеротичною бляшкою). Існують поодинокі повідомлення про випадкове проведення процедури ниркової денервації у хворих зі значним стенозом (> 50 %) артерій або після попередньої реваскуляризації, що проводилося всупереч зареєстрованим показанням та чого слід уникати. Нещодавно опубліковані дані показали, що використання радіочастотної енергії, що подається, приводить до короткочасного місцевого порушення цілісності ендотелію, гострого набряку клітин, коагуляції сполучної тканини й утворення тромбів [20]. Хоча даних, отриманих у контрольованих дослідженнях, не вистачає, усе ж ці спостереження дозволяють припустити, що використання антитромбоцитарної терапії під час проведення процедури (ацетилсаліцилова кислота 250 мг внутрішньовенно) на термін до чотирьох тижнів після проведення ниркової денервації (ацетилсаліцилова кислота 75–100 мг/добу перорально) може бути доцільною.
Завдяки спільному розміщенню симпатичних нервів і больових волокон C знеболювання й седація (наприклад, із використанням мідазоламу, морфіну, реміфентанилу, фентанілу або пропофолу) є обов’язковим під час проведення ниркової денервації. Необхідності присутності анестезіолога при проведенні процедури зазвичай немає, проте в деяких країнах це є обов’язковим. Під час проведення процедури фізичний стан пацієнта (артеріальний тиск, частота серцевих скорочень і насичення киснем) слід моніторувати. У деяких пацієнтів ниркова денервація за допомогою радіочастотної енергії може викликати набряк і/або спазм ниркової артерії на стороні проведення втручання, що можна усунути за допомогою внутрішньоартеріального введення нітрогліцерину або верапамілу. Навіть якщо спазм судин зберігається під час процедури, незважаючи на лікування, він зазвичай минає протягом години після денервації. Час проведення процедури ниркової денервації зазвичай триває від 45 до 60 хвилин.
Численні нові катетерні системи і способи проведення ниркової денервації знаходяться в стадії розробки, що включають розробку нових радіочастотних катетерів та катетерів із використанням ультразвукової енергії, кріодеструкції, місцевим введенням лікарських засобів або навіть із зовнішнім застосуванням ультразвукової енергії. Важливо відзначити, що всі нові пристрої, згадані вище, а також ті лікарі, які використовують нові методи лікування (ультразвук або хімічну денервацію), мають довести безпечність та ефективність процедури у великій групі пацієнтів протягом довгострокового спостереження перед тим, як вони можуть бути рекомендовані до загального використання [21].
Клінічні дослідження
Ефективність
У перше дослідження ефективності лікування артеріальної гіпертензії шляхом денервації ниркових артерій Symplicity HTN1 [6] та наступне за ним багатоцентрове проспективне рандомізоване дослідження Symplicity HTN2 увійшли 45 і 106 пацієнтів із резистентною АГ відповідно. Початковий рівень АТ у цих пацієнтів становив 177/100 і 178/96 мм рт.ст. відповідно, незважаючи на лікування в середньому чотирма або більше антигіпертензивними препаратами. Ниркова денервація призвела до значного зниження як систолічного, так і діастолічного артеріального тиску, що було вперше виявлено через 1 місяць (–14/–10 мм рт.ст.; P = 0,026) і зберігалося 24 місяці після цього (–32/–14 мм рт.ст.; Р = 0,001) [8]. Невелике нерандомізоване довгострокове (36 місяців) спостереження підтвердило стійке зниження артеріального тиску (–33–19 мм рт.ст., Р = 0,01, N = 34) [22]. У підгрупі з 32 пацієнтів, які проводили домашнє вимірювання АТ, було зафіксовано зниження АТ на 20/12 мм рт.ст. (P < 0,0001) порівняно з 2/0 мм рт.ст. у 40 пацієнтів контрольної групи. Як і очікувалося, зниження середньодобового АТ, виміряного упродовж добового моніторування АТ протягом 24 годин після проведення ниркової денервації, було менше порівняно зі змінами офісного АТ (а саме: 11/7 мм рт.ст.; P < 0,007, N = 20). Відповідь на лікування, що визначалася за зниженням систолічного артеріального тиску (САТ) > 10 мм рт.ст., була виявлена у 84 % пацієнтів при 6місячному спостереженні. Важливо відзначити, що артеріальний тиск рідко змінюється негайно після процедури. Часто потрібно від тижнів до декількох місяців, щоб відбулось помітне зниження артеріального тиску. Вважається, що повільний розвиток відповіді пояснюється поступовими прогресуючими змінами симпатичної нервової регуляції. Пацієнти та лікуючі лікарі повинні бути заздалегідь проінформовані про це, щоб уникнути нереалістичних очікувань відразу ж після процедури. Крім того, важливо донести до пацієнтів і широкого загалу лікарів, що на сьогодні ниркова денервація застосовується лише у хворих, чий артеріальний тиск не піддається контролю за допомогою стандартного медикаментозного лікування. У зв’язку з цим ниркова денервація не позиціонується як метод, здатний у більшості пацієнтів істотно зменшити кількість медикаментозних препаратів або цілком вилікувати гіпертонічну хворобу. Ні в Symplicity HTN1, ні в HTN2 зниження кількості антигіпертензивних препаратів після процедури не досліджувалось як кінцева точка. Слід зазначити, що спонсором обох досліджень виступили компанії, що виробляють пристрої для проведення ниркової денервації (Ardian/Medtronic).
Безпечність
У дослідженнях Symplicity процедура була проведена без істотних ускладнень у 98 % (201 з 209) пацієнтів [6–8]. Серед зареєстрованих були такі: три псевдоаневризми стегнової артерії, одне інфекційне ускладнення сечовивідних шляхів, один випадок болю в спині, одна госпіталізація для уточнення етіології парестезії й одна дисекція ниркової артерії під час розміщення направляючого катетера. У семи пацієнтів (13 %) під час втручання мали місце вазовагальні реакції, які були купірувані атропіном. Через 6 місяців після процедури 130 пацієнтам була проведена візуалізація ниркових артерій, за результатами якої прогресування атеросклеротичного ураження було виявлено в одного пацієнта, але воно не потребувало додаткових лікувальних заходів. Було опубліковано два випадки вторинного підвищення АТ після ниркової денервації, що пов’язують із прогресуванням стенозу ниркових артерій [24, 25]. Невідомо, чи абляція та/або встановлення катетера індукували стеноз ниркових артерій або сприяли його швидкому розвитку або ж прогресування стенозу являло собою природний розвиток хвороби. Висловлювалися побоювання, що ниркова денервація може негативно впливати на функцію нирок [26]. У дослідженні Symplicity HTN1 64 пацієнти спостерігалися протягом 24 місяців. Упродовж першого року спостереження швидкість клубочкової фільтрації (ШКФ) у них залишалася стабільною. Результати більш тривалого спостереження динаміки ШКФ доступні лише в 10 хворих, у яких зафіксовано зниження ШКФ на 16 мл/хв/1,73 м2, ці зміни пов’язують із корекцією сечогінної терапії. Вплив ниркової денервації на функцію нирок й екскрецію альбуміну з сечею був досліджений у 100 хворих на резистентну АГ зі збереженою функцією нирок [27]. Дослідження терміном 6 місяців показало зменшення кількості пацієнтів з мікро і макроальбумінурією після денервації ниркових артерій без негативної динаміки швидкості клубочкової фільтрації. Важливо відзначити, що з міркувань безпеки в дослідження Symplicity не включалися пацієнти з ШКФ < 45 м2 мл/хв/1,73 м2. Хоча попередні дані свідчать про те, що ниркова денервація є безпечною та ефективною у хворих із помірними та тяжкими хронічними хворобами нирок [28], таких пацієнтів можна лікувати тільки в рамках клінічних досліджень iз подальшим спостереженням. Вплив денервації ниркових артерій на толерантність до фізичних навантажень досліджувався за допомогою кардіореспіраторних навантажувальних тестів [29]. Ниркова денервація призвела до значного зменшення тривалості відпочинку і часу відновлення АТ, в той час як частота серцевих скорочень під час тренування і, відповідно, споживання кисню залишились на хорошому рівні. Ще одним очікуваним побічним ефектом була ортостатична гіпотензія. Вона була відзначена у 1950х роках, коли резистентну гіпертензію спробували лікувати шляхом хірургічної симпатектомії [30]. На щастя, при використанні катетерних технологій такий побічний ефект не відмічався. Дійсно, під час недавнього дослідження не виявили достовірних змін артеріального тиску при зміні пози у відповідь на ортостатичну пробу [31].
Обмеження
Одна з основних проблем полягає у відсутності критеріїв успішності проведення процедури. Не існує легкодоступних методів, що дозволяють з’ясувати, чи була проведена процедура повністю або частково ефективна або неефективна зовсім. Крім того, не всі пацієнти відповідають на лікування зниженням АТ. Незрозуміло, чи обумовлено це фенотиповими особливостями пацієнта або недосконалим виконанням процедури. Таким чином, немає можливості прогнозувати ймовірність відповіді й загального успіху процедури денервації нирок. Однак, як і в дослідженнях гіпотензивних препаратів, вихідний рівень САТ був визначений як предиктор величини зниження АТ [27]. Це може принаймні частково пояснити статистичний феномен «регресії до середнього» у Symplicity HTN2 [7], використання симпатолітиків центральної дії визначено як предиктор вираженого зниження АТ, хоча це досить дивно, адже в основі лежить той же механізм дії, що і при денервації, і можна було б очікувати, що препарати будуть більш ефективними. На сьогодні не було запропоновано негативних предикторів відповіді і, як зазначено вище, не існує надійних біохімічних або інших параметрів для оцінки досягнутого ступеня успішності ниркової денервації, придатних для застосування в повсякденній клінічній практиці. Досі не до кінця встановлені точні механізми, за допомогою яких відбувається зниження артеріального тиску внаслідок денервації ниркових артерій, але, ймовірно, мають місце зниження загального периферичного опору, зниження секреції реніну і сприятливі зміни водносольового обміну.
Слід зазначити, що вимірювання передачі імпульсів по симпатичних волокнах малогомілкового нерва показало зменшення симпатичної активності після ниркової денервації [5]. Це важливо, оскільки передбачає, що внаслідок процедури відбудеться зменшення активності симпатичної нервової системи всього тіла, скоріше за все, у зв’язку зі зниженням аферентного потоку, що, у свою чергу, призводить до зменшення зворотної імпульсації від центральної нервової системи [5]. Проте одне з опублікованих досліджень показало на невеликій групі з 12 пацієнтів відсутність істотного загального гіпотензивного ефекту і будьяких змін м’язової симпатичної нервової активності після ниркової денервації (RDN) [32]. Інтерпретація цього дослідження обмежується тим, що на відміну від досліджень Symplicity базовий АТ був на рівні 157/85 мм рт.ст. (тобто на ≈ 20/10 мм нижче) і деякі з пацієнтів мали ліковану резистентну гіпертензію (42 % пацієнтів мали САТ≤ 140 мм рт.ст.) [33]. Таким чином, менш виражене зниження артеріального тиску в даному випадку було цілком прогнозованим, однак активація симпатичної нервової системи присутня навіть при м’якій гіпертензії [34]. На відміну від цього у великих контрольованих дослідженнях, куди увійшли численні групи пацієнтів з підтвердженою резистентною до медикаментозного лікування гіпертензією і високим рівнем АТ, спостерігалося помірне зниження м’язової симпатичної нервової активності (МСНА) м’язу та достовірне зниження цього показника в окремому м’язовому волокні [5]. Когорти пацієнтів відрізняються як рівнями АТ і МСНА (із розрахунку на 100 серцевих скорочень), так і супутньою медикаментозною терапією. Невідомо також, чи буде ефект від денервації ниркових артерій стабільно зберігатися протягом часу. На сьогодні є дані обмежених спостережень лише протягом 36 місяців [22]. Справді, дослідження на тваринах й експерименти з трансплантації показали, що симпатичні ниркові нерви мають можливості повторно вирости і/або регенерувати з часом [35–37].
Дійсно, досліди на тваринах та експерименти за участі пацієнтів після трансплантації показали, що ренальні симпатичні нервові волокна можуть відновлюватися та/або регенерувати із часом. Таким чином, довготривалість ефекту процедури і досі залишається відкритим питанням, адже на даний момент доступна лише обмежена інформація стосовно тривалого спостереження за пацієнтами як у клінічних дослідженнях, так і в реальній практиці. Оприлюднені результати 36місячного спостереження дослідження Symplicity HTN1 обнадіюють, адже вони доводять стійкість антигіпертензивного ефекту та дозволяють припустити, що значна і функціонально адекватна регенерація ниркових нервів є малоймовірною. Також постає питання необхідності повторного проведення НДН у пацієнтів із неадекватною відповіддю після першої процедури. Тим не менше враховуючи сучасні відомості, можливо рекомендувати і такий підхід.
Дослідження Symplicity HTN2 надає лише обмежену інформацію відносно впливу ниркової денервації на рівні АТ у денний та нічний час, а також на середньодобовий рівень артеріального тиску, через це, беручи до уваги отримані результати, вважали, що ниркова денервація не в змозі знизити рівень амбулаторного артеріального тиску настільки ж ефективно, як і офісного Багатоцентровий аналіз за участі понад 300 пацієнтів, які пройшли процедуру ниркової денервації, згодом допоміг встановити, що НДН значно знижує рівень офісного, середньодобового, денного та нічного АТ у пацієнтів із резистентною артеріальною гіпертензією та збільшує частку пацієнтів із досягненням цільового рівня артеріального тиску, що відображалося як у зміні показників офісного вимірювання, так і за результатами добового моніторування артеріального тиску (Mahfoud F., Homburg/Saar, data on file).
На відміну від деяких антигіпертензивних препаратів, для ниркової денервації не було доведено впливу на серцевосудинну захворюваність та смертність. Хоча покращення віддалених наслідків цілком ймовірне, оскільки ми досягаємо суттєвого зниження артеріального тиску як дійсного сурогатного результату при тяжкій та резистентній артеріальній гіпертензії, саме тому в наш час перед нами постає потреба проводити подальші дослідження, щоб чітко встановити роль інвазивної терапії. Багатоцентрове проспективне сліпе рандомізоване плацебоконтрольоване дослідження Symplicity HTN3 (NCT01418261) проводить набір пацієнтів у США, що, як ми сподіваємося, допоможе відповісти на питання, чи сприяє ефект плацебо виникненню зміщень у результатах ниркової денервації.
Відбір пацієнтів
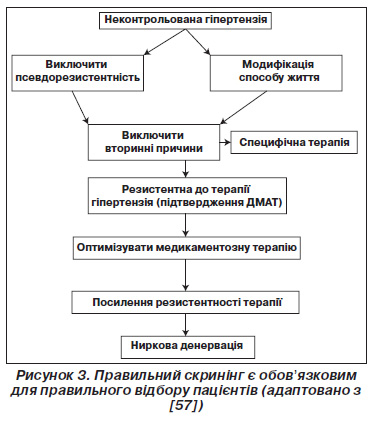
Згідно з наявними даними, пацієнтам із (тяжкою) резистентною до лікування гіпертензією, що визначається як рівень офісного САТ ≥ 160 мм рт.ст. (≥ 150 мм рт.ст. при цукровому діабеті 2го типу), незважаючи на лікування принаймні трьома антигіпертензивними препаратами різних класів в адекватних дозах, одним із яких є діуретик, варто проводити процедуру денервації ниркових артерій. У деяких центрах рівень АТ на тлі терапії понад 140/90 мм рт.ст. прийнято розцінювати як резистентну гіпертензію. Високий рівень офісного АТ слід підтвердити шляхом добового моніторування артеріального тиску аби виключити ймовірність псевдорезистентності. Псевдорезистентністю слід вважати артеріальну гіпертензію, при якій рівень офісного АТ значно вищий, ніж за даними вимірювання поза клінікою (середній денний АТ < 135 мм рт.ст.). Але перш ніж рекомендувати пацієнту з резистентною артеріальною гіпертензією ниркову денервацію, він має проконсультуватися з експертами спеціалізованих центрів (наприклад, Hypertension Excellence Centers; див. http://www.eshonline.org/Communities/CentresList.aspx). Слід зробити частиною протоколу відбору оптимізацію антигіпертензивної терапії та виявлення несприятливих факторів способу життя. Особливу увагу варто приділяти можливості додаткового призначення антагоністів рецепторів мінералокортикоїдів (наприклад, спіронолактон, еплеренон), які особливо ефективні в пацієнтів із резистентною артеріальною гіпертензією. Хоча щодо довготривалої безпеки використання цих препаратів існують певні побоювання, особливо у хворих зі зниженою функцією нирок та вже існуючою блокадою ренінангіотензинової системи. Таким чином, чинні рекомендації стосовно того, що тільки пацієнтам, в яких лікування антагоністами рецепторів мінералокортикоїдів було невдалим, можна рекомендувати проведення ниркової денервації, не є остаточними. Також слід систематично виключати вторинні гіпертензії, у тому числі стеноз ниркових артерій, феохромоцитому, синдром нічного апное, а також первинний гіперальдостеронізм. На рис. 3 подано рекомендовану схему процесу відбору, перш ніж слід розглядати питання ниркової денервації. На основі критеріїв виключення з досліджень Symplicity наступні критерії також слід використовувати для того, щоб сміливо призначати ниркову денервацію: попереднє втручання на ниркових артеріях (балонна ангіопластика або стентування), ознаки атеросклеротичного ураження ниркових артерій (що визначається як стеноз ниркових артерій понад 50 %), множинні ниркові артерії або діаметр основної ниркової артерій менше 4 мм або довжина менше 20 мм. Функція нирок повинна бути збережена (ШКФ ≥ 45 мл/хв/1,73 м2), хоча проведення ниркової денервації здається безпечним та ефективним також у пацієнтів із помірною та тяжкою хронічною хворобою нирок. Нижче наведено критерії відбору пацієнтів для ниркової денервації відповідно до наявної на даний момент доказової бази. Варто також врахувати, що серед пацієнтів із резистентною гіпертензією багато повідомлень про побічні дії антигіпертензивних препаратів. Досі не було опубліковано жодного дослідження ефективності ниркової денервації в пацієнтів із непереносимістю різних препаратів, хоча ця проблема може стати актуальною. Проте зараз жодні рекомендації з цього приводу не слід давати. Тим не менше видається логічним індивідуальне прийняття рішення у пацієнтів із відтвореною непереносимістю препаратів або із виникненням значних побічних ефектів.
Критерії, яким повинен відповідати пацієнт, перед проведенням ниркової денервації
— Рівень офісного АТ ≥ 160 мм рт.ст. (≥ 150 мм рт.ст. при цукровому діабеті 2го типу).
— ≥ 3 антигіпертензивних препаратів в адекватних дозах та комбінації (включаючи діуретик).
— Модифікація способу життя.
— Виключення вторинних гіпертензій.
— Виключення псевдорезистентності за допомогою добового моніторування АТ (середньодобовий АТ > 130 мм рт.ст. або середній АТ в денний час > 135 мм рт.ст.).
— Збережена функція нирок (ШКФ ≥ 45 мл/хв/1,73 м2).
— Прийнятна анатомія ниркових артерій: відсутність.
Центри відбору
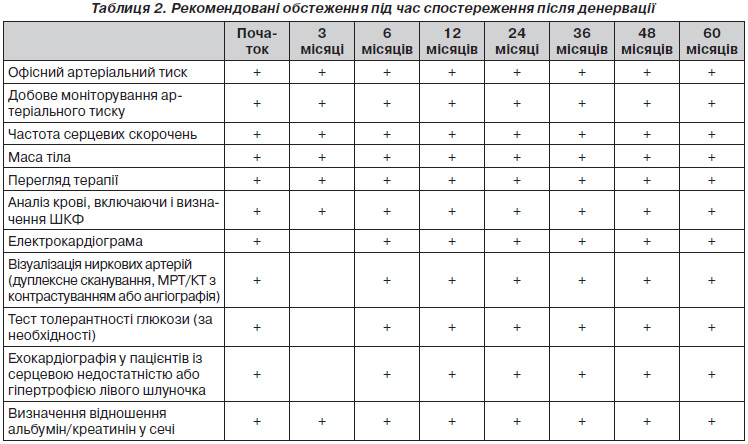
У пацієнтів із неконтрольованою АГ вторинні причини гіпертензії — явище поширене. Таким чином, детальний процес скринінгу є обов’язковим методом виявлення пацієнтів із потенційно виліковними формами гіпертензії, оскільки виконання ниркової денервації неефективне для них. Центри відбору повинні бути спеціалізованими в лікуванні АГ (наприклад, Hypertension Excellence Centers, див. http://www.eshonline.org/Communities/CentresList.aspx), у яких принаймні один фахівець з артеріальної гіпертензії бере активну участь у лікуванні й процесі відбору. З метою уникнення частих ускладнень рекомендовано, щоб втручання виконували інтервенційні кардіологи або ангіографісти, які пройшли підготовку у проведенні даної конкретної процедури і які мають право лікувати потенційні ускладнення, такі як гостре розшарування ниркової артерії шляхом імплантації стента. Відповідний фахівець в одному центрі може провести приблизно 25 процедур ниркової денервації на рік. На початковій стадії впровадження процедури центри повинні вводити власні дані до великих реєстрів, аби забезпечити належний контроль якості та аналіз ефективності процедури одразу після її проведення та під час тривалого спостереження. У табл. 2 наведено рекомендовані подальші дослідження після виконання ниркової денервації.
Економічна ефективність
Нещодавно було опубліковано показники економічної ефективності та довгострокові клінічні переваги ниркової денервації в пацієнтів із резистентною АГ, отримані шляхом використання статистичної моделі переходів Маркова. Результати показують, що, хоча лікування методом ниркової денервації і потребує додаткового використання коштів (госпіталізація, катетер та витрати на оплату роботи оператора) та, можливо, буде мати досить високу собівартість, із часом він може стати економічно більш вигідним порівняно з іншими медичними процедурами. Приблизне, скориговане за якістю життя на рік, співвідношення «цінаефективність» додаткової тривалості життя становить $ 3071, хоча воно значно нижче за загальноприйняте порогове значення — $ 5000. Прогнозоване середнє виживання становить 18,4 року для терапії методом денервації ниркових артерій і 17,1 року — для існуючого стандарту допомоги. Однак ці попередні розрахунки досить чутливі до кошторисів різних систем охорони здоров’я і засновані на припущенні, що зниження артеріального тиску за допомогою медикаментозної терапії або шляхом ниркової денервації не відрізняються за ступенем ефективності або шкоди поза межами їх впливу на зниження артеріального тиску.
Потенційний позитивний вплив процедури, крім зниження артеріального тиску
Цукровий діабет та резистентність до інсуліну
Активація симпатичної нервової системи є основною причиною інсулінорезистентності, метаболічного синдрому, пов’язана із центральним ожирінням та ризиком розвитку цукрового діабету. Існує двонаправлений зв’язок між симпатичною індукцією інсулінорезистентності та збільшенням симпатичного тонусу шляхом гіперінсулінемії. В експериментальному дослідженні ниркова денервація позитивно впливала на метаболізм глюкози в пацієнтів із резистентною АГ. Через три місяці після процедури відбулося значне зниження рівнів глюкози та інсуліну натще, а також концентрація глюкози через 2 години після орального тесту толерантності, що призвело до значного поліпшення чутливості до інсуліну (виміряне із використанням індексу HOMA), тоді як у контрольної групи не спостерігалось жодних змін. Схожі результати були отримані і в дослідженні ефективності ниркової денервації у хворих із синдромом обструктивного апное сну. Автори повідомляють, що, крім зниження тяжкості проявів обструктивного апное уві сні, вони також спостерігали зміну концентрації глюкози через 2 год після орального тесту на толерантність, а також зниження рівня HbA1c. У попередній доповіді про результати денервації у двох пацієнтів із синдромом полікістозних яєчників [45] припускається, що ниркова денервація знижує кров’яний тиск і покращує інсулінрезистентність (яка вимірювалася за допомогою еуглікемічного клемптесту) при відсутності змін маси тіла протягом 3місячного періоду. У подальшому необхідні дослідження для визначення тривалості цих позитивних змін, а також їх наслідків для ведення пацієнтів із цукровим діабетом.
Кардіальні ефекти
Нейрогуморальна активація, зокрема активація симпатичної нервової системи, має прогностичне значення у хворих із хронічною серцевою недостатністю, тому протидія впливу симпатичної нервової системи шляхом призначення бетаблокаторів значно знижує захворюваність та серцевосудинну смертність. Нирки було визначено як основний чинник комплексу патофізіологічних змін, що офіційно називається кардіоренальним синдромом. В одному з опублікованих досліджень вивчався вплив ниркової денервації на масу міокарда лівого шлуночка та показники діастолічного наповнення у 46 хворих із резистентною АГ, у яких ниркова денервація призвела до значного зниження артеріального тиску і значного зменшення маси міокарда лівого шлуночка і середньої товщини міжшлуночкової перегородки. Діастолічна функція (яку оцінювали як співвідношення Е/Е) значно покращилась після ниркової денервації, а також відбулося зниження тиску наповнення лівого шлуночка і покращення фракції викиду. У невеликому пілотному першому дослідженні за участі семи нормотензивних пацієнтів із хронічною серцевою недостатністю через 6 місяців після ниркової денервації відбулося покращення результатів 6хвилинної ходьби і суб’єктивної оцінки самопочуття пацієнтів. Не відбулося жодних істотних змін у показниках артеріального тиску, функції нирок, а також не спостерігалося жодних симптомних коливань гемодинаміки. Сьогодні продовжується рандомізоване контрольоване багатоцентрове дослідження (READAPTCHF) вивчення впливу ниркової денервації у 100 пацієнтів із хронічною серцевою недостатністю (функціонального класу NYHA II–III), результати якого допоможуть отримати цінну інформацію.
Хронічна хвороба нирок
Численні факти свідчать про те, що хронічне захворювання нирок характеризується активацією симпатичної нервової системи, що сприяє виникненню артеріальної гіпертензії та прогресуванню зниження функції нирок. Тим не менше денервація ниркових артерій потенційно може стати новим терапевтичним напрямком у лікуванні пацієнтів із порушеннями функції нирок, у тому числі при термінальній стадії захворювання нирок, хоча в дослідження Symplicity HTN не включали пацієнтів із ШКФ < 45 мл/хв/1,73 м2 через те, що безпечність даного втручання в цій популяції пацієнтів не визначено. Нещодавно повідомили про вплив ниркової денервації в невеликій групі з 15 пацієнтів із помірним зниженням функції нирок (середня ШКФ < 45 мл/хв/1,73 м2). Ниркова денервація виявилася ефективною з точки зору зниження артеріального тиску, у той час як не спостерігалось жодних ознак подальшого зниження ШКФ або ефективного ниркового плазмотоку через 6 місяців після процедури, незважаючи навіть на ймовірний вплив введення контрастної речовини. Хоча внаслідок обмеження наявних даних пацієнтів із більш високим ступенем ниркової недостатності слід лікувати лише в контексті наявних клінічних досліджень.
Антиаритмічний вплив
Вегетативна нервова система також модулює електрофізіологічні властивості серця, включаючи і хронотропію, дронотропію, деполяризаційну швидкість синусового вузла і атріовентрикулярного проведення. Як було показано, процедура ниркової денервації призводить до значного зниження ЧСС спокою та інтервалу PR у пацієнтів з резистентною АГ. Цікаво, що ні вихідна частота пульсу, ні зміна частоти серцевих скорочень після процедури не корелюють із ступенем зниження артеріального тиску. У перших експериментах ниркову денервацію використовували як терапію порятунку у двох пацієнтів із застійною серцевою недостатністю, які страждали від резистентних до лікування серцевих нападів, пов’язаних з електричною нестабільністю серця. Після ниркової енервації частота виникнення шлуночкових тахіаритмій значно знизилася в обох пацієнтів. В одному з досліджень оцінили вплив ниркової денервації у пацієнтів із рефрактерною фібриляцією передсердь і стійкою артеріальною гіпертензією. 27 пацієнтів були рандомізовані в групи ізоляції легеневих вен окремо або ізоляції легеневих вен ниркової денервації. Крім значного зниження артеріального тиску, пацієнти другої групи відчули значне зменшення епізодів фібриляції передсердь при подальшому спостереженні. Більше того, в експериментах на тваринах підтверджено антиаритмічний ефект ниркової денервації, а також запропоновано процедуру як таку, що може зменшити індукування фібриляції передсердь. Таким чином, роль ниркової денервації в плані лікування аритмій заслуговує подальшого вивчення в дослідженнях із чітким визначенням протоколів. Однак унаслідок обмеження числа пацієнтів у дослідженнях рутинне використання процедури в цьому випадку не рекомендоване.
Гіпертензивне ураження органів-мішеней
Було показано, що такі показники жорсткості судин, як відбиття пульсової хвилі та приріст швидкості пульсової хвилі, негативно пов’язані із серцевосудинною захворюваністю та смертністю у пацієнтів з артеріальною гіпертензією. Ниркова денервація значно зменшує центральний пульсовий тиск, що пов’язаний із периферичним пульсовим тиском, та призводить до зниження швидкості поширення пульсової хвилі, тим самим вказуючи на ефект зворотного ремоделювання периферичних судин. Це було доведено для пацієнтів із значною жорсткістю судин на початку дослідження. Проводили також визначення рівня альбумінурії як ознаки раннього ураження нирок при гіпертонічній хворобі. Було показано, що ниркова денервація може знизити ступінь макроальбумінурії і мікроальбумінурії до нижчих класів екскреції альбуміну із сечею, що призводить до зменшення частки пацієнтів із мікро або макроальбумінурією після 6 місяців спостереження.
Висновок
Отримані дані з наявних клінічних досліджень достовірно свідчать про те, що катетерна радіочастотна абляція ниркових артерій знижує артеріальний тиск та покращує його контроль у пацієнтів із резистентною до медикаментозної терапії АГ, що, як свідчать наявні на сьогодні повідомлення, зберігається 36 місяців. Відповідно, проведення ниркової денервації можливо розглядати як тактику вибору в пацієнтів із резистентною АГ, артеріальний тиск яких не вдається контролювати поєднанням зміни способу життя та корекції фармакологічної терапії, відповідно до чинних рекомендацій. Той факт, що ниркова денервація також знижує тонус симпатичної нервової системи всього організму, дозволяє припустити, що вона також може бути корисною в лікуванні інших клінічних станів, які характеризується підвищенням активації симпатичної нервової системи, оскільки це може в кінцевому підсумку призвести до створення нових показань для процедури.
Фінансування
Felix Mahfoud підтримується Deutsche Hochdruckliga. Felix Mahfoud та Michael Böhm підтримуються Deutsche Forschungsgemeinschaft та Deutsche Gesellschaft für Kardiologie. Stephan Windeckerотримав гранти від Abbott, Biotronik, Biosensors, Boston Scientific, Cordis, Medtronic, St. Jude, Edwards Lifesciences. Thomas Zeller дослідницькі гранти від MedtronicArdian та Recor.
Конфлікт інтересів: Felix Mahfoud та Michael Böhm отримали дослідницьку підтримку Medtronic, St. Jude, Vessix та ReCor та отримали гонорари від виступів у Medtronic, St. Jude та Cordis. Thomas Felix Lüscher отримав незначні гонорари Medtronic. Iris Baumgartner отримав гонорари від виступів у Medtronic. Horst Sievert отримав дослідницьку підтримку Medtronic, Vessix, Maya, Covidien та ReCor. Massimo Volpe задіяний в Advisory Board of the Global Symplicity Registry of Medtronic. Bryan Williams є головним дослідником NIHR і консультував Medtronic із створення Міжнародного реєстру денервації. Adam Witkowski отримав гонорари від виступів Medtronic. Thomas Zeller є членом медичних консультативних рад MedtronicArdian, Northwind та St. Jude Medical.
1. Kearney P.M., Whelton M., Reynolds K., Muntner P., Whelton P.K., He J. Global burden of hypertension: analysis of worldwide data // Lancet 2005; 365: 217223.
2. Calhoun D.A., Jones D., Textor S., Goff D.C., Murphy T.P., Toto R.D., White A., Cushman W.C., WhiteW., Sica D., Ferdinand K., Giles T.D., Falkner B., Carey R.M. Resistant hypertension: diagnosis, evaluation, and treatment: a scientific statement from the American Heart Association Professional Education Committee of the Council for High Blood Pressure Research // Circulation 2008; 117: e510e526.
3. Mancia G., De Backer G., Dominiczak A., Cifkova R., Fagard R., Germano G., Grassi G., Heagerty A.M., Kjeldsen S.E., Laurent S., Narkiewicz K., Ruilope L., Rynkiewicz A., Schmieder R.E., Boudier H.A., Zanchetti A., Vahanian A., Camm J., De Caterina R., Dean V., Dickstein K., Filippatos G., FunckBrentano С., Hellemans I., Kristensen S.D., McGregor K., Sechtem U., Silber S., Tendera M., Widimsky P., Zamorano J.L., Erdine S., Kiowski W., AgabitiRosei E., Ambrosioni E., Lindholm L.H., Viigimaa M., Adamopoulos S., Bertomeu V., Clement D., Farsang C., Gaita D., Lip G., Mallion J.M., Manolis A.J., Nilsson P.M., O’Brien E., Ponikowski P., Redon J., Ruschitzka F., Tamargo J., van Zwieten P., Waeber B., Williams B. 2007 Guidelines for the Management of Arterial Hypertension: The Task Force for the Management of Arterial Hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC) // J. Hypertens. 2007; 25: 11051187.
4. Daugherty S.L., Powers J.D., Magid D.J., Tavel H.M., Masoudi F.A., Margolis K.L., O’Connor P.J., Selby J.V., Ho P.M. Incidence and prognosis of resistant hypertensionin hypertensive patients // Circulation 2012; 125: 16351642.
5. Hering D., Lambert E.A., Marusic P., Walton A.S., Krum H., Lambert G.W., Esler M.D., Schlaich M.P. Substantial reduction in single sympathetic nerve firing after renal denervationin patients with resistant hypertension // Hypertension 2013; 61: 457464.
6. Krum H., Schlaich M., Whitbourn R., Sobotka P.A., Sadowski J., Bartus K., Kapelak B., Walton A., Sievert H., Thambar S., Abraham W.T., Esler M. Catheterbased renal sympathetic denervation for resistant hypertension: a multicentre safety andproofofprinciple cohort study // Lancet 2009; 373: 12751281.
7. Esler M.D., Krum H., Sobotka P.A., Schlaich M.P., Schmieder R.E., Böhm M. Renal sympathetic denervation in patients with treatmentresistant hypertension (The SymplicityHTN2 Trial): a randomised controlled trial // Lancet 2010; 376: 19031909.
8. Krum H., Barman N., Schlaich M., Sobotka P., Esler M., Mahfoud F., Böhm M., Dunlap M. Catheterbased renal sympathetic denervation for resistant hypertension: durability of blood pressure reduction out to 24 months // Hypertension 2011; 57: 911917.
9. Esler M.D., Krum H., Schlaich M., Schmieder R.E., Böhm M., Sobotka P.A. Renal sympatheticdenervation for treatment of drugresistant hypertension: oneyear resultsfrom the Symplicity HTN2 randomized, controlled trial // Circulation 2012; 126: 29762982.
10. Mahfoud F., Vonend O., Bruck H., Clasen W., Eckert S., Frye B., Haller H., Hausberg M., Hoppe U.C., Hoyer J., Hahn K., Keller T., Krämer B.K., Kreutz R., Potthoff S.A., Reinecke H., Schmieder R., Schwenger V., Kintscher U., Böhm M., Rump L.C. [Expert consensusstatement on interventional renal sympathetic denervation for hypertension treatment] // Dtsch Med. Wochenschr 2011; 136: 2418.
11. Pathak A., Girerd X., Azizi M., Benamer H., Halimi J.M., Lantelme P., Lefevre T., Sapoval M. Expert consensus: renal denervation for the treatment of arterial hypertension // Arch. Cardiovasc. Dis. 2012; 105: 386393.
12. Weber T., Zweiker R., Watschinger B., Gruner P., Koppelstatter C., Brandt M.C., Horina J., Brussee H., Hohenstein K., Lambert T., Auer J., Hoppe U.C. Clinical applicationof interventional renal sympathetic denervation: recommendations of the AustrianSociety of Hypertension 2012 // Wien Klin Wochenschr 2012; 124: 789798.
13. Witkowski A., Januszewicz A., Imiela J., Narkiewicz K., Opolski G., Rowinski O., Sadowski J., Dudek D., Bryniarski L., Gil R.J., Adamczak M., Grajek S., Kadziela J., Prejbisz A., Nowicki M. [Catheterbased renal sympathetic denervation for the treatmentof resistant arterial hypertension in Poland — experts consensus statement] // Kardiol. Pol. 2011; 69: 12081211.
14. Schmieder R.E., Redon J., Grassi G., Kjeldsen S.E., Mancia G., Narkiewicz K., Parati G., Ruilope L., van de Borne P., Tsioufis C. ESH position paper: renal denervation — aninterventional therapy of resistant hypertension // J. Hypertens. 2012; 30: 837841.
15. Grassi G. Assessment of sympathetic cardiovascular drive in human hypertension:achievements and perspectives // Hypertension 2009; 54: 690697.
16. Sobotka P.A., Mahfoud F., Schlaich M.P., Hoppe U.C., Böhm M., Krum H. Sympathorenalaxis in chronic disease // Clin. Res. Cardiol. 2011; 100: 10491057.
17. DiBona G.F. Physiology in perspective: The Wisdom of the Body. Neural control ofthe kidney // Am. J. Physiol. Regul. Integr. Comp. Physiol. 2005; 289: R633R641.
18. Esler M. The 2009 Carl Ludwig Lecture: Pathophysiology of the human sympatheticnervous system in cardiovascular diseases: the transition from mechanisms tomedical management // J. Appl. Physiol. 2010; 108: 227237.
19. Esler M. Catheterbased renal denervation reduces total body and renal noradrenalinespillover and blood pressure in resistant hypertensive patients // J. Hypertens 2009; 27: s167.
20. Steigerwald K., Titova A., Malle C., Kennerknecht E., Jilek C., Hausleiter J., Nahrig J.M., Laugwitz K.L., Joner M. Morphological assessment of renal arteries after radiofrequencycatheterbased sympathetic denervation in a porcine model // J. Hypertens 2012; 30: 22302239.
21. Mahfoud F., Kjeldsen S.E. Catheterbased renal denervation: a word of caution // EuroIntervention 2013; 8: 1.
22. Krum H., Schlaich M., Sobotka P.A., Esler M.D., Mahfoud F., Böhm M., Dunlap M., RochaSingh K., Katholi R. TCT12 longtermfollowup of catheterbased renal denervationfor resistant hypertension confirms durable blood pressure reduction // J. Am. Coll. Cardiol. 2012; 60: doi: 10.1016/j.jacc.2012.08.017.
23. Papademetriou V., Worthley S., Tsioufis C., Worthley M., Chew D., Sinhal A., Meredith I., Malaiapan Y. Catheterbased renal denervation for the treatment ofpatients with drugresistant hypertension: EnligHTN I: threemonth data of a firstin man study using a multielectrode radiofrequency ablation catheter // Circulation 2012; 125: A19523.
24. Vonend O., Antoch G., Rump L.C., Blondin D. Secondary rise in blood pressure afterrenal denervation // Lancet 2012; 380: 778.
25. Kaltenbach B., Id D., Franke J.C., Sievert H., Hennersdorf M., Maier J., Bertog S.C. Renalartery stenosis after renal sympathetic denervation // J. Am. Coll. Cardiol. 2012; 60: 26942695.
26. Petidis K., Anyfanti P., Doumas M. Renal sympathetic denervation: renal function concerns // Hypertension 2011; 58: e19.
27. Mahfoud F., Cremers B., Janker J., Link B., Vonend O., Ukena C., Linz D., Schmieder R., Rump L.C., Kindermann I., Sobotka P.A., Krum H., Scheller B., Schlaich M., Laufs U., Böhm M. Renal hemodynamics and renal function after catheterbased renal sympatheticdenervation in patients with resistant hypertension // Hypertension 2012; 60: 419424.
28. Hering D., Mahfoud F., Walton A.S., Krum H., Lambert G.W., Lambert E.A., Sobotka P.A., Böhm M., Cremers B., Esler M.D., Schlaich M.P. Renal denervation in moderate tosevere CKD // J. Am. Soc. Nephrol. 2012; 23: 12501257.
29. Ukena C., Mahfoud F., Kindermann I., Barth C., Lenski M., Kindermann M., Brandt M.C., Hoppe U.C., Krum H., Esler M., Sobotka P.A., Böhm M. Cardiorespiratory response toexercise after renal sympathetic denervation in patients with resistant hypertension // J. Am. Coll. Cardiol. 2011; 58: 11761182.
30. Smithwick R.H. Surgical treatment of hypertension // Am. J. Med. 1948; 4: 744759.
31. Mahfoud F., Lenski M., Ukena C., Barth C., Razouk A., Fischer D., Laufs U., Kindermann I., Böhm M. Influence of renal sympathetic denervation on orthostatic function inpatients with resistant hypertension // Circulation 2012; 126: A17201.
32. Brinkmann J., Heusser K., Schmidt B.M., Menne J., Klein G., Bauersachs J., Haller H., Sweep F.C., Diedrich A., Jordan J., Tank J. Catheterbased renal nerve ablation andcentrally generated sympathetic activity in difficulttocontrol hypertensive patients:prospective case series // Hypertension 2012; 60: 14851490.
33. Mahfoud F., Böhm M., Rump L.C., Vonend O., Schmieder R.E., Kintscher U. Catheterbasedrenal nerve ablation and centrally generated sympathetic activity indifficulttocontrol hypertensive patients: prospective case series // Hypertension 2013; 61: e17.
34. Smith P.A., Graham L.N., Mackintosh A.F., Stoker J.B., Mary D.A. Relationship betweencentral sympathetic activity and stages of human hypertension // Am. J. Hypertens. 2004; 17: 217222.
35. Mulder J., Hokfelt T., Knuepfer M.M., Kopp U.C. Renal sensory and sympathetic nervesreinnervate the kidney in a similar time dependent fashion following renal denervationin rats // Am. J. Physiol. Regul. Integr. Comp. Physiol. 2013. DOI10.1152/ajpregu.00599.2012.
36. Grisk O., Grone H.J., Rose H.J., Rettig R. Sympathetic reinnervation of rat kidney grafts // Transplantation 2001; 72: 11531155.
37. Kline R.L., Mercer P.F. Functional reinnervation and development of supersensitivity to NE after renal denervation in rats // Am. J. Physiol. 1980; 238: R353R358.
38. De la Sierra A., Segura J., Banegas J.R., Gorostidi M., de la Cruz J.J., Armario P., Oliveras A., Ruilope L.M. Clinical features of 8295 patients with resistant hypertension classified onthe basis of ambulatory blood pressure monitoring // Hypertension 2011; 57: 898902.
39. Vaclavik J., Sedlak R., Plachy M., Navratil K., Plasek J., Jarkovsky J., Vaclavik T., Husar R., Kocianova E., Taborsky M. Addition of spironolactone in patients with resistant arterialhypertension (ASPIRANT): a randomized, doubleblind, placebocontrolled trial // Hypertension 2011; 57: 10691075.
40. Geisler B.P., Egan B.M., Cohen J.T., Garner A.M., Akehurst R.L., Esler M.D., Pietzsch J.B.Costeffectiveness and clinical effectiveness of catheterbased renal denervationfor resistant hypertension // J. Am. Coll. Cardiol. 2012; 60: 12711277.
41. Grassi G., Dell’Oro R., QuartiTrevano F., Scopelliti F., Seravalle G., Paleari F., Gamba P.L., Mancia G. Neuroadrenergic and reflex abnormalities in patients with metabolic syndrome // Diabetologia 2005; 48: 13591365.
42. Huggett R.J., Scott E.M., Gilbey S.G., Stoker J.B., Mackintosh A.F., Mary D.A. Impact of type 2 diabetes mellitus on sympathetic neural mechanisms in hypertension // Circulation 2003; 108: 30973101.
43. Mahfoud F., Schlaich M., Kindermann I., Ukena C., Cremers B., Brandt M.C., Hoppe U.C., Vonend O., Rump L.C., Sobotka P.A., Krum H., Esler M., Böhm M. Effect of renal sympatheticdenervation on glucose metabolism in patients with resistant hypertension: apilot study // Circulation 2011; 123: 19401946.
44. Witkowski A., Prejbisz A., Florczak E., Kadziela J., Sliwinski P., Bielen P., Michalowska I., Kabat M., Warchol E., Januszewicz M., Narkiewicz K., Somers V.K., Sobotka P.A., Januszewicz A. Effects of renal sympathetic denervation on blood pressure, sleepapnea course, and glycemic control in patients with resistant hypertension andsleep apnea // Hypertension 2011; 58: 559565.
45. Schlaich M.P., Straznicky N., Grima M., IkaSari C., Dawood T., Mahfoud F., Lambert E., Chopra R., Socratous F., Hennebry S., Eikelis N., Böhm M., Krum H., Lambert G., Esler M.D., Sobotka P.A. Renal denervation: a potential new treatment modality forpolycystic ovary syndrome? // J. Hypertens. 2011; 29: 991996.
46. Parati G., Esler M. The human sympathetic nervous system: its relevance in hypertensionand heart failure // Eur. Heart J. 2012; 33: 10581066.
47. Rundqvist B., Elam M., BergmannSverrisdottir Y., Eisenhofer G., Friberg P. Increasedcardiac adrenergic drive precedes generalized sympathetic activation in humanheart failure // Circulation 1997; 95: 169175.
48. Brandt M.C., Mahfoud F., Reda S., Schirmer S.H., Erdmann E., Böhm M., Hoppe U.C. Renal sympathetic denervation reduces left ventricular hypertrophy and improves cardiacfunction in patients with resistant hypertension // J. Am. Coll. Cardiol. 2012; 59: 901909.
49. Davies J.E., Manisty C.H., Petraco R., Barron A.J., Unsworth B., Mayet J., Hamady M., Hughes A.D., Sever P.S., Sobotka P.A., Francis D.P. Firstinman safety evaluation ofrenal denervation for chronic systolic heart failure: Primary outcome from REACH Pilot study // Int. J. Cardiol. 2013; 162: 189192.
50. Schlaich M.P., Socratous F., Hennebry S., Eikelis N., Lambert E.A., Straznicky N., Esler M.D., Lambert G.W. Sympathetic activation in chronic renal failure // J. Am. Soc. Nephrol. 2009; 20: 933939.
51. Inoue H., Zipes D.P. Changes in atrial and ventricular refractoriness and in atrioventricularnodal conduction produced by combinations of vagal and sympathetic stimulationthat result in a constant spontaneous sinus cycle length // Circ. Res. 1987; 60: 942951.
52. Ukena C., Mahfoud F., Spies A., Kindermann I., Linz D., Cremers B., Laufs U., Neuberger H.R., Böhm M. Effects of renal sympathetic denervation on heart rateand atrioventricular conduction in patients with resistant hypertension // Int. J. Cardiol. 2012. in press; DOI10.1016/j.ijcard.2012.07.027.
53. Ukena C., Bauer A., Mahfoud F., Schreieck J., Neuberger H.R., Eick C., Sobotka P.A., Gawaz M., Böhm M. Renal sympathetic denervation for treatment of electricalstorm: firstinman experience // Clin. Res. Cardiol. 2012; 101: 6367.
54. Pokushalov E., Romanov A., Corbucci G., Artyomenko S., Baranova V., Turov A., Shirokova N., Karaskov A., Mittal S., Steinberg J.S. A randomized comparison of pulmonaryvein isolation with versus without concomitant renal artery denervationin patients with refractory symptomatic atrial fibrillation and resistant hypertension // J. Am. Coll. Cardiol. 2012; 60: 11631170.
55. Linz D., Mahfoud F., Schotten U., Ukena C., Neuberger H.R., Wirth K., Böhm M. Renal sympathetic denervation suppresses postapneic blood pressure rises and atrial fibrillationin a model for sleep apnea // Hypertension 2012; 60: 172178.
56. Brandt M.C., Reda S., Mahfoud F., Lenski M., Böhm M., Hoppe U.C. Effects of renal sympatheticdenervation on arterial stiffness and central hemodynamics in patients withresistant hypertension // J. Am. Coll. Cardiol. 2012; 60: 19561965.
57. Mahfoud F., Himmel F., Ukena C., Schunkert H., Böhm M., Weil J. Treatment strategiesfor resistant arterial hypertension // Dtsch Arztebl. Int. 2011; 108: 725731.
58. Ormiston J., Watson T., van Pelt N., Stewart R., Haworth P., Stewart J., Webster M. Firstreport of the 6month first in human results of the OneShotTM renal denervation system: the RHAS study // J. Am. Coll. Cardiol. 2012; 60 (Suppl. B): TCT212.
59. Mabin T., Sapoval M., Cabane V., Stemmett J., Iyer M. First experience with endovascular ultrasound renal denervation for the treatment of resistant hypertension // EuroIntervention 2012; 8: 5761.