Журнал «Медико-социальные проблемы семьи» 1 (том 16) 2011
Вернуться к номеру
Показатели перекисного окисления липидов при комбинированном малоинвазивном хирургическом лечении лимфедемы конечностей
Авторы: И.Н. Щербинин, ООО Центр лимфохирургии им. Н. Шматкова
Рубрики: Акушерство и гинекология
Разделы: Клинические исследования
Версия для печати
У представленій статті розглянуто вплив на рівень оксидативного стресу заощадлювального хірургічного лікування хворих із хронічною лімфедемою. Отримані дані демонструють збільшене формування кисневих радикалів і активізацію процесів перекісного окиснення ліпідів у хронічній лімфедематозній тканині. Автор визначав біомаркери проокислювальних реакцій і антиокислювальної системи захисту в еритоцитах і плазмі крові в пацієнтів із хронічною лімфедемою після ліпосакції з озоном, і підшкірного дренування (n=38) у порівнянні з пацієнтами, яким виконано накладення лімфовенозного анастомозу. Активність процесів ПОЛ була продемонстрована звільненням малонового діальдегіду в сироватку крові навіть після накладення лімфовенозного дренажу
В представленной статье рассмотрено влияние на уровень оксидативного стресса щадящего хирургического лечения больных с хронической лимфедемой. Полученные данные демонстрируют увеличенное формирование кислородных ра-дикалов и активизацию процессов перекисного окисления липидов в хронической лимфедематозной ткани. Автор определял биомаркеры проокислительных реакций и антиокислительной системы защиты в эритоцитах и плазме крови у пациентов с хронической лимфедемой после липосакции с озоном, и подкожного дренирования (n=38) в сравнении с пациентами, которым выполнено наложение лимфовенозного анастомоза. Активность процессов ПОЛ была продемонстрирована освобождением малонового диальдегида в сыворотку крови даже после наложения лимфовенозного дренажа
The miniinvasive surgery treatment on the oxidative stress influence in chronic lymphedema patients is discussed in the article. This data demonstrate enhanced formation: of reactive oxygen species and accelerated lipid peroxidation processes in chronic lymphoedematous tissue. Author obtained venous blood samples from patients (n=38) with chronic lymphoedema after liposuction with ozon and subcutaneous drainage determined biomarkers of prooxidative reactions and of antioxidative defense system in the erythrocytes or blood plasma compared with the patients whom performed limphovenous anastomosis. Accelerated free radical formation and lipid peroxidation processes were further demonstrated by the liberation of MDA into the blood serum after lymphovenous drainage
лімфедема, хірургічне лікування, оксидативний стрес
лимфедема, хирургическое лечение, оксидативный стресс
lymphedema, surgical treatment, oxidative stress
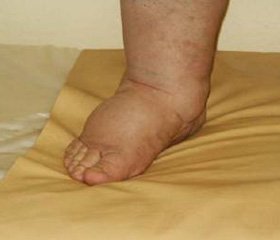
Хронический лимфостаз является в настоящее время одним из самых трудноизлечимых страданий, развиваясь как первично, так и вторично в результате травм, инфекционно-воспалительных и онкологических заболеваний [1]. При этом, из-за ограничения транспортной возможности лимфатических сосудов, происходит увеличение интерстициальных объемов жидкости и внутритканевого давления. В отличие от других видов отека, лимфедему характеризует капиллярно-тканевая «утечка» белка, морфологическое и функциональное повреждение эндотелиальных клеток, склероз и сокращение количества гладких мышечных клеток в лимфатических коллекторах и сосудах. С другой стороны, лимфедему можно рассматривать как «патологическую» модель ишемически реперфузионного повреждения тканей. В этих условиях развивается регионарный кислородный дефицит и активация процессов свободнорадикального окисления [2]. Восстановление микроциркуляторной перфузии путем дренирования и удаления избытков тканевой жидкости в комплексе с гипероксигенацией может изменить течение лимфедемы. Локальная озонотерапия способна уменьшать объем локальных жировых отложений, возможно, разрушая жировую ткань в месте введения [3], однако механизм действия этого вида лечения, тем более в комбинации с липосакцией исследован недостаточно.
Цель исследования: изучить процессы перекисного окисления липидов и антиоксидантной защиты при хронической лимфедеме конечностей и оценить влияние на них комбинированного малоинвазивного хирургического лечения с применением озонотерапии и липосакции.
Материалы и методы
В сравнительном аспекте нами изучены концентрации восстановленного и окисленного глутатнона (GSH и GSSG) эритоцитов и малонового диальдегида (MDA) в плазме крови пациентов, оперированных по поводу лимфедемы с использованием малоинвазивных методик хирургического лечения в сроки 4,0±2,7 лет после хирургического или комбинированного лечения опухолей. У всех пациентов отсутствовал рецидив опухоли или метастазы.
Первую группу составили 38 пациентов (31 женщина и 7 мужчин), которым в комплексе хирургического лечения лимфедемы проведена липосакция после тьюминесцентного введения озоновой смеси и подкожное дренирование спиральными дренажами. 20 пациентов страдали лимфедемой нижних конечностей, 13 имели лимфедему рук и у пятерых было сочетание поражения конечностей. У восьмерых пациенток с хронической лимфедемой рук комплекс хирургического лечения дополнен наложением бесшовного лимфовенозного анастомоза по оригинальной методике [4]. Средний возраст пациентов был 50,6±13,6 лет.
Вторую группу составили 20 пациентов с лимфостазом, для лечения которого использовано наложение бесшовного лимфовенозного анастомоза без проведения дренирования и липосакции. Средний возраст в этой группе был 48,2±14,6 лет (16 женщин и четверо мужчин).
Контрольная группа (группа 3) состояла из 20 здоровых людей (12 женщин, 8 мужчин). Средний возраст был 48,1±15,7 лет.
Все лечившиеся пациенты не принимали антиокисидантов, таких как витамин Е или аскорбиновая кислота, и не имели признаков обострения инфекционных кожных процессов.
Забор крови проведен из подкожных вен рук (в случае наличия у пациентов лимфедемы руки – из вены контралатеральной руки). После добавления антикоагулянта плазма сепарирована центрифугированием для анализа MDA. Для анализа GSH и концентрации GSSG, цельную кровь соединяли с метафосфорной кислотой и сохраняли при 4 °C, затем центрифугировали до 10 мин. при 1200 g. Супернатант был разделен на две пробы. Концентрацию общего глутатиона в плазме крови определяли с использованием 5,5-дитио-бис (2-нитробензойной) кислоты (реактив Эллмана) [5] с последующим измерением поглощения на длине волны 412 нм. Определение GSH и GSSG в эритроцитах проводили при помощи палладиево-хлорпромазиновой реакции с последующим измерением оптической плотности на фотометре при длине волны 578 нм против воды, используя кварцевую кювету [6]. Аутоокисление GSH предотвращали добавлением 50ммоль N-ethylmaleimide. MDA определяли по тесту с тиобарбитуровой кислотой в сыворотке крови. В сыворотке определяли спонтанный и стимулированный уровни МДА, в суспензии клеток определяли стимулированный уровень МДА[7]. Статистическое определение различий в группах были проверены с использованием t-теста, p <0,05 расценивали как существенные.
Результаты и их обсуждение
Для получения газовой смеси озона использовали аппарат «ОЗОН УМ-80». Концентрацию озона в газовой смеси калибровали методами прямого измерения (титрование йодидом калия). Для осуществления подкожных обкалываний кислородно-озоновой газовой смесью применяли стандартные одноразовые шприцы емкостью 10, 20 или 50 мл и иглы 30-32 G диаметром 0,4 мм и менее. Концентрацию озона применяли при значениях 5 мг/л в объеме 300-600мл на зону.
Липосакция производилась через многочисленные 3-миллиметровые разрезы полыми канюлями с внешним диаметром 3 мм (длина 15 см, три отверстия в наконечнике) и 4 мм диаметром (16 см, два отверстия). Система была соединена с вакуумным насосом, который позволял достичь отрицательного атмосферного давления 0,7-0,9. Использовалась «сухая техника» без местного введения адреналина.
Через разрезы при помощи троакаров подкожно устанавливали спиральные дренажи открытыми для лимфооттока. Накладывалась компрессионная повязка для гемостаза и профилактики отека. Средняя продолжительность операции составила 122±31 минуты. В течение первых 24 часов внутривенно назначали цефалоспорин, а затем в течение двух недель использовали таблетированную форму препарата.
Исследование показателей ПОЛ и АОЗ проводили до операции, через 24 часа и через 5 суток после вмешательства. У пациентов 2 группы с лимфедемой содержание GSH в эритроцитах уменьшалось приблизительно на 20 % (рис. 1), тогда как содержание GSH в основной группе не отличалось от здоровых.GSSG было увеличено в 2 раза по сравнению с любой из остальных групп. Уменьшенное содержание GSH и увеличенное GSSG привели к тройному возрастанию соотношения глутатиона GSH/GSSG (0,088±0,012 против 0,036±0,014).
/13/13.jpg)
Это увеличение может быть рассмотрено как индикатор оксидативного стресса в эритроцитах пациентов с нераздренированной хронической лимфедемой.
Липосакцией с последующим подкожным дренированием спиральными дренажами достигается эвакуация отечной жидкости и патологически измененных тканей. Накладываемый бандаж уменьшает дополнительное формирование соединительнотканной жидкости. Тогда как приведенные таблица и рисунок 2 показывают, что лимфовенозный дренаж привел к увеличению содержания MDA в сыворотке и в эритроцитах, т.е. к транслокации продуктов ПОЛ и напряжению антиоксидантных систем.
Содержание MDA увеличилось приблизительно на 20 % в первые сутки и продолжало быть повышенным как результат функционирования анастомоза.
/13/13_3.jpg)
Повышение содержания GSSG и MDA у пациентов с лимфедемой подтверждает гипотезу, что процессы ПОЛ активно протекают в хронической лимфедематозной ткани, сопровождаясь тройным ростом уровня сывороточного MDA.
Источниками этой ускоренной генерации свободных радикалов и продуктов ПОЛ при хронической лимфедеме, вероятно, является региональная гипоксия / реперфузия. Концентрация продуктов ПОЛ определяется темпом формирования и деградации этих продуктов.
Рисунок 3 показывает обратную взаимосвязь между MDA и GSH. Высокая концентрация сывороточного MDA связана с пониженным уровнем эритроцитарного GSH.
/13/13_4.jpg)
Фактически, уровень продуктов ПОЛ зависит от суммарного объема отечной жидкости. По нашим данным, в среднем объем пораженных тканей ног составил 4,1±2,2л, объем рук был в диапазоне 0,59±0,55 л.Становится понятным почему уровень малонового диальдегида был выше у пациентов с лимфедемой нижних конечностей по сравнению с пациентами с поражением рук.
Очевидно, что у пациентов с более выраженными отеками повышен выброс альдегидов в кровоток, приводя к более высоким уровням концентрации их в крови и сыворотке. Таким образом, чем выше объем лимфедематозной жидкости, тем выше окислительный стресс для организма в целом, а изменения его параметров связаны с именно с наличием лимфедемы. Даже хорошо, и по показаниям выполненная лимфодренирующая операция не всегда дает стойкую редукцию отека без поддерживающей терапии и профилактических мероприятий.
Выводы
Таким образом, липосакция с использованием озоно-кислородной смеси и микролимфатическое дренирование в сочетании с бандажированием дают положительный результат и позволяют значительно повысить эффективность комплексного лечения такого сложного заболевания, как хронический лимфостаз конечностей, за счет активной разгрузки систем антиокислительной защиты.
- Lymphedema: a comprehensive review / A.G. Warren, H. Brorson, L.J. Borud, S.A. Slavin // Ann. Plast. Surg. – 2007. – Vol. 59, № 4. – P. 464-472.
- Малинин A.A. Комплексное лечение лимфедемы и повреждений лимфатических сосудов (клинико-экспериментальное исследование): дис. ... д-ра мед. наук / A.A. Малинин. – M., 2005. – 261 c.
- Leffell. D.J. The definitive guide to whole skin care for life total skin / D. J. Leffell. – New York: Hyperioni, 2000. – 423 p.
- Шматков Н.П. Катетеризация лимфатических cосудов (новая методика и техническое обеспечение): дис. ... канд. мед. наук / Н.П. Шматков. – Донецк, 1987. – 128 c.
- Beutler E. Improved method for the determination of blood glutathione / E. Beut-ler, O. Duron, B.M. Kelly // J. Lab. Clin. Med. – 1963. – Vol. 61. – P. 882–886.
- Hissin P.J. A fluorimetric method for determination of oxidized and reduced glutathione in tissues / P.J. Hissin, R. Hilf // Anal. Biochem. – 1976. – Vol. 74. – P. 371–377.
- Lipoperoxides in plasma as measured by liquid-chromatographic separation of malondialdehyde-thiobarbituric acid adduct / S.H.J. Wong, J.A. Knight, S.M. Hopfer [et al.] // Clin. Chem. – 1987. – Vol. 33. – P. 214–220.

/13/13_2.jpg)