Журнал «Медико-социальные проблемы семьи» 3-4 (том 17) 2012
Вернуться к номеру
Ефективність протоколів допоміжної репродуктивної технології з диференційованим підходом щодо проведення контрольованої оваріальної стимуляції в пацієнток із хронічною гіперандрогенною ановуляцією залежно від результатів тестування на поліморфізм генів FSHR та ESR2 та з попередньою підготовкою флутамідом
Авторы: Борис О.М. - Український державний інститут репродуктології Національної академії післядипломної освіти ім. П.Л. Шупика, м. Київ
Рубрики: Акушерство и гинекология
Разделы: Клинические исследования
Версия для печати
У статті доведено, що використання протоколів допоміжної репродуктивної технології з диференційованим підходом щодо проведення контрольованої стимуляції овуляції в пацієнток із хронічною гіперандрогенною ановуляцією залежно від тестування на поліморфізм генів FSHR та ESR2 і з попереднім застосуванням антиандрогену флутаміду вірогідно знижує тривалість стимуляції в 1,08 раза (р < 0,0001), загальний витрачений рекомбінантний фолікулостимулюючий гормон — в 1,06 (р < 0,009), рівень естрадіолу й прогестерону в день введення тригерної дози хоріонічного гонадотропіну людини — в 1,31 (р < 0,0001) і 1,19 (р < 0,0001), зменшує число випадків синдрому гіперстимуляції яєчників середнього ступеня в 1,57 раза (p < 0,0003) і приводить до відсутності цього синдрому тяжкого ступеня, при цьому якість отриманих овоцитів й ембріонів відповідно до кумулятивного числа вагітностей і пологів вірогідно не відрізняється.
В статье доказано, что использование протоколов вспомогательной репродуктивной технологии с дифференцированным подходом к проведению контролируемой стимуляции овуляции у пациенток с хронической гиперандрогенной ановуляцией в зависимости от тестирования на полиморфизм генов FSHR и ESR2 и предшествующим применением антиандрогена флутамида достоверно снижает продолжительность стимуляции в 1,08 раза, общий затраченный рекомбинантный фолликулостимулирующий гормон — в 1,06, уровень эстрадиола и прогестерона в день введения триггерной дозы хорионического гонадотропина человека — в 1,31 (р < 0,0001) и 1,19
(р < 0,0001), уменьшает число случаев синдрома гиперстимуляции яичников средней степени в 1,57 раза и приводит к отсутствию этого синдрома тяжелой степени, при этом качество полученных овоцитов и эмбрионов соответственно кумулятивному числу беременностей и родов достоверно не отличается.
It is shown that the use of ART protocols differentiated approach to conducting controlled ovulation stimulation in patients with chronic hyperandrogenic anovulation depending on testing FSHR and ESR2 gene polymorphism and previous use of antiandrogen flutamide significantly reduces the duration of stimulation by 1.08 times, the total spent rFSH — by 1.06, the level of E2 and progesterone in the day of administration of HCG trigger dose — by 1.31 and 1.19 times, reduces the incidence of moderate OHSS by 1.57 times and leads to the absence of severe OHSS, while the quality of the oocytes and embryos of cumulative number of pregnancies and births respectively have no significantdifferent.
Допоміжні репродуктивні технології, контрольована оваріальна стимуляція, генетичне тестування, генетичний поліморфізм, ген FSHR, ген ESR2, флутамід.
Вспомогательные репродуктивные технологии, контролируемая овариальная стимуляция, генетическое тестирование, генетический полиморфизм, ген FSHR, ген ESR2, флутамид.
Assisted reproductive technology, controlled ovarian stimulation, genetic testing, genetic polymorphisms, FSHR gene, ESR2 gene, flutamide.
Гормональна дисрегуляція спричинює низку захворювань і патологічних станів, зокрема в репродуктивній системі організму. Ендокринна ановуляторна безплідність найчастіше характеризується гіперандрогенією [1–3, 6, 9, 14, 18, 22].
Джерелами синтезу андрогенних гормонів у жіночому організмі є яєчники та кора надниркових залоз. Надмірний синтез тестостерону (Т) та андростендіону може бути зумовлений наявністю гормонопродукуючої пухлини, генетичними дефектами ферментів біосинтезу стероїдів або порушенням гіпоталамо-гіпофізарної регуляції функції гонад. Функціональна гіперандрогенія достатньо поширена в жіночій популяції і призводить до низки патологічних змін — від косметичних вад (гірсутизм, вугрова хвороба, андрогенна алопеція, себорея) до синдрому полікістозних яєчників (СПКЯ) із притаманними йому ускладненнями — порушенням менструальних циклів, ановуляторною безплідністю, метаболічним синдромом тощо [7, 8, 10, 15, 16–21].
Для реалізації жіночої репродуктивної функції застосовують хірургічні втручання або стимуляцію кломіфеном, інгібіторами ароматази, препаратами гонадотропних гормонів, при невдачах призначають допоміжні репродуктивні технології (ДРТ) [2, 11, 12, 23].
Але функціональна гіперандрогенія зменшує ймовірність успіху контрольованої оваріальної стимуляції. Тому продовжуються пошуки шляхів її вдосконалення. У комплексному лікуванні СПКЯ застосовують, зокрема, комбіновані оральні контрацептиви, особливо такі, до складу яких входять синтетичні прогестини з антиандрогенними властивостями — ципротерону ацетат, дієногест, дроспіренон. Раніше у відділі ендокринології репродукції та адаптації ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України» під керівництвом чл.-кор. НАН і НАМН України, проф. О.Г. Рєзнікова була експериментально обґрунтована доцільність використання нестероїдного антиандрогенного засобу флутаміду для подолання андрогенної блокади яєчників [4, 13]. Після проведення клінічних випробувань під керівництвом професорів Т.Ф. Татарчук (ДУ «Інститут педіатрії, акушерства та гінекології НАМНУ») і В.Я. Голоти (Національний медичний університет ім. О.О. Богомольця) було розширено терапевтичні показання до застосування, а саме для нормалізації менструальної функції у жінок із хронічною гіперандрогенною ановуляцією. Ми припустили, що подолання андрогенної блокади овуляції за допомогою нестероїдних антиандрогенів, наприклад флутаміду, якому не властива супутня гормональна дія, дасть можливість підвищити ефективність контрольованої оваріальної стимуляції при ановуляторній безплідності гіперандрогенного походження.
Оптимальний протокол контрольованої оваріальної стимуляції при хронічній гіперандрогенній ановуляції, що забезпечив би адекватний фолікулогенез та отримання достатньої кількості зрілих овоцитів високої якості і мав мінімальну ймовірність ускладнень [6], ще на стадії обговорення: потребують подальшого порівняння циклів ДРТ із використанням антагоністів і агоністів гонадотропного рилізинг-гормону (ГнРГ), відкритим залишається питання застосування флутаміду.
Є відомості, що в жінок з ановуляцією, у тому числі асоційованою з гіперандрогенією, існують мутації рецепторів гена фолікулостимулюючого гормону (ФСГ) (FSHR) та рецепторів гена естрадіолу (Е2) (ЕSR2), що можуть привести до ненастання вагітності та розвитку синдрому гіперстимуляції яєчників (СГЯ) у циклах ДРТ [5, 17, 19]. Потрібні подальші генетичні дослідження з цього питання. Доцільною є розробка протоколів циклів ДРТ із диференційованим підходом щодо проведення конт-рольованої стимуляції овуляції в пацієнток із хронічною гіперандрогенною ановуляцією залежно від тестування на поліморфізм генів FSHR та ESR2 та попереднім застосуванням антиандрогену флутаміду.
Метою дослідження стало підвищення ефективності лікування хворих із хронічною гіперандрогенною ановуляцією шляхом розробки протоколів циклів ДРТ із диференційованим підходом до проведення залежно від тестування на поліморфізм генів FSHR та ESR2 та попередньою підготовкою нестероїдним антиандрогеном флутамідом.
Матеріал та методи
Обстежені 205 пацієнток групи з хронічною гіперандрогенною ановуляцією (ХГА), які не відповіли на медикаментозну та ендохірургічну стимуляцію овуляції. Вони були стратифіковані у дві групи залежно від розподілу генотипів генів FSHR і ESR2 та виду проведення програми ДРТ:
— основна група (О, n = 103) — підготовка 3 місяці флутамідом по 0,25 тричі на добу, диференційоване проведення циклів ДРТ залежно від ризику СГЯ помірного та тяжкого ступеня на підставі вивчення генетичного поліморфізму генів FSHR і ESR2. У жінок із високим ризиком СГЯ помірного та тяжкого ступеня проведення короткого протоколу контрольованої оваріальної стимуляції з використанням антагоністів ГнРГ, в інших жінок — проведення довгого протоколу контрольованої оваріальної стимуляції з агоністами ГнРГ;
— група порівняння (П, n = 102) — проведення традиційного довгого протоколу контрольованої оваріальної стимуляції з агоністами ГнРГ усім жінкам.
Групу ІІ становили 130 пацієнток, у яких під час проходження лікування з приводу різних видів безплідності за програмою ДРТ не розвинувся СГЯ.
Контрольну групу (К) сформували 99 гінекологічно та соматично здорових жінок із нормальною плідністю, із самостійними вагітностями в анамнезі, що закінчилися пологами.
Визначення гормонів сироватки крові здійснювалося методом імуноферментного твердофазного аналізу за допомогою стандартних наборів DRG Diagnostics і Bioserv (Німеччина).
Геномна ДНК із зразків крові була виділена за допомогою наборів GenуJet DNA purification Kit (Fermentas). Вимірювання концентрації виділеної із зразків крові ДНК проводили на флюориметрі Nanodrop із використанням барвника SybrGreenI. Ампліфіцікацію проводили методом мультиплексної TouchDown полімеразної ланцюгової реакції з HotStartTag DNA Polymerase з використанням набору Maxima Hot Start PCR master mix (Fermentas) і 10 пкмоль специфічних праймерів для аналізованих SNP досліджуваних генів: 95 °С — 15 хв, 10 циклів 95 °С — 30 с, 65 °С — 1 хв, із зниженням температури на 1,0 градус/цикл; 30 циклів, 95 °С — 30 с; 60 °С — 30 с, 72 °С — 45 с, 72 °С — 10 хв на термоциклері MJR і ICycler. Дизайн праймерів був розроблений за допомогою програми PSQ Assay Desing (Biotage). Синтез праймерів був проведений фірмою «Синтол» (Росія).
Аналіз SNP проводили методом піросеквенування з використанням набору Pyro Gold Reagents фірми Qiagen і 0,3 мМ специфічних секвенуючих праймерів до досліджуваних SNP згідно з методикою піросеквенування (Qiagen). Аналіз поліморфізму проводили на приладі PyroMark Q96 MA.
Отримані результати обробляли на ЕОМ типу IВM PC із застосуванням електронної таблиці Microsoft Excel.
Результати та їх обговорення
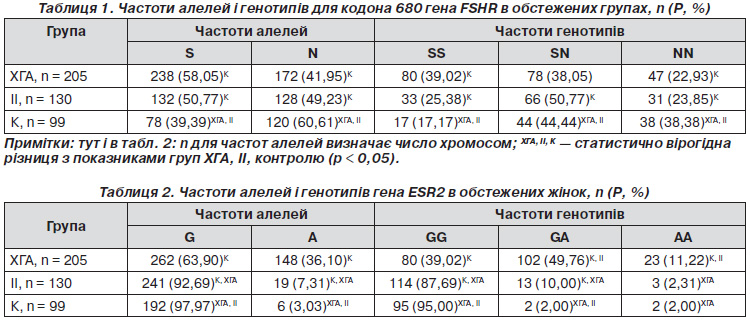
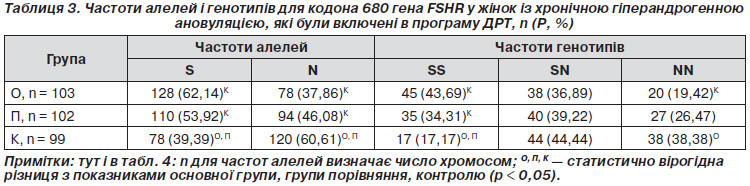
У всіх 205 пацієнток із хронічною гіперандрогенною ановуляцією, які були включені до програми ДРТ, було проведено дослідження алелей і генотипів для кодона 680 генів FSHR і ESR2 (табл. 1, 2).
Як видно з табл. 1, частоти алелей для поліморфізму S680N становили 58,05 % S і 41,95 % N у групі пацієнток із хронічною гіперандрогенною ановуляцією, що порівняно з відповідними частотами в контрольній групі плідних жінок для алелі S було більше в 1,47 (рК < 0,0001), а для алелі N — менше в 1,44 раза (рК < 0,0001). Відмінності між цими частотами не були статистично вірогідними при порівнянні програм ДРТ контрольної групи пацієнток із групою пацієнток із хронічною гіперандрогенною ановуляцією.
Частоти генотипів гена FSHR у положенні 680 у групі пацієнток із хронічною гіперандрогенною ановуляцією становили 39,02 % SS; 38,05 % SN і 22,93 % NN, що порівняно з відповідними частотами в контрольній групі плідних жінок для генотипу SS було більше в 2,27 (рК < 0,0001), а для алелей SN і NN — менше відповідно в 1,17 (рК < 0,05) та 1,67 раза (рК < 0,005) (табл. 1).
Відмінності між цими частотами не були статистично вірогідними при порівнянні програм ДРТ контрольної групи пацієнток із пацієнтками з хронічною гіперандрогенною ановуляцією.
Як видно з табл. 2, у групі пацієнток із хронічною гіпер-андрогенною ановуляцією частоти алелей для поліморфізму GA гена ESR2 становили 63,90 % G і 36,10 % А, що для алелі G було менше, ніж у контрольній групі плідних жінок, в 1,53 раза (рК < 0,0001), а для алелі А — більше в 11,91 раза (рК < 0,0001). При порівнянні частоти алелей у контрольній групі пацієнток програми ДРТ із групою пацієнток із хронічною гіперандрогенною ановуляцією зареєстровано зменшення в останній частоти алелі G в 1,45 раза (р < 0,0001) і збільшення алелі А в 4394 рази (р < 0,0001).
Частоти генотипів гена ESR2 становили 39,02 % GG; 49,76 % GA і 11,22 % AA, що для генотипу GG було менше, ніж у контрольній групі плідних жінок, у 2,43 раза (рК < 0,0001), а для генотипів GA і АА — більше відповідно в 24,88 (рК < 0,0001) і 5,61 раза (рК < 0,007). При порівнянні частоти генотипів у контрольній групі пацієнток програми ДРТ із групою пацієнток із хронічною гіперандрогенною ановуляцією зареєстровано зменшення в останній частоти генотипу GG у 2,25 раза (р < 0,0001), збільшення частоти генотипів GA в 4,98 (р < 0,0001) і AA — у 4,86 раза (р < 0,003) (табл. 2).
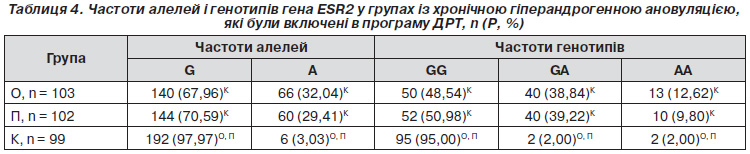
У зв’язку з тим що при проведених нами раніше дослідженнях установлено, що в пацієнток із хронічною гіперандрогенною ановуляцією порівняно з плідними жінками найбільш характерне збільшення частоти генотипу GA для гена ESR2 у 24,88 раза, а при поєднанні гетерозиготних генотипів SN за геном FSHR і GA за геном ESR2 ризик виникнення СГЯ збільшується втричі (ВШ = 3,1; ДІ 95% 2,5–3,6), усі пацієнтки групи ХГА були стратифіковані у дві групи залежно від розподілу генотипів гена ESR2 та виду проведення програми ДРТ: основну та групу порівняння.
Частоти алелей для поліморфізму S680N становили 62,14 % S і 37,86 % N в основній групі, 53,92 % S і 46,08 % N — у групі порівняння (табл. 3). Відмінності між цими частотами не були статистично вірогідними. При порівнянні контрольної групи плідних жінок із пацієнтками основної групи і групи порівняння в останній виявлено збільшення частоти алелі S відповідно в 1,58 (рО–К < 0,0001) і в 1,37 раза (рП–К < 0,004), зниження частоти алелі N — в 1,60 (рО–К < 0,0001) і в 1,32 раза (рП–К < 0,004).
Частоти генотипів гена FSHR у положенні 680 становили 43,69 % SS; 36,89 % SN і 19,42 % NN в основній групі; 34,31 % SS; 39,22 % SN і 26,47 % NN — у групі П (табл. 3). Не виявлено вірогідних відмінностей між розподілом цих частот. При порівнянні контрольної групи плідних жінок із пацієнтками основної групи і групи порівняння в останніх виявлено збільшення частоти генотипу SS відповідно в 2,54 (рО–К < 0,0001) і у 2,00 раза (рП–К < 0,006) і зниження частоти генотипу NN — в 1,98 (рО–К < 0,003) і в 1,45 раза (рП–К > 0,05). Не було виявлено вірогідної різниці між частотою генотипу SN у групах: основній, порівняння і контролю.
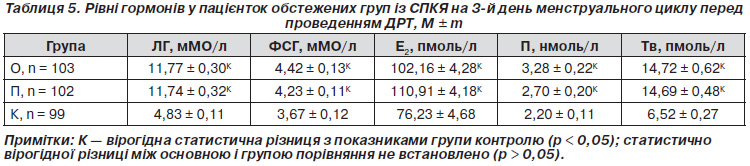
Частоти алелей для поліморфізму GA гена ESR2 становили 67,96 % G і 32,04 % А в основній групі, 70,59 % G і 29,41 % А — у групі порівняння (табл. 4). Відмінності між цими частотами не були статистично вірогідними. При порівнянні контрольної групи плідних жінок із пацієнтками основної групи і групи порівняння в останніх виявлено зменшення частоти алелі G відповідно в 1,44 (рО–К < 0,0001) і в 1,39 раза (рП–К < 0,004), збільшення частоти алелі А — у 10,57 (рО–К < 0,0001) і в 9,71 раза (рП–К < 0,004).
Частоти генотипів гена ESR2 становили 48,54 % GG; 38,84 % GA і 12,62 % AA в основній групі; 50,98 % GG; 39,22 % GA і 9,80 % AA — у групі порівняння. Не виявлено вірогідних відмінностей між розподілом цих частот. При порівнянні контрольної групи плідних жінок із пацієнтками основної і групи порівняння в останніх виявлено зниження частоти генотипу GG відповідно в 1,96 (рО–К < 0,0001) і в 1,86 раза (рП–К < 0,0001), підвищення частоти генотипу GA в 19,42 (рО–К < 0,0001) і в 19,61 раза (рП–К < 0,0001) і генотипу АА — у 6,31 (рО–К < 0,005) і в 4,90 раза (рП–К < 0,02).
Таким чином, розподіл генів рецепторів ФСГ та Е2 в обстежених пацієнток із хронічною гіперандрогенною ановуляцією основної групи та групи порівняння є гомогенним, що дозволяє порівнювати результати проведення контрольованої оваріальної стимуляції в циклах ДРТ.
Вік обстежених жінок коливався від 21 до 37 років і в середньому в основній групі становив 30,06 ± 0,32 року, у групі порівняння — 31,08 ± 0,34 року, у контрольній групі — 30,44 ± 0,38 року і вірогідно між групами не відрізнявся.
Обстежені основної групи і групи порівняння гомогенні за віком, розподілом за віковими категоріями, соціальним статусом, частотою тютюнопаління та середньою кількістю випалених сигарет, за антропометричними показниками та розподілом статури, окружністю талії та стегон, середнім гірсутним числом, наявністю акне та вираженістю ступеня вугрової хвороби, характеристиками менструальної функції, початком статевого життя, розподілом первинної та вторинної безплідності, середньою тривалістю безплідності, репродуктивним, інфекційним, соматичним анамнезом, розмірами яєчників та матки, рівнем гонадотропних та статевих гормонів, що дає можливість порівнювати їх при проведенні контрольованої оваріальної стимуляції.
Уміст лютеїнізуючого гормону (ЛГ) у пацієнток основ-ної групи перевищував такий у контролі у 2,44 раза (рО–К < 0,0001) і в групі порівняння — у 2,43 (рП–К < 0,0001, рО–П > 0,05); ФСГ — в 1,20 (рО–К < 0,0001) і в 1,15 (рП–К < 0,0001, рО–П > 0,05); Е2 — в 1,49 (рО–К < 0,0001) і в 1,45 (рП–К < 0,0001, рО–П > 0,05); прогестерону — в 1,49 раза (рО–К < 0,0001) і в 1,23 (рП–К < 0,0001, рО–П > 0,05); Тв — у 2,23 раза (рО–К < 0,0001) і в 2,25 (рП–К < 0,0001, рО–П > 0,05) (табл. 5).
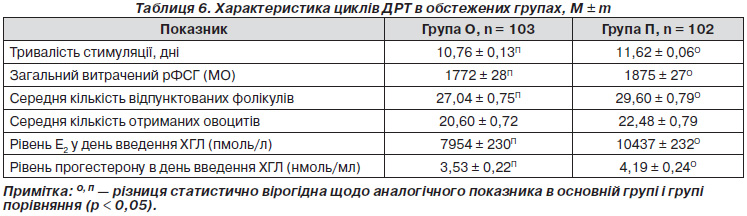
Як показав аналіз проведених циклів ДРТ в обстежених групах, в основній групі тривалість контрольованої оваріальної стимуляції вірогідно була меншою за таку в циклах пацієнток групи порівняння в 1,08 раза (р < 0,0001), загальний витрачений рФСГ — в 1,06 (р < 0,009), рівень Е2 у день введення тригерної дози хоріонічного гонадотропіну людини (ХГЛ) — в 1,31 (р < 0,0001), рівень прогестерону в день введення тригерної дози ХГЛ — в 1,19 (р < 0,0001) (табл. 6).
В основній групі було відпунктовано усього 2785 фолікулів, у групі порівняння — 3019 і отримано відповідно 2122 (76,19 %) і 2293 (75,95 %) овоцити. Як видно з табл. 6, незважаючи на те що загальна кількість відпунктованих фолікулів в основній групі перевищувала таку в групі порівняння на 234 фолікули, а отриманих овоцитів — на 171, обстежені групи статистично вірогідно не відрізнялися за середньою кількістю отриманих овоцитів (20,60 ± 0,72 проти 22,48 ± 0,79).
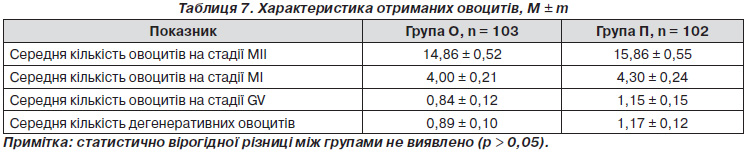
Проведено вивчення якості отриманих овоцитів від обстежених пацієнток. В основній групі було отримано 1531 (72,15 %) овоцит на стадії МІІ, 412 (19,42 %) — на стадії МІ, 87 (4,10 %) — на стадії GV, 92 (4,34 %) — дегенеративні форми овоцитів, у групі порівняння на стадії МІІ — 1618 (70,56 %), на стадії МІ — 439 (19,15 %), на стадії GV — 117 (5,10 %), дегенеративних форм овоцитів — 119 (5,19 %) (р > 0,05).
Як видно з табл. 7, розподіл середньої кількості зрілих, недозрілих та дегенеративних форм овоцитів по групах був гомогенним.
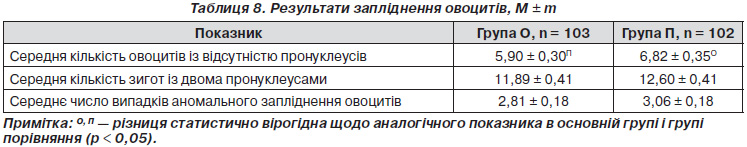
В основній групі після запліднення овоцитів спермою чоловіка утворилося 608 (28,65 %) овоцитів із відсутністю пронуклеусів, 1225 (57,73 %) — зиготи з двома пронуклеусами, у 289 (13,62 %) випадках відбулося аномальне запліднення. У групі порівняння після запліднення овоцитів спермою чоловіка утворилося 696 (30,35 %) овоцитів із відсутністю пронуклеусів, 1285 (56,04 %) зигот із двома пронуклеусами, у 312 (13,61 %) випадках зареєстровано аномальне запліднення. Тобто коефіцієнт запліднення становив в основній групі 57,73 %, у групі порівняння — 56,04 % і вірогідно між групами не відрізнявся.
Середня кількість овоцитів із відсутністю пронуклеусів була в основній групі менша, ніж у групі порівняння, на 0,92 пронуклеуса (p < 0,05). Обстежені групи вірогідно статистично не відрізнялися за розподілом середньої кількості нормально (11,89 ± 0,41 проти 12,60 ± 0,41) та аномально (2,81 ± 0,18 проти 3,06 ± 0,18) запліднених овоцитів (табл. 8).
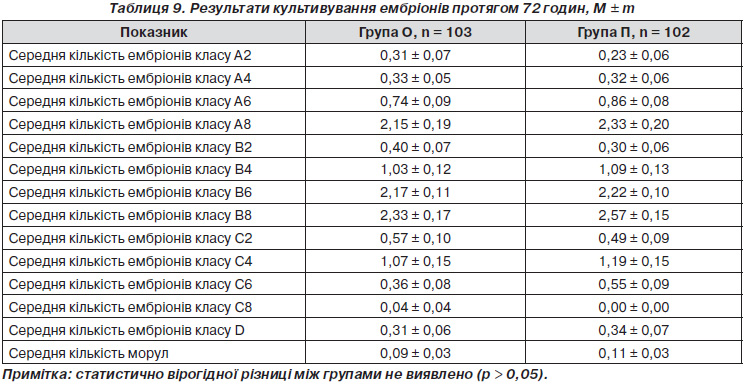
Через 72 години з початку культивування ембріонів в основній групі отримано 1225 ембріонів: 363 (29,63 %) ембріонів класу А, 611 (49,88 %) — класу В, 210 (17,14 %) — класу С, 32 (2,61 %) — класу D, 9 (0,73 %) морул. У групі порівняння отримано усього 1285 ембріонів: 382 (29,73 %) ембріони класу А, 630 (49,03 %) — класу В, 227 (17,67 %) — класу С, 35 (2,72 %) — класу D, 11 (0,86 %) — морули (р > 0,05). Виявлено, що через 72 години з початку культивування ембріонів обстежені групи вірогідно статистично не відрізнялися за розподілом середньої кількості ембріонів класу А2, А4, А6, А8, В2, В4, В6, В8, С2, С4, С6, С8, D, морул (табл. 9).
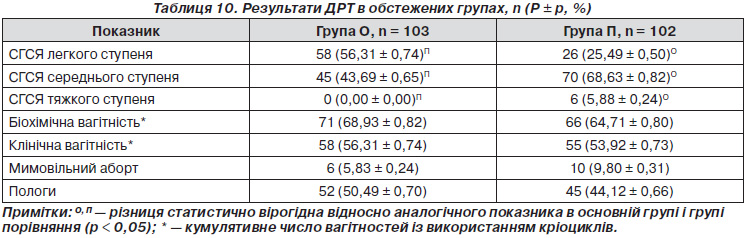
При аналізі результатів проведених циклів ДРТ встановлено, що в циклах із диференційованим підходом до проведення контрольованої оваріальної стимуляції залежно від тестування на генетичний поліморфізм генів FSHR та ESR2 порівняно з циклами з традиційним довгим протоколом з агоністами у 2,21 раза частіше спостерігали СГЯ легкого ступеня (p < 0,0001), але в 1,57 рідше — СГЯ середнього ступеня (p < 0,0003).
Випадків СГЯ тяжкого ступеня в основній групі не спостерігалося, тоді як у групі порівняння зареєстровано 6 (5,88 %) випадків СГСЯ тяжкого ступеня (p < 0,02) (табл. 10).
Як видно з табл. 10, не спостерігалося вірогідних відмінностей між кумулятивною кількістю отриманих біохімічних, клінічних вагітностей, мимовільних абортів і пологів.
Висновки
1. Найбільш характерними рисами поліморфізму генів рецепторів ФСГ і Е2 у пацієнток із хронічною гіперандрогенною ановуляцією є збільшення частоти генотипу SS для кодона 680 гена FSHR порівняно з плідними жінками у 2,27 (р < 0,0001) і генотипу GA для гена ESR2 у 24,88 раза (р < 0,0001).
2. Використання протоколів ДРТ із диференційованим підходом щодо проведення контрольованої стимуляції овуляції у пацієнток із хронічною гіперандрогенною ановуляцією залежно від тестування на поліморфізм генів FSHR та ESR2 та попереднім застосуванням антиандрогену флутаміду вірогідно знижує тривалість стимуляції в 1,08 раза (р < 0,0001), загальний витрачений рФСГ — в 1,06 (р < 0,009), рівень Е2 і прогестерону в день введення тригерної дози ХГЛ — в 1,31 (р < 0,0001) і в 1,19 (р < 0,0001), зменшує числа випадків СГЯ середнього ступеня в 1,57 раза (p < 0,0003) і приводить до відсутності СГЯ тяжкого ступеня, при цьому якість отриманих овоцитів й ембріонів, відповідно, кумулятивного числа вагітностей і пологів вірогідно не відрізняється.
1. Детская гинекология: Справочник / [сост. Л.Б. Маркин, Э. Б. Маркина]. — М.: МИА, 2007. — 480 с.
2. Допоміжні репродуктивні технології в лікуванні безпліддя в Україні / О.М. Юзько, Т.А. Юзько, Н.Г. Руденко [та співавт.] // Здоровье женщины. — 2009. — № 3(39). — С. 219.
3. Дубоссарская З.М. Репродуктивная эндокринология (перинатальные, акушерские и гинекологические аспекты) / З.М. Дубоссарская [Учебно-методическое пособие]. — Днепропетровск: Лира ЛТД, 2008. — 416 с.
4. Експериментальна терапія порушень статевої циклічності у щурів з гіперандрогенією / [Тарасенко Л.В., Носенко Н.Д., Сініцин П.В., Резніков О.Г.] // Клін. експ. патологія. — 2004. — Т. 3, № 2. — С. 140-142.
5. Запорожан В.М. Зв’язок низького рівня відповіді на стимуляцію овуляції у пацієнток з СПКЯ із функціональним генетичним поліморфізмом / В.М. Запорожан, О.М. Борис // Медико-соціальні проблеми сім’ї. — 2011. — Т. 16, № 3. — С. 35-39.
6. Калугина А.С. Оптимизация контролируемой суперовуляции и криоконсервации в программах вспомогательных репродуктивных технологий: Автореф. дис... д-ра мед. наук: спец. 14.00.01 «Акушерство и гинекология» / А.С. Калугина / Государственное образовательное учреждение дополнительного профессионального образования Санкт-Петербургской медицинской академии последипломного образования. — Санкт-Перетербург, 2009. — 40 с.
7. Калугина Л.В. Опыт лечения СПКЯ / Л.В. Калугина, О.А. Ефименко // Репродуктивная эндокринология. — 2012. — № 2(4). — С. 74-78.
8. Козуб М.І. Вплив супутньої гінекологічної патології на ефективність лапароскопічного лікування пацієнток з СПКЯ / М.І. Козуб, М.П. Сокол, М.М. Козуб // Репродуктивна ендокринологія. — 2011. — № 2. — С. 58.
9. Контрольована стимуляції яєчників за допомогою антагоністів гонадотропін-рилізинг-гормонів з урахуванням рівня сироваткового прогестерону як метод профілактики ускладнень та ненастання вагітності при проведенні допоміжних репродуктивних технологій у пацієнток групи високого ризику розвитку синдрому гіперстимуляції яєчників / Чайка А.В., Носенко О.М., Айзятулова Е.М., Дорошенко В.Е. // Медико-соціальні проблеми сім’ї. — 2011. — Т. 16, № 4. — С. 39-47.
10. Лечение гиперандрогении как причины нарушения репродуктивного здоров’я женщины / [Татарчук Т.Ф., Ганжий И.Ю., Березовская Е.И., Шевчук Т.В.] // Здоровье женщины. — 2009. — № 6. — С. 147-151.
11. Нейроэндокринные механизмы развития экспериментальной ановуляции гиперандрогенного происхождения / [Резников А.Г., Синицын П.В., Тарасенко Л.В., Полякова Л.И.] // Пробл. эндокринол. — 2002. — Т. 48, № 6. — С. 50-53.
12. Носенко О.М. Оцінка ефективності відновлення репродуктивної функції при призначенні кломіфен-цитрату після хірургічної стимуляції овуляції у пацієнток з кломіфен-резистентною формою СПКЯ / О.М. Носенко, Г.М. Яковець // Медико-соціальні проблеми сім’ї. — 2010. — Т. 15, № 4. — С. 24-32.
13. Пат. 29025 Україна, МПК7 А, А61К31/165. Спосіб лікування ендокринного безпліддя / Резніков О.Г., Сініцин П.В.; Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України. Опубл. 16.10.2000, Бюл. № 10.
14. Пат. 42246 України. Процес тестування активності індукторів овуляції з периферичним механізмом дії / Резніков О.Г., Носенко Н.Д., Сініцін П.В. [та ін.]. Опубл. 25.06.2009, Бюл. № 12.
15. Пищулин А. А. Синдром овариальной гиперандрогении неопухолевого генеза / А.А. Пищулин, А.В. Бутов, О.В. Удовиченко // Гинеколог. — 2005. — № 5. — С. 17-27.
16. Чайка А.В. Комплексна діагностика, лікування та реабілітація репродуктивної функції у жінок з синдромом полiкiстозних яєчникiв: Автореф. дис… д-ра мед. наук: спец. 14.01.01 «Акушерство та гінекологія» / А.В. Чайка / Національний медичний університет ім. О.О. Богомольця. — Київ, 2003. — 38 с.
17. Abnormal gene expression profiles in human ovaries from polycystic ovary syndrome patients / [Jansen E., Laven J.S., Dommerholt H.B. et al.] // Mol. Endocrinol. — 2004. — № 18(12). — P. 3050-3063.
18. Bell A. Evidence of biochemical hyperandrogenism in women: The limitations of serum testosterone quantitation / A. Bell, C.L. Meek, A. Viljoen // J. Obstet. Gynaecol. — 2012. — № 32(4). — P. 367-371.
19. Genetic profile of SNP (s) and ovulation induction / [Loutradis D., Theofanakis Ch., Anagnostou E. et al.] // Curr. Pharm. Biotechnol. — 2012. — № 13(3). — P. 417-425.
20. Phenotype and metabolic disorders in polycystic ovary syndrome / [Gluszak O., Stopinska-Gluszak U., Glinicki P. et al.] // ISRN Endocrinol. — 2012. — 569862.
21. Prevalence of the metabolic syndrome in women with a previous diagnosis of polycystic ovary syndrome: long-term follow-up / [Hudecova M., Holte J., Olovsson M. et al.] // Fertil. Steril. — 2011. — № 96(5). — Р. 1271-1274.
22. Whitaker K.N. Polycystic ovary syndrome: an overview / K.N. Whitaker // J. Pharm. Pract. — 2011. — № 24(1). — P. 94-101.
23. Women with oligo-/amenorrhoea and polycystic ovaries have identical responses to GnRH stimulation regardless of their androgen status: comparison of the Rotterdam and Androgen Excess Society diagnostic criteria / [Lewandowski K.C., Cajdler-Luba A., Bienkiewicz M., Lewinski A.] // Neuro Endocrinol. Lett. — 2011. — № 32(6). — P. 847-856.