Журнал «» 4(18) 2011
Вернуться к номеру
Пролонгированная форма торасемида: что нового?
Авторы: Carmen Acuna, Барселона, Испания
Рубрики: Семейная медицина/Терапия, Кардиология, Терапия
Версия для печати
Хроническая сердечная недостаточность (ХСН) является значимой причиной заболеваемости и смертности во всем мире, и ее частота и распространенность продолжают расти. Задержка жидкости и перегрузка объемом служат причиной большей части смертей, связанных с сердечной недостаточностью. Существует множество препаратов для лечения ХСН, но петлевым диуретикам отводится особая роль.
Фуросемид является наиболее часто используемым петлевым диуретиком. Торасемид — петлевой диуретик, принадлежащий к классу пиридинсульфонилмочевин. Он является высокопредельным диуретиком, который имеет большее время полувыведения, большую продолжительность действия и более высокую биодоступность по сравнению с фуросемидом. Для него характерен ряд дополнительных эффектов, таких как антиальдостероновое и вазодилататорное действие. Торасемид является единственным петлевым диуретиком, который эффективно снижает высокое артериальное давление даже в низких дозах. Учитывая все перечисленное, торасемид рекомендуют использовать для лечения ХСН вместо фуросемида. Данные клинических исследований показали, что торасемид улучшает функцию левого желудочка, снижает смертность, а также частоту и длительность госпитализаций по поводу сердечной недостаточности. Он также повышает толерантность к физическим нагрузкам, улучшает функциональный класс сердечной недостаточности по классификации Нью-Йоркской кардиологической ассоциации и качество жизни у пациентов с ХСН. В дополнение к этому торасемид является достаточно безопасным препаратом.
В наблюдательном исследовании TORIC, выполненном после выхода препарата на рынок, было показано, что назначение 1377 пациентам с ХСН торасемида приводило к достоверному снижению смертности от сердечно-сосудистых причин по сравнению с фуросемидом. Торасемид обращал миокардиальный фиброз и снижал синтез коллагена I типа, тем самым уменьшая ремоделирование сердца у пациентов с ХСН.
Пролонгированная форма торасемида является новой формой, которая по сравнению с обычной формой торасемида (с быстрым высвобождением вещества) имеет такую же биодоступность, но достоверно более низкую скорость адсорбции и менее выраженные колебания концентрации препарата в плазме крови. Натрийуретическая эффективность у новой формы более высокая, а диурез более стабилен. В дополнение к этому для нее характерна более высокая переносимость.
Введение
Сердечная недостаточность является распространенным, инвалидизирующим, дорогим в лечении, прогрессирующим заболеванием, которое может приводить к летальному исходу. Она является единственным сердечно-сосудистым заболеванием, сопровождающимся высокой частотой госпитализаций и значительным увеличением расходов на здравоохранение [1]. Согласно данным испанского исследования EPISERVE, более чем в 80 % случаев причинами сердечной недостаточности являются артериальная гипертензия и ишемическая болезнь сердца [2].
Распространенность сердечной недостаточности растет вследствие увеличения продолжительности жизни и удваивается в расчете на каждую декаду (10 лет) возраста населения. Так, в исследовании PRICE (PRevalencia de la Insuficiencia Cardiaca en Espaсa — Распространенность сердечной недостаточности в Испании) оценили распространенность сердечной недостаточности у 1776 пациентов в возрасте старше 45 лет, которым оказывалась помощь в испанских центрах первичного звена здравоохранения. Тех из них, у которых присутствовали Фрамингемские критерии сердечной недостаточности, направляли для оценки к кардиологу. В результате было выяснено, что распространенность застойной сердечной недостаточности составляет 6,8 % (95% ДИ от 4 до 8,7), причем в 5,8 % случаев ее диагноз был выставлен ранее, до проведения исследования. Среди больных с сердечной недостаточностью систолическая функция была нарушена (фракция выброса (ФВ) левого желудочка < 45 %) в 52 % случаев и сохранена (фракция выброса ≥ 45 %) в 48 % случаев. Распространенность сердечной недостаточности не зависела от пола (6,5 % мужчин и 7 % женщин), но зависела от возраста, так что в группе больных 45–55 лет распространенность составила 1,3 % (95% ДИ от 0,4 до 2,1), в группе пациентов 55–64 лет увеличилась до 5,5 % (от 2,4 до 8,5 %), в группе 65–74 лет возросла до уровня 8 % (от 4,2 до 11,8 %), и у пациентов старше 74 лет достигала 16,1 % (от 11 до 21,1 %) [3]. Эти данные свидетельствуют об увеличении распространенности сердечной недостаточности в Испании, если сравнивать с данными из более раннего исследования, в котором она составила в среднем 5 %, хотя также варьировала в зависимости от возраста [4]. В соответствии с данными испанского регистра BADAPIC (BAse de DAtos de Pacientes con Insuficiencia Cardiaca — База данных пациентов с сердечной недостаточностью) [5], в который занесена информация о 3909 пациентах, средний возраст больных с сердечной недостаточностью составил 66 ± 12 лет, причем 40 % больных были в возрасте старше 70 лет. Наиболее частыми причинами сердечной недостаточности были ишемическая болезнь сердца (41 %) и артериальная гипертензия. В 68 % случаев была нарушена систолическая функция (фракция выброса < 45 %). Что касается лечения, 86 % пациентов получали диуретики, 87 % — ингибиторы ангиотензинпревращающего фермента (ИАПФ) или блокаторы ангиотензиновых рецепторов (БАР) и 59 % — бета-блокаторы. Выживаемость в течение 2 лет составила 87 % [5].
Сердечная недостаточность часто не распознается, особенно у женщин. Примером тому является исследование MERICAP [6], в которое было включено 4307 женщин в возрасте 65 лет с артериальной гипертензией, обратившихся за помощью в испанские центры первичного звена здравоохранения. Из них 18,7 % пациенток (n = 807) на момент включения в исследование уже был выставлен диагноз сердечной недостаточности. Однако среди оставшихся 3500 пациенток еще у 21,4 % женщин (n = 749) выявили ранее не распознанную сердечную недостаточность. Следовательно, одна из пяти женщин с артериальной гипертензией страдает также от сердечной недостаточности. Сердечно-сосудистые факторы риска наблюдались достоверно более часто у пациенток с нераспознанной сердечной недостаточностью, особенно гипертрофия левого желудочка, ишемическая болезнь сердца и коморбидность с другими заболеваниями, такими как сахарный диабет. Уровень артериального давления был достоверно более высоким у пациенток с нераспознанной сердечной недостаточностью [6, 7]. Приведенные данные свидетельствуют о том, что в практической деятельности врача было бы целесообразно применять мочегонное средство, которое было бы эффективно при артериальной гипертензии и одновременно обладало бы доказанным положительным влиянием на сердечную недостаточность. К диуретикам с подобными свойствами относят торасемид.
Сердечная недостаточность является второй лидирующей причиной госпитализации в Испании и первой у пациентов в возрасте старше 65 лет [3]. В противоположность этому смертность от сердечной недостаточности снизилась, хотя и остается на уровне 50 % в течение 5 лет после выставления диагноза, несмотря на проводимое лечение. Сердечная недостаточность является третьей ведущей причиной смертности от сердечно-сосудистых причин [8].
Сердечная недостаточность — клинический синдром, который представляет собой совокупность ряда симптомов и признаков [9].
Симптомы и признаки сердечной недостаточности [9]:
1. Симптомы сердечной недостаточности:
— одышка в покое и при физической нагрузке;
— утомляемость.
2. Признаки сердечной недостаточности:
— тахикардия;
— тахипноэ;
— плевральный выпот;
— повышение венозного давления;
— отеки ног;
— гепатомегалия.
3. Объективные данные о наличии структурных или функциональных аномалий сердца в покое:
— кардиомегалия;
— третий тон;
— шумы в сердце;
— аномальная ЭКГ;
— повышение уровня натрийуретического пептида (BNP).
В зависимости от клинического течения сердечная недостаточность может быть классифицирована на впервые выявленную, транзиторную, хроническую или терминальную. В зависимости от повреждения сердечной мышцы сердечная недостаточность может быть разделена на систолическую сердечную недостаточность, при которой развивающиеся нарушения приводят к уменьшению сократительной функции сердца, и на сердечную недостаточность с сохранением фракции выброса левого желудочка, называемую диастолической, при которой ФВ составляет более 40–50 %. Однако у большинства пациентов систолическая и диастолическая дисфункция сосуществуют как в покое, так и при физической нагрузке, поэтому Европейское кардиологическое общество рекомендует не рассматривать их по отдельности [9]. Сердечную недостаточность классифицируют также по тяжести (табл. 1) [10].
Оптимальная терапия хронической сердечной недостаточности включает идентификацию и коррекцию факторов, провоцирующих ее развитие, которые могут быть обратимы, а также оптимизацию дозы препаратов, используемых для лечения пациентов, госпитализированных с декомпенсацией болезни [1]. Лечение сердечной недостаточности преследует несколько целей [9], и является очевидным, что наиболее подходящим препаратом будет тот, который позволит достичь всех этих целей.
Цели лечения сердечной недостаточности [9]:
1. В отношении прогноза:
— снизить смертность.
2. В отношении заболевания:
— устранить симптомы и признаки недостаточности;
— улучшить качество жизни;
— устранить отеки и задержку жидкости в организме;
— увеличить толерантность к физической нагрузке;
— уменьшить утомляемость и диспноэ;
— снизить частоту госпитализации;
— обеспечить уход за терминально больными.
3. Необходимо осуществить профилактику:
— появления и прогрессирования повреждения миокарда;
— ремоделирования миокарда;
— рецидивирования симптомов и задержки жидкости;
— госпитализации.
Роль диуретиков при лечении сердечной недостаточности
Заболеваемость при сердечной недостаточности зависит главным образом от задержки жидкости и симптомов перегрузки объемом. Натрийуретическая пептидная система в сердечно-сосудистой системе действует как контррегуляторный механизм; при сердечной недостаточности в плазме крови повышается содержание мозгового натрийуретического пептида, что коррелирует с наличием и тяжестью этой недостаточности [11].
Механизмы, вовлеченные в задержку жидкости при сердечной недостаточности [11]:
— снижение клубочковой фильтрации;
— активация ренин-ангиотензиновой системы;
— секреция альдостерона.
Системный и легочный застой — ключевые признаки как острой, так и хронической сердечной недостаточности. Поэтому диуретики являются одной из основных групп средств, применяемых для лечения этой патологии [12, 13], — их относят к терапии первой линии при лечении острой и хронической сердечной недостаточности [14, 15].
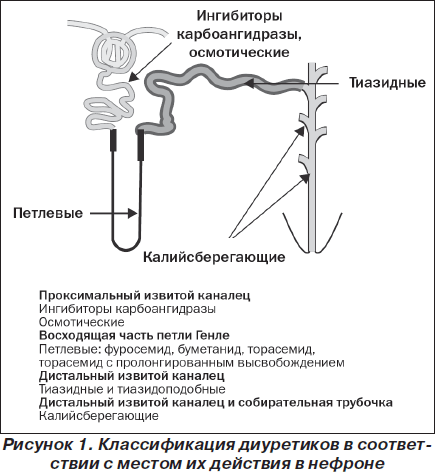
Все диуретики действуют главным образом путем снижения абсорбции натрия в почечных канальцах (рис. 1), однако они различаются по механизму действия, фармакологическим свойствам и показаниям. Их назначение также может быть связано с развитием побочных эффектов — в основном с изменением кислотно-щелочного равновесия и содержания электролитов. К настоящему времени известны фармакологические свойства каждого класса диуретиков (их эффективность и безопасность), поэтому адекватный мониторинг за пациентами является наиболее важной стратегией, направленной на предотвращение развития побочных эффектов, связанных с приемом этих препаратов [16].
В исследовании BADAPIC 86 % пациентов получали диуретики, 87 % — ингибиторы ангиотензинпревращающего фермента или блокаторы ангиотензиновых рецепторов, 59 % пациентов — бета-блокаторы [5]. В исследовании EPISERVE 98 % пациентов получали диуретики, причем примерно в 80 % случаев это был петлевой диуретик [2].
Петлевые диуретики, такие как торасемид, используют для лечения отечных расстройств, включая сердечную недостаточность, в то время как другие диуретики — тиазидные, калийсберегающие — применяют по другим показаниям [17]. У грудных детей и детей младшего возраста клиническая картина сердечной недостаточности имеет ряд особенностей, но применение петлевых диуретиков и у них остается одним из основных видов лечения [18].
Применение петлевых диуретиков при сердечной недостаточности
Петлевые диуретики действуют путем блокирования котранспортера для ионов Na-K-2Cl в просвете восходящей части петли Генле. Данный котранспортер облегчает транспорт одного иона натрия, одного иона калия и двух ионов хлора из внеклеточного пространства в клетку (рис. 2). Он экспрессируется не только в петле Генле, но и в некоторых других тканях. На сегодня известны две его основные разновидности: NKCC2 и NKCC1. Котранспортер NKCC2 обнаруживается только в почках и представляет собой трансмембранный белок с молекулярной массой белковой сердцевины 121 кДа, состоит из 12 трансмембранных доменов, причем петлевые диуретики связываются с участками 11 и 12 доменов, в то время как ионы Na, K и/или Cl транспортируются участками 2, 4 и 7 доменов [19]. Существуют три основные изоформы котранспортера NKCC2, но у человека доминирующей является NKCC2А-изоформа. Котранспортер NKCC1 экспрессируется в других тканях, и петлевые диуретики влияют на него слабо или не влияют совсем [20].
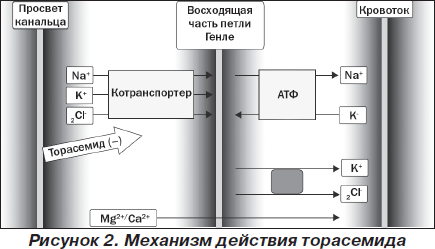
Блокирование котранспортера для ионов Na-K-2Cl предотвращает реабсорбцию этих ионов и воды с помощью активного транспорта из почечных канальцев в интерстициальную ткань восходящей части петли Генле. В результате увеличивается выведение почками ионов натрия (натрийурез) и воды (диурез). Одновременно усиливается выведение почками ионов калия, поскольку большее количество ионов натрия достигает дистальных извитых канальцев и более интенсивно обменивается здесь на ионы калия (за счет работы ренин-ангиотензин-альдостероновой системы). Торасемид является петлевым диуретиком с высокой аффинностью к котранспортеру для ионов Na-K-2Cl [21]. Петлевые диуретики вызывают наибольший диурез, с потерей 15–25 % вышедших в первичную мочу ионов натрия, поэтому их еще называют высокопредельными диуретиками.
Было показано, что у пациентов с хронической сердечной недостаточностью и сохраненной функцией почек кишечная абсорбция петлевых диуретиков аналогична той, которая наблюдается у здоровых волонтеров. Поэтому количество препарата, которое достигает дистальных извитых канальцев, является нормальным, и повышение дозы не требуется. В то же время может потребоваться увеличение частоты приема препарата, поскольку абсорбция протекает медленнее и эффект развивается с некоторой задержкой [19]. Скорость абсорбции не одинакова у всех петлевых диуретиков: например, у вышеупомянутой категории пациентов торасемид абсорбируется более быстро, чем фуросемид [22].
Этот класс диуретиков начинает действовать при определенной пороговой концентрации. Дальше при увеличении дозы натрийурез и диурез растут до тех пор, пока не будет достигнута максимальная доза, выше которой прирост этих показателей не отмечается (рис. 3) [11].
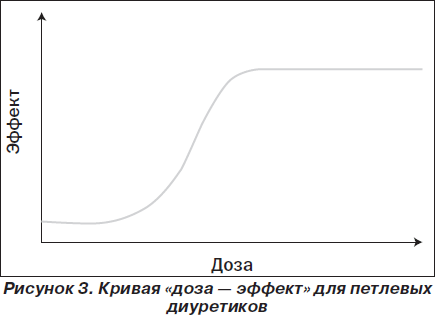
У большинства пациентов низкой дозы петлевого диуретика на фоне умеренно низкого потребления натрия достаточно, чтобы уменьшить перегрузку от объема. Однако в более тяжелых случаях сердечной недостаточности дозу диуретика необходимо увеличить и добавить к нему другой диуретик с комплементарным режимом действия. Если, несмотря на эти мероприятия, перегрузка от объема не исчезает, пациент должен быть госпитализирован.
В обновленном руководстве по лечению сердечной недостаточности Американского кардиологического колледжа (ACC) и Американской кардиологической ассоциации (AHA) отмечается, что если пациент попал в палату интенсивной терапии вследствие сердечной недостаточности и симптомов/признаков перегрузки объемом, то необходимо как можно быстрее начать внутривенное введение петлевого диуретика, и что ранняя реализация подобного подхода приводит к более благоприятным исходам (уровень доказательности В). Если пациент хронически принимает петлевой диуретик, то внутривенная доза должна быть равной или больше, чем ежедневная пероральная доза. Необходимо регулярно оценивать объем мочи и наличие симптомов/признаков застоя и подобрать такую дозу диуретика, которая бы устранила эти проявления и уменьшила избыточный объем внеклеточной жидкости (уровень доказательности С). Если выделение мочи остается неадекватным, можно увеличить дозу петлевого диуретика, добавить второй диуретик (например, спиронолактон или внутривенно хлортиазид) или начать непрерывное инфузионное введение петлевого диуретика (уровень доказательности С) [23].
Было высказано предположение, что изменение фармакодинамики петлевых диуретиков при сердечной недостаточности может развиваться вследствие изменения экспрессии или активности котранспортера для ионов Na-K-2Cl, а также вследствие влияния вазопрессина [19].
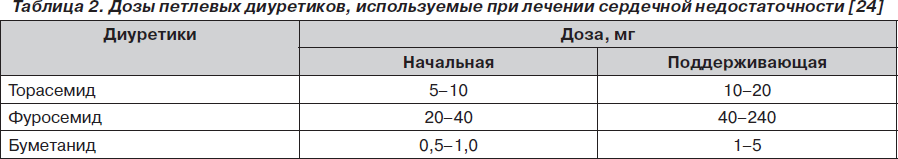
В руководстве по диагностике и лечению сердечной недостаточности Европейского кардиологического общества (ESC) диуретики вместе с ингибиторами ангиотензинпревращающего фермента или блокаторами ангиотензиновых рецепторов рекомендованы в качестве препаратов первого выбора при лечении сердечной недостаточности (класс рекомендаций I, уровень доказательности В). При умеренном и тяжелом течении сердечной недостаточности рекомендуется применять петлевые диуретики. При недостаточной эффективности или резистентности к фуросемиду необходимо рассмотреть возможность переключения на торасемид. Дозы должны подбираться индивидуально для каждого пациента, и их ориентировочные стартовые и поддерживающие значения приведены в табл. 2 [24].
Торасемид
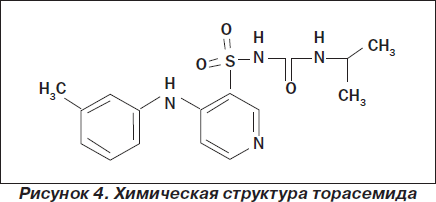
Торасемид является петлевым диуретиком длительного действия из группы пиридинсульфонилмочевин (1-изопропил-3-([4-(3-метилфениламино)-пиридин]-3-сульфонил)-мочевина) (рис. 4). Он сочетает в себе эффекты фуросемида и спиронолактона.
Торасемид обычно не вызывает такой интенсивный и краткосрочный диурез, как фуросемид, поэтому лучше переносится, и комплайенс пациентов к нему выше [10].
Петлевые диуретики стимулируют работу ренин-ангиотензин-альдостероновой системы и могут вызывать гипокалиемию за счет увеличения выведения ионов калия. Торасемид ингибирует работу ренин-ангиотен-альдостероновой системы — эффект, который отсутствует у фуросемида, и, уменьшая высвобождение альдостерона, снижает потери калия. В рамках исследования TORIC у пациентов с сердечной недостаточностью частота гипокалиемии была ниже среди пациентов, получавших торасемид [25].
Торасемид является эффективным и безопасным антигипертензивным средством при назначении его как в виде монотерапии, так и в комбинации с другими препаратами. Он эффективен по крайней мере в той же степени, что и тиазидные диуретики, но лучше переносится. Торасемид снижает артериальное давление даже в тех дозах, которые не являются диуретическими [26].
Торасемид безопасен и эффективен при лечении сердечной недостаточности как у взрослых, так и детей [27]. Кроме того, торасемид оказывает еще один дополнительный положительный эффект — снижает выраженность фиброза миокарда [28].
Фармакокинетика торасемида
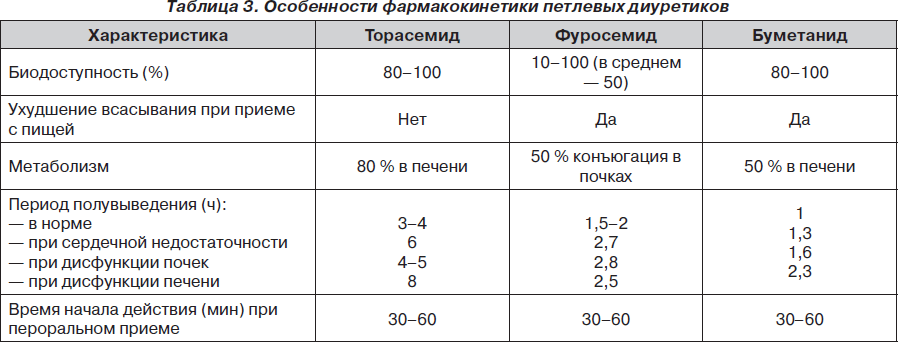
Фармакокинетические свойства торасемида отличаются от таковых у других петлевых диуретиков, что было показано в обзорных работах, опубликованных между 1966 и 2009 гг. (табл. 3). В соответствии с ними торасемид превосходит фуросемид, поскольку он имеет более высокую и более предсказуемую биодоступность, а также более длительный период полувыведения. Фармакокинетика торасемида превосходит также фармакокинетику буметанида, другого петлевого диуретика [29].
Торасемид метаболизируется цитохромом Р450, чем объясняется отсутствие изменений его фармакокинетических свойств у пациентов с сердечной недостаточностью или хронической почечной недостаточностью. При этом 75–80 % торасемида выводится в виде метаболитов (М1, М2 и особенно М5) с мочой или другими путями, а оставшаяся часть выделяется в неизмененном виде. Наличие двух путей клиренса — почечного и печеночного — снижает риск кумуляции торасемида в случае нарушения функции почек (выводится печенью), а при циррозе печени повышается его выделение почками. В противоположность этому фуросемид в значительной степени метаболизируется в почках путем конъюгации с глюкуроновой кислотой. Поэтому его фармакокинетика зависит больше от функции почек, нежели от функции печени, и дисфункция почек может привести к кумуляции препарата [30]. В целом фармакокинетические свойства торасемида лучше, чем у фуросемида.
В ряде исследований было обнаружено влияние генетических факторов [31–34]. В частности, было продемонстрировано выраженное снижение элиминации торасемида у женщин по сравнению с мужчинами, что, по-видимому, связано с полиморфизмом SLCO1B1c.521T>C транспортера органических анионов OATP1B, который переносит лекарственные средства в печени. Было выяснено, что торасемид является субстратом OATP1B, причем захват торасемида значительно снижается при наличии 521С варианта этого транспортера. Выявленные половые различия могут быть причиной того, что у женщин обнаруживается большее количество побочных эффектов при лечении торасемидом. Этот факт должен быть принят во внимание, чтобы более тщательно отслеживать развитие побочных эффектов во время курса терапии [35]. В другой работе исследовали влияние генотипов цитохрома Р450 (CYP) 2С9 (CYP2С9) и транспортера OATP1B на фармакокинетику торасемида. В результате было обнаружено, что генотипы CYP2С9*3 и SLCO1B1c.521T>C влияют на фармакокинетические параметры торасемида [36]. Полиморфизмы Val174Ala и Asn130Asp транспортера OATP1B тоже оказывали подобное действие [34].
Фармакокинетика пролонгированной формы торасемида
В целом характеристика пролонгированной формы торасемида совпадает с таковой для формы с обычным (быстрым) высвобождением, поскольку действующее вещество является одним и тем же. Однако из пролонгированной формы действующее вещество высвобождается постепенно, что не приводит к развитию ярко выраженного пика действия. Абсорбция протекает более медленно, Тmax удлинено, Сmax снижена. Биодоступность, отражающая системную экспозицию препарата и оцениваемая как площадь под кривой «концентрация — время» (AUC), не меняется. Препарат начинает действовать более медленно, и пациент не страдает от экстренного выделения мочи, что улучшает качество его жизни. После повторных введений препарата наблюдается меньшая вариация концентрации в плазме крови. Некоторые различия пролонгированной формы торасемида от его формы с обычным высвобождением представлены ниже [37, 38].
Фармакокинетические свойства пролонгированной формы торасемида по сравнению с обычной формой торасемида:
— биодоступность одинакова;
— скорость абсорбции снижена;
— малые вариации концентрации препарата в плазме крови;
— большая натрийуретическая активность;
— менее выражено экстренное выделение мочи.
Фармакокинетика при повторном введении пролонгированной и обычной формы торасемида была изучена у молодых здоровых волонтеров. С этой целью было выполнено рандомизированное одиночное слепое перекрестное (с 2 периодами) исследование, в рамках которого испытуемые получали 10 мг/день торасемида с пролонгированным или обычным высвобождением в течение 4 дней подряд. В результате было обнаружено, что при введении пролонгированной формы торасемида Тmax было больше, чем при введении обычной формы, а Сmax — ниже (рис. 5). Объем мочи был одинаковым, хотя в первые часы после введения препаратов он был немного ниже в группе с пролонгированной формой торасемида. Как и в предыдущих исследованиях, в группе с пролонгированной формой торасемида экстренное выделение мочи развивалось позже и, по мнению испытуемых, было менее выраженным [37].
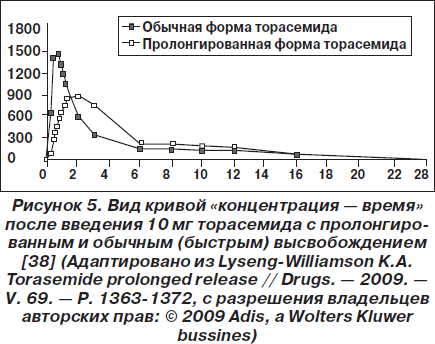
В одном из последних исследований сравнили фармакокинетические свойства двух доз торасемида (5 и 10 мг) с пролонгированным и обычным высвобождением при их введении здоровым волонтерам. В итоге были получены данные, во многом аналогичные вышеприведенным результатам. Биодоступность обеих форм была одинаковой. Скорость абсорбции пролонгированной формы торасемида была ниже, что выражалось более высоким значением Тmax и более низким значением Сmax. Кроме того, прием пролонгированной формы торасемида был связан с более стабильным диурезом и более высокой натрийуретической активностью.
Фармакодинамика торасемида
Фармакодинамические эффекты торасемида прямо связаны с дозой: по мере увеличения дозы диурез и экскреция натрия и хлоридов линейно возрастают. В противоположность этому экскреция калия остается минимальной. Торасемид не изменяет концентрацию калия, магния и кальция в плазме крови даже при длительном применении в комбинации с тиазидным диуретиком [40]. Это было подтверждено как у здоровых волонтеров, так и у пациентов с артериальной гипертензией и отеками разных типов. В исследовании TORIC гипокалиемия наблюдалась более часто при использовании фуросемида и других диуретиков, нежели при назначении торасемида [25]. По сравнению с фуросемидом торасемид действовал дольше (24 ч по сравнению с 6–8 ч для фуросемида), его диуретический, натрийуретический и хлоруретический эффекты были в 8 раз выше, а калийурез увеличивался лишь в 3 раза, что говорит о том, что торасемид лучше поддерживает водно-электролитный баланс [41].
Фармакодинамика пролонгированной формы торасемида
При использовании пролонгированной формы торасемида диурез начинается приблизительно через 1 ч после приема препарата, достигает максимума через 3–6 ч и поддерживается 8–10 ч. Как и для обычной формы торасемида, взаимосвязь между вводимой дозой препарата и экскрецией натрия носила линейный характер в диапазоне доз от 2,5 до 20 мг. Фармакодинамические показатели мочи были одинаковы для обеих форм торасемида, хотя пролонгированная форма торасемида характеризовалась более высокой натрийуретической эффективностью, меньшим объемом мочи и меньшим выделением электролитов с мочой в первый час после введения препарата [39]. Экскреция калия увеличивается незначительно после однократного приема торасемида в дозе до 10 мг и лишь немного возрастает (5–15 мЭкв) после приема 20 мг препарата [42].
Клинические данные об эффективности пролонгированной формы торасемида при артериальной гипертензии
Пролонгированная форма торасемида снижала диастолическое артериальное давление в той же самой степени, что и обычная форма торасемида, однако в отношении других аспектов эффективность пролонгированной формы была выше. Так, в рамках рандомизированного двойного слепого исследования 432 пациентам с артериальной гипертензией была назначена обычная форма торасемида 5 мг/день (n = 223) или пролонгированная форма торасемида 5 мг/день (n = 219) сроком на 12 недель. Спустя 4 или 8 недель доза могла быть увеличена до 10 мг/день в том случае, если целевое снижение давления не было достигнуто. В результате было обнаружено, что спустя 8 и 12 недель процент пациентов с адекватным контролем артериального давления был достоверно выше в группе, получавшей пролонгированную форму торасемида. Кроме того, амбулаторный мониторинг артериального давления в течение 24 ч показал, что снижение систолического артериального давления в течение дня было достоверно более высоким при назначении пролонгированной формы торасемида (128,0 ± 9,9 мм рт.ст.) по сравнению с обычной формой торасемида (133,5 ± 10,4 мм рт.ст., p < 0,05). Между обеими формами торасемида не было различий в переносимости и безопасности [43].
Другие эффекты торасемида
Как уже упоминалось, торасемид ингибирует секрецию альдостерона, что уменьшает экскрецию калия и объясняет, почему потеря калия с мочой при применении торасемида ниже, чем при использовании других диуретиков [44].
Торасемид оказывает прямые сосудистые эффекты: достоверно увеличивает вазодилатацию у здоровых волонтеров и у пациентов с артериальной гипертензией с помощью механизма, связанного с высвобождением оксида азота (NO) [45].
Торасемид увеличивает секрецию простагландина I2 in vitro и in vivo в большей степени, чем фуросемид. Торасемид в отличие от фуросемида не стимулирует высвобождение тромбоксана [46].
Торасемид ингибирует вазоконстрикцию, вызванную ангиотензином II, и повышение внутриклеточного содержания кальция в аорте спонтанно гипертензивных крыс [47]. Данный препарат блокирует также вазоконстрикторное действие эндотелина-1 (ET-1) [48].
Торасемид тормозит образование белков в гладкомышечных клетках сосудов, опосредованное ангиотензинном II, — трофический эффект ангиотензина II у спонтанно гипертензивных крыс. У фуросемида подобный эффект отсутствует [49].
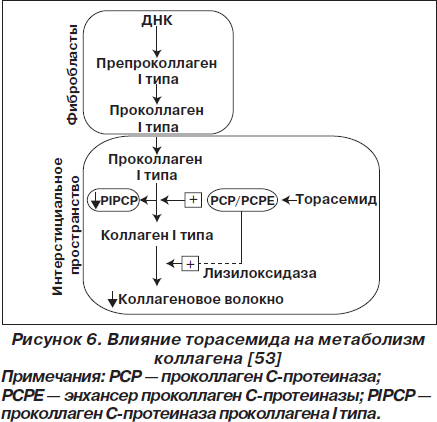
На модели аутоиммунного миокардита у крыс было впервые показано, что торасемид достоверно улучшает функцию левого желудочка и уменьшает прогрессирование ремоделирования сердца [50]. Площадь фиброза, размер сердечных миоцитов, концентрация трансформирующего фактора роста бета-1 (TGF-b1), коллагена III и альдостеронсинтазы были достоверно снижены, в то время как концентрация белка Са2+-АТФаза2 саркоплазматического ретикулума достоверно увеличивалась. Также в плазме крови дозозависимо увеличивалась концентрация ангиотензина II и альдостерона, а предсердного натрийуретического пептида снижалась [28].
В другом исследовании сравнили эффективность торасемида и фуросемида у крыс с хронической сердечной недостаточностью вследствие экспериментального аутоиммунного миокардита. Аналитические результаты оказались одинаковыми. Однако только при введении торасемида наблюдалось увеличение выживаемости, улучшение функции желудочков и уменьшение прогрессирования ремоделирования сердца [51]. На аналогичной модели сравнили эффективность торасемида, фуросемида и спиронолактона (антагонист альдостероновых рецепторов). При введении торасемида и спиронолактона достоверно улучшалась сердечная функция и уменьшалось ремоделирование левого желудочка по сравнению с фуросемидом [52]. Этот эффект торасемида связывают с ингибированием карбокситерминальной протеиназы проколлагена I типа — фермента, вовлеченного в образование молекул внутриклеточного коллагена I типа в миокарде (рис. 6). Следовательно, торасемид может обращать миокардиальный фиброз и уменьшать синтез коллагена I типа у пациентов с сердечной недостаточностью [53].
Эффективность торасемида при хронической сердечной недостаточности была продемонстрирована во многих клинических исследованиях [54–58]. В сравнительных исследованиях с другими диуретиками, особенно фуросемидом, было показано превосходство торасемида [59–63].
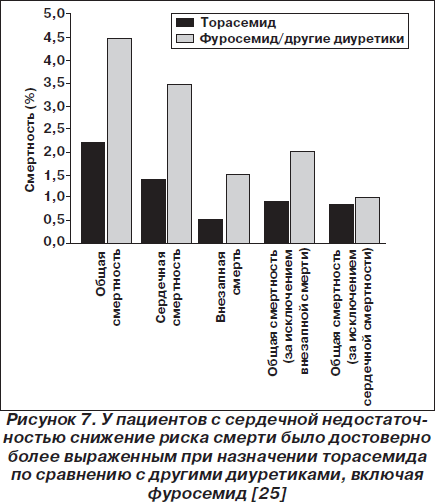
Исследование TORIC (TOrasemida en la Insuficiencia Cardiaca congestive — Эффективность торасемида при застойной сердечной недостаточности) было выполнено как открытое наблюдательное нерандомизированное исследование, в рамках которого сравнили эффективность торасемида 10 мг/день (n = 778), фуросемида 40 мг/день (n = 527) и других диуретиков (n = 72). Диуретики назначались в дополнение к стандартной терапии, исследование длилось 12 месяцев. В общей сложности в исследование было вовлечено 1377 пациентов с хронической сердечной недостаточностью II–III функционального класса по классификации NYHA. Общая смертность, смертность вследствие сердечных причин и частота внезапной смерти были достоверно ниже в группе, принимавшей торасемид (рис. 7). Функциональные улучшения наблюдались у 45,8 % пациентов, получавших торасемид, и у 37,2 % пациентов, получавших фуросемид или другие диуретики (р = 0,00017). Торасемид лучше переносился и достоверно реже вызывал гипокалиемию [25].
В открытом исследовании, включавшем 234 пациента с хронической сердечной недостаточностью, получавших торасемид (n = 113) или фуросемид (n = 121) в течение 12 месяцев, было обнаружено, что частота повторной госпитализации вследствие сердечной недостаточности или всех сердечно-сосудистых причин была достоверно ниже на фоне лечения торасемидом. Длительность госпитализации вследствие сердечной недостаточности также была достоверно ниже в группе, получавшей торасемид [62]. Снижение частоты госпитализации при приеме торасемида было обнаружено еще в одном исследовании, включавшем 1000 пациентов [61].
В ряде новых исследований было продолжено изучение эффективности торасемида при сердечной недостаточности. У 51 пациента с хронической сердечной недостаточностью, получающих лечение диуретиками (включая торасемид), бета-блокаторами, ингибиторами ангиотензинпревращающего фермента, блокаторами ангиотензиновых рецепторов и другими препаратами, была удвоена получаемая ранее доза диуретиков. В результате через 24 ± 6 дней наблюдалось статистически достоверное снижение массы тела, функционального класса по классификации NYHA и значений по опроснику Minnesota Living with Heart Failure Questionnaire (Миннесотский опросник «Жизнь с сердечной недостаточностью»), а также достоверное увеличение дистанции, которую больной проходил за 6 мин. При этом не было отмечено изменений в систолической и диастолической функции левого желудочка [64].
Таким образом, результаты выполненных исследований свидетельствуют о том, что торасемид более эффективен и безопасен по сравнению с фуросемидом при лечении пациентов с хронической сердечной недостаточностью. Поэтому при данной патологии вместо фуросемида рекомендуется использовать торасемид [29].
При сердечной недостаточности торасемид оказывает ряд положительных эффектов в дополнение к его диуретическому действию. Результаты японского исследования свидетельствуют о том, что эти положительные эффекты могут быть связаны с блокадой альдостероновых рецепторов [65].
У 60 пациентов с сердечной недостаточностью и желудочковой дисфункцией назначение торасемида или комбинации фуросемида и спиронолактона приводило к улучшению активности симпатических нервов сердца (увеличивался обратный захват норадреналина в окончания симпатических нервов, что уменьшает ремоделирование миокарда. — Прим. перев.) и функции левого желудочка по сравнению с монотерапией фуросемидом [66].
Торасемид благодаря своим антиальдостероновым эффектам снижал напряжение стенки левого желудочка во время систолы у пациентов с сердечной недостаточностью, при этом активация симпатической нервной системы не наблюдалась (в плазме крови не увеличивалась концентрация норадреналина. — Прим. перев.). Подобные улучшения не были отмечены в группе больных, получавших азосемид: в плазме крови увеличивалась концентрация норадреналина, а напряжение стенки левого желудочка не менялось [67].
Способность торасемида уменьшать фиброз миокарда была изучена в нескольких клинических исследованиях. Было показано, что у пациентов с сердечной недостаточностью торасемид улучшает активность симпатических нервов сердца (увеличивается обратный захват норадреналина в окончания симпатических нервов. — Прим. перев.) и снижает выраженность ремоделирования желудочков [65, 68–70].
В миокарде пациентов с сердечной недостаточностью до лечения/после лечения торасемидом или фуросемидом и у здоровых волонтеров была оценена выраженность образования поперечных сшивок в коллагене и экспрессия лизилоксидазы, которая регулирует этот процесс. В результате было обнаружено, что в миокарде пациентов с сердечной недостаточностью по сравнению со здоровыми волонтерами увеличивались оба упомянутых показателя. На фоне лечения торасемидом оба параметра достоверно снижались (р = 0,021 и р = 0,034 соответственно), в то время как в группе с фуросемидом снижения не было. У всех пациентов с сердечной недостаточностью независимо от группы выраженность образования поперечных сшивок коррелировала с экспрессией лизилоксидазы и наоборот. Интересно, что способность торасемида уменьшать избыточную экспрессию лизилоксидазы и уменьшать образование поперечных сшивок в коллагене приводила к нормализации ригидности стенок левого желудочка у пациентов с сердечной недостаточностью [71]. Скоро станут доступны результаты исследования TORAFIC (Torasemide and Fibrosis in Heart Failure — Влияние торасемида на фиброз при сердечной недостаточности), в рамках которого оценивалось антифибротическое действие пролонгированной формы торасемида.
Все перечисленные эффекты торасемида — в отношении образования коллагена и ремоделирования желудочков, продукции норадреналина и альдостерона — не наблюдались у фуросемида, что может иметь важное значение для лечения пациентов с сердечной недостаточностью с желудочковой дисфункцией и без нее. Повышение в плазме крови концентрации альдостерона приводит к увеличению сердечно-сосудистого риска у пациентов с острой и хронической сердечной недостаточностью и после инфаркта миокарда. В то же время блокада эффектов альдостерона снижает общую и сердечно-сосудистую смертность у этих пациентов. Введение торасемида вместо фуросемида и других калийнесберегающих диуретиков приводит к снижению концентрации альдостерона и связанного с ним сердечно-сосудистого риска, а также к снижению необходимости принимать антагонисты альдостерона [72].
Торасемид является единственным петлевым диуретиком, который ингибирует высвобождение альдостерона и норадреналина, образование коллагена в миокарде и ремоделирование желудочков, а также снижает сердечно-сосудистую смертность по сравнению с фуросемидом [72]. В целом результаты выполненных исследований свидетельствуют о том, что у пациентов с хронической сердечной недостаточностью торасемид [30]:
— улучшает функцию левого желудочка;
— снижает смертность;
— снижает частоту и длительность госпитализаций по поводу сердечной недостаточности;
— улучшает качество жизни;
— увеличивает переносимость физических нагрузок;
— уменьшает функциональный класс сердечной недостаточности по классификации NYHA.
Пролонгированная форма торасемида сочетает в себе более высокую антигипертензивную эффективность, более стабильный диурез без экстренного выделения мочи и более высокую переносимость. По сравнению с фуросемидом торасемид меньше ограничивает повседневную активность, менее часто и позже вызывает экстренное выделение мочи и превосходит фуросемид по ряду параметров, включая риск смерти и госпитализации.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов. При подготовке статьи авторам не предоставлялись гранты или спонсорская помощь.
1. Ramani G.V., Uber P.A., Mehra M.R. Chronic heart failure: contemporary diagnosis and management // Mayo Clin. Proc. 2010; 85: 180-95. Review.
2. Gonzalez-Juanatey J.R., Alegria Ezquerra E., Bertomeu Martinez V., Conthe Gutierrez P., de Santiago Nocito A., Zsolt Fradera I. Insuficiencia cardiaca en consultas ambulatorias: comorbilidades y actuaciones diagnostico-terapeuticas por diferentes especialistas. Estudio EPISERVE // Rev. Esp. Cardiol. 2008; 61: 611-9.
3. Anguita Sanchez M., Crespo Leiro M.G., de Teresa Galvan E., Jimenez Navarro M., Alonso-Pulpon L., Muniz Garcia J.; PRICE Study Investigators. Prevalencia de la insuficiencia cardiaca en la poblacion general espanola mayor de 45 anos. Estudio PRICE // Rev Esp Cardiol. 2008; 61: 1041-9.
4. Cortina A., Reguero J., Segovia E. et al. Prevalence of heart failure in Asturias (a region in the north of Spain) // Am. J. Cardiol. 2001; 87: 1417-9.
5. Anguita Sanchez M.; Investigadores del Registro BADAPIC. Caracteristicas clinicas, tratamiento y morbimortalidad a corto plazo de pacientes con insuficiencia cardiaca controlados en consultas especificas de insuficiencia cardiaca. Resultados del Registro BADAPIC // Rev. Esp. Cardiol. 2004; 57: 1159-69.
6. Barrios Alonso V., Escobar Cervantes C., Llisterri Caro J.L., de la Sierra Isarte A., Bertomeu Martinez V., Gonzalez Segura D. Existen diferencias en el perfil clinico entre la insuficiencia cardiaca reconocida y la no reconocida? Estudio MERICAP // Rev. Esp. Cardiol. 2009; 3: 1-226. Abstract 678.
7. Escobar Cervantes C., Barrios Alonso V., Llisterri Caro J.L., de la Sierra Isarte A., Bertomeu Martinez V., Gonzalez Segura D. Deteccion de la insuficiencia cardiaca no reconocida en mujeres ancianas hipertensas atendidas en atencion primaria // Rev. Esp. Cardiol. 2009; 62: 1-226. Abstract 683.
8. Banegas J.R., Rodriguez-Artalejo F., Guallar-Castillon P. Situacion epidemiologica de la insuficiencia cardiaca en Espana // Rev. Esp. Cardiol. 2006; 6: 4-9.
9. Task Force for Diagnosis and Treatment of Acute and Chronic Heart Failure 2008 of European Society of Cardiology, Dickstein K., Cohen-Solal A., Filippatos G. y cols. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2008: the Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2008 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association of the ESC (HFA) and endorsed by the European Society of Intensive Care Medicine (ESICM) // Eur. Heart J. 2008; 29: 2388-442.
10. Aldamiz-Echevarria Iraurgui B. Insuficiencia cardiaca // Guias Clinicas 2010; 10 (13). http://www.fisterra.com/guias2/icc.asp
11. De Teresa E. Tratamiento diuretico de la insuficiencia cardiaca // Rev. Esp. Cardiol. 2007; 7: 34-44.
12. Szady A.D., Hill J.A. Diuretics in heart failure: a critical appraisal of efficacy and tolerability // Drugs. 2009; 69: 2451-61.
13. Volz E.M., Felker G.M. How to use diuretics in heart failure // Curr. Treat. Options. Cardiovasc. Med. 2009; 11: 426-32.
14. Wang D.J., Gottlieb S.S. Diuretics: still the mainstay of treatment // Crit Care Med. 2008; 36: S89-94.
15. Pang P.S., Komajda M., Gheorghiade M. The current and future management of acute heart failure syndromes // Eur. Heart J. 2010; 31: 784-93.
16. Sarafidis P.A., Georgianos P.I., Lasaridis A.N. Diuretics in clinical practice. Part II: electrolyte and acid-base disorders complicating diuretic therapy // Expert. Opin. Drug. Safety. 2010; 9: 259-73.
17. Sarafidis P.A., Georgianos P.I., Lasaridis A.N. Diuretics in clinical practice. Part I: mechanisms of action, pharmacological effects and clinical indications of diuretic compounds // Expert. Opin. Drug Saf. 2010; 9: 243-57.
18. Picchio F.M., Formigari R., Balducci A. Pediatric heart failure // Minerva Cardioangiol. 2008; 56: 311-9. Review.
19. Shankar S.S., Brater D.C. Loop diuretics: from the Na-K-2Cl transporter to clinical use // Am. J. Physiol. Renal. Physiol. 2003; 284: F11-21.
20. Carota I., Theilig F., Oppermann M. et al. Localization and functional characterization of the human NKCC2 isoforms // Acta Physiol (Oxf). 2010 Feb 8. [Epub ahead of print]
21. Knauf H., Mutschler E. Clinical pharmacokinetics and pharmacodynamics of torasemide // Clin. Pharmacokinet. 1998; 34: 1-24. Review.
22. Vargo D.L., Kramer W.G., Black P.K., Smith W.B., Serpas T., Brater D.C. Bioavailability, pharmacokinetics, and pharmacodynamics of torsemide and furosemide in patients with congestive heart failure // Clin. Pharmacol Ther. 1995; 57: 601-9.
23. Hunt S.A., Abraham W.T., Chin M.H. et al. 2009 focused update incorporated into the ACC/AHA 2005 Guidelines for the Diagnosis and Management of Heart Failure in Adults: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines: developed in collaboration with the International Society for Heart and Lung Transplantation // Circulation. 2009; 119: e391-479.
24. European Society of Cardiology; Heart Failure Association of the ESC (HFA); European Society of Intensive Care Medicine (ESICM) et al. ESC guidelines for the diagnosis and treatment of acute and chronic heart failure 2008: the Task Force for the diagnosis and treatment of acute and chronic heart failure 2008 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association of the ESC (HFA) and endorsed by the European Society of Intensive Care Medicine (ESICM) // Eur. J. Heart Fail. 2008 Oct; 10(10): 933-89. Erratum in: Eur. J. Heart Fail. 2009; 11: 110. Eur. J. Heart Fail. 2010; 12: 416. Dosage error in article text.
25. Cosin J., Diez J.; TORIC investigators. Torasemide in chronic heart failure: results of the TORIC study // Eur. J. Heart Fail. 2002; 4: 507-13.
26. Reyes A.J. Diuretics in the therapy of hypertension // J. Hum. Hypertens. 2002; 161: S78-83.
27. Senzaki H., Kamiyama M., Masutani S., et al. Efficacy and safety of torasemide in children with heart failure // Arch. Dis. Child. 2008; 93: 768-71.
28. Veeraveedu P.T., Watanabe K., Ma M. et al. Torasemide, a long-acting loop diuretic, reduces the progression of myocarditis to dilated cardiomyopathy // Eur. J. Pharmacol. 2008; 581: 121-31.
29. Wargo K.A., Banta W.M. A comprehensive review of the loop diuretics: should furosemide be first line? // Ann. Pharmacother. 2009; 43: 1836-47.
30. Ishido H., Senzaki H. Torasemide for the treatment of heart failure // Cardiovasc. Hematol. Disord. Drug Targets. 2008; 8: 127-32.
31. Vormfelde S.V., Schirmer M., Hagos Y. et al. Torasemide renal clearance and genetic variation in luminal and basolateral organic anion transporters // Br. J. Clin. Pharmacol. 2006; 62: 323-35.
32. Vormfelde S.V., Schirmer M., Toliat M.R. et al. Genetic variation at the CYP2C locus and its association with torsemide biotransformation // Pharmacogenomics J. 2007; 7: 200-11.
33. Vormfelde S.V., Sehrt D., Toliat M.R., et al. Genetic variation in the renal sodium transporters NKCC2, NCC, and ENaC in relation to the effects of loop diuretic drugs // Clin. Pharmacol. Ther. 2007; 82: 300-9.
34. Vormfelde S.V., Toliat M.R., Schirmer M., Meineke I., Nurnberg P., Brockmoller J. The polymorphisms Asn130Asp and Val174Ala in OATP1B1 and the CYP2C9 allele *3 independently affect torsemide pharmacokinetics and pharmacodynamics // Clin. Pharmacol. Ther. 2008; 83: 815-7.
35. Werner U., Werner D., Heinbuchner S., et al. Gender is an important determinant of the disposition of the loop diuretic torasemide // J. Clin. Pharmacol. 2010; 50: 160-8.
36. Werner D., Werner U., Meybaum A., et al. Determinants of steady-state torasemide pharmacokinetics: impact of pharmacogenetic factors, gender and angiotensin II receptor blockers // Clin. Pharmacokinet. 2008; 47: 323-32.
37. Barbanoj M.J., Ballester M.R., Antonijoan R.M. et al. Comparison of repeated-dose pharmacokinetics of prolonged-release and immediate-release torasemide formulations in healthy young volunteers // Fundam. Clin. Pharmacol. 2009; 23: 115-25.
38. Lyseng-Williamson K.A. Torasemide prolonged release // Drugs. 2009; 69: 1363-72.
39. Barbanoj M.J., Ballester M.R., Antonijoan R.M., Puntes M., Gropper S., Santos B. et al. A bioavailability/bioequivalence and pharmacokinetic study of two oral doses of torasemide (5 and 10 mg): prolonged-release versus the conventional formulation // Clin. Exp. Pharmacol. Physiol. 2009; 36: 469-77.
40. Knauf H., Mutschler E., Velazquez H., Giebisch G. Torasemide significantly reduces thiazide-induced potassium and magnesium loss despite supra-additive natriuresis // Eur. J. Clin. Pharmacol. 2009; 65: 465-72.
41. Reyes A.J., Leary W.P. Response of serum potassium concentration to the diuretic torasemide: formal assessment // Am. J. Hypertens. 2002; 15: 38A. Abstract P-13.
42. Ficha tecnica de Sutril Neo®. https:// sinaem4.agemed.es /consaem/especialidad.do?metodo=verFichaWordPdf&co digo=67986&formato=pdf&formulario=FICHAS
43. Roca-Cusachs A., Aracil-Vilar J., Calvo-Gomez C. et al. Clinical effects of torasemide prolonged release in mild-tomoderate hypertension: a randomized noninferiority trial versus torasemide immediate release // Cardiovasc. Ther. 2008; 26: 91-100.
44. Goodfriend T.L., Ball D.L., Oelkers W., Bahr V. Torsemide inhibits aldosterone secretion in vitro // Life Sci. 1998; 63: PL45-PL50.
45. De Berrazueta J.R., Gonzalez J.P., de Mier I., Poveda J.J., Garcia-Unzueta M.T. Vasodilatory action of loop diuretics: A plethysmography study of endothelial function in forearm arteries and dorsal hand veins in hypertensive patients and controls // J. Cardiovasc. Pharmacol. 2007; 49: 90-5.
46. Liguori A., Casini A., Di Loreto M., Andreini I., Napoli C. Loop diuretics enhance the secretion of prostacyclin in vitro, in healthy persons, and in patients with chronic heart failure // Eur. J. Clin. Pharmacol. 1999; 55: 117-24.
47. Fortuno A., Muniz P., Ravassa S. Torasemide inhibits angiotensin II-induced vasoconstriction and intracellular calcium increase in the aorta of spontaneously hypertensive rats // Hypertension. 1999; 34: 138-43.
48. Fortuno A., Muniz P., Zalba G., Fortuno M.A., Diez J. The loop diuretic torasemide interferes with endothelin-1 actions in the aorta of hypertensive rats // Nephrol. Dial. Transplant. 2001; 16: 18-21.
49. Muniz P., Fortuno A., Zalba G., Fortuno M.A., Diez J. Effects of loop diuretics on angiotensin II-stimulated vascular smooth muscle cell growth // Nephrol. Dial. Transplant. 2001; 16: 14-17.
50. Thanikachalam P.V., Watanabe K., Thandavarayan R.A. Torasemide, a novel loop diuretic, reduces the progression of heart failure in rats with dilated cardiomyopathy // J. Cardiac. Fail. 2007; 13: Abstr. 013.
51. Veeraveedu P.T., Watanabe K., Ma M., Thandavarayan R.A., Palaniyandi S.S., Yamaguchi K., Suzuki K., Kodama M., Aizawa Y. Comparative effects of torasemide and furosemide in rats with heart failure // Biochem. Pharmacol. 2008 Feb 1; 75(3): 649-59.
52. Tanaka H., Watanabe K., Harima M. et al. Effects of various diuretics on cardiac function in rats with heart failure // Yakugaku Zasshi. 2009; 129: 871-9.
53. Lopez-Aguilera J., Anguita-Sanchez M., Garcia-Fuertes D. et al. Torasemide Prolonged-Release: A Review of its use in the Management of Edema Associated with Congestive Heart Failure // Clin. Med. Rev. Vasc. Health. 2010: 2. http://www.la-press.com/torasemide-prolonged-releasea-review-of-its-use-in-the-management-of—a1914
54. Dusing R., Piesche L. Second line therapy of congestive heart failure with torasemide // Prog. Pharmacol. Clin. Pharmacol. 1990; 8: 105-20.
55. Hariman R.J., Bremner S., Louie E.K. et al. Dose-response study of intravenous torsemide in congestive heart failure // Am. Heart J. 1994; 128: 352-7.
56. Patterson J.H., Adams K.F. Jr., Applefeld M.M., Corder C.N., Masse B.R. Oral torasemide in patients with chronic congestive heart failure: Effects on body weight, edema, and electrolyte excretion. Torsemide Investigators Group // Pharmacotherapy. 1994; 14: 514-21.
57. Brater D.C. Benefits and risks of torasemide in congestive heart failure and essential hypertension // Drug Saf. 1996; 14: 104-120.
58. Wittig T., Medert G. Torasemide in patients with chronic heart failure. Results of clinical administration in general practice // Fortschr. Med. 1996; 114: 24-8.
59. Scheen A.J., Vancrombreucq J.C., Delarge J., Luyckx A.S. Diuretic activity of torasemide and furosemide in chronic heart failure: A comparative double blind cross-over study // Eur. J. Clin. Pharmacol. 1986; 31: 35-42.
60. Stauch M., Stiehl L. Controlled, double-blind clinical trial on the efficacy and tolerance of torasemide in comparison with furosemide in patients with congestive heart failure – A multicenter study // Prog. Pharmacol. Clin. Pharmac. 1990; 8: 121-26.
61. Spannheimer A., Muller K., Falkenstein P., Reitberger U., Gutzwiller F., Follath F. Long-term diuretic treatment in heart failure: Are there differences between furosemide and torasemide? // Praxis (Bern 1994). 2002; 91: 1467-75.
62. Murray M.D., Deer M.M., Ferguson J.A. et al. Open-label randomized trial of torasemide compared with furosemide therapy for patients with heart failure // Am. J. Med. 2001; 111: 513-20.
63. Muller K., Gamba G., Jaquet F., Hess B. Torasemide vs. furosemide in primary care patients with chronic heart failure NYHA II to IV – Efficacy and quality of life // Eur. J. Heart Fail. 2003; 5: 793-801.
64. Kumar A., Aronow W.S., Vadnerkar A., Sivan K., Mittal S. Effects of Increased Dose of Diuretics on Symptoms, Weight, 6-Minute Walk Distance, and Echocardiographic Measurements of Left Ventricular Systolic and Diastolic Function in 51 Patients With Symptomatic Heart Failure Caused by Reduced Left Ventricular Ejection Fraction Treated With Beta Blockers and Angiotensin-Converting Enzyme Inhibitors or Angiotensin Receptor Blockers // Am. J. Ther. 2009. [Epub ahead of print].
65. Yamato M., Sasaki T., Honda K. et al. Effects of torasemide on left ventricular function and neurohumoral factors in patients with chronic heart failure // Circ. J. 2003; 67: 384-90. Erratum: Circ. J. 2003; 67: 565; Circ. J. 2003; 67: 649.
66. Negishi K., Kasama S., Araki Y. et al. Torasemide treatment improves cardiac sympathetic nerve activity as well as combined furosemide and spironolactone treatment in patients with heart failure // Circ. J. 2008; 72: Abst PJ-155.
67. Harada K., Izawa H., Nishizawa T. et al. Beneficial effects of torasemide on systolic wall stress and sympathetic nervous activity in asymptomatic or mildly symptomatic patients with heart failure: comparison with azosemide // J. Cardiovasc. Pharmacol. 2009; 53: 468-73.
68. Lopez B., Querejeta R., Gonzalez A., Sanchez E., Larman M., Diez J. Effects of loop diuretics on myocardial fibrosis and collagen type I turnover in chronic heart failure // J. Am. Coll. Cardiol. 2004; 43: 2028-35.
69. Kasama S., Toyama T., Hatori T. et al. Effects of torasemide on cardiac sympathetic nerve activity and left ventricular remodeling in patients with congestive heart failure // Heart 2006; 92: 1434-40.
70. Lopez B., Gonzalez A., Beaumont J., Querejeta R., Larman M., Diez J. Identification of a potential cardiac antifibrotic mechanism of torasemide in patients with chronic heart failure // J. Am. Coll. Cardiol. 2007; 50: 859-67.
71. Lopez B., Querejeta R., Gonzalez A., Beaumont J., Larman M., Diez J. Impact of treatment on myocardial lysyl oxidase expression and collagen cross-linking in patients with heart failure // Hypertension. 2009; 53: 236-42.
72. Pitt B., Nicklas J. Loop diuretics in patients with heart failure: time to change to torasemide? // J. Cardiovasc. Pharmacol. 2009; 53: 435-7.