Журнал «» 2(16) 2011
Вернуться к номеру
Порівняння впливу двох комбінацій (препарат Лоріста HD та бісопролол + гідрохлортіазид) на пружно-еластичні властивості артерій та центральний артеріальний тиск у пацієнтів із помірною та тяжкою артеріальною гіпертензією: результати дослідження ЕЛІЗА
Авторы: Радченко Г.Д., Міхєєва К.В., Кушнір С.М., Сіренко Ю.М., ННЦ «Інститут кардіології імені академіка М.Д. Стражеска» АМН України, м. Київ
Рубрики: Семейная медицина/Терапия, Кардиология, Терапия
Версия для печати
У даній статті наведено результати дослідження ЕЛІЗА, метою якого було порівняти антигіпертензивну ефективність, вплив на біохімічні показники та пружно-еластичні властивості артерій двох схем лікування: на основі препарату Лоріста HD (лозартан 100 мг + гідрохлортіазид (ГХТ) 25 мг) та комбінації бісопролол 10 мг + ГХТ 25 мг. Особливу увагу у даній статті було приділено вивченню впливу обраних високодозових комбінацій на центральний систолічний артеріальний тиск (цСАТ) та пружно-еластичні властивості артерій.
У дослідження було включено 60 пацієнтів із помірною та тяжкою АГ (середній рівень систолічного (САТ)/діастолічного (ДАТ) АТ — 173,3 ± 1,7/98,4 ± 1,2 мм рт.ст.). Усім пацієнтам на початку дослідження та на етапах лікування проводили наступні дослідження: вимірювання маси тіла та зросту, офісного САТ, ДАТ та частоти серцевих скорочень (ЧСС), добове моніторування АТ (ДМАТ), визначення швидкості поширення пульсової хвилі по артеріях еластичного (ШППХе) та м’язового (ШППХм) типу, визначення цСАТ, індексу приросту (АІх), біохімічне дослідження крові, електрокардіографію. Пацієнти були рандомізовані отримувати або Лорісту HD (n = 32), або комбінацію бісопролол 10 мг + ГХТ 25 мг (n = 27). Якщо призначена комбінація не призводила до досягнення цільового АТ через місяць, то до лікування додавали, поступово збільшуючи дози, амлодипін та на етапі 3 місяці — доксазозин.
За даними і офісного вимірювання АТ, і ДМАТ комбіноване лікування на основі препарату Лоріста HD було таке ж ефективне, як і лікування на основі комбінації бісопролол + ГХТ: офісний цільовий АТ було досягнуто у 96,9 та 92,6 % та цільовий середньодобовий АТ у 75 та 66,7 % (Р = НД) на 6-му місяці відповідно у групах Лорісти HD та бісопролол + ГХТ. Але лише під впливом лікування на основі Лорісти HD спостерігалося достовірне зменшення добового пульсового АТ (дПАТ) і варіабельності дСАТ, що при подальшому лікуванні може мати позитивне прогностичне значення. Будь-яке ефективне за даними вимірювання АТ на плечовій артерії лікування АГ супроводжувалося достовірним зниженням цСАТ. При цьому при однаковому зниженні АТ на плечовій артерії лікування на базі препарату Лоріста HD забезпечувало достовірно більший ступінь зниження цСАТ (23,0 ± 2,3 мм рт.ст. проти 15,4 ± 2,9 мм рт.ст., Р < 0,05) та досягнення на 6,5 мм рт.ст. меншого рівня цСАТ, ніж терапія на базі комбінації бісопролол + ГХТ. ЦСАТ пов’язаний із віком, статтю, рівнем АТ, а особливо САТ і ПАТ, що виміряні при ДМАТ, Вар.дСАТ та із показниками, що характеризують пружно-еластичні властивості артерій. У різних групах лікування спостерігалися різні фактори, що достовірно корелювали з кінцевим цСАТ та ступенем його зниження. У групі Лорісти HD кінцевий цСАТ був пов’язаний із рівнем кінцевих дПАТ та нічного пульсового АТ, Вар.дСАТ, які достовірно зменшувалися на фоні лише даного лікування. У групі бісопролол + ГХТ кінцевий цСАТ достовірно зворотно був пов’язаний із досягнутою на фоні лікування ЧСС, яка більш виражено, особливо за даними ДМАТ, зменшувалася при даній терапії. Ступінь зниження цСАТ у групі Лорісти HD достовірно був пов’язаний із рівнем цСАТ на початку та в кінці лікування, а у групі бісопролол + ГХТ, окрім рівня цСАТ на початку, із Вар.дСАТ у кінці, що не змінювалася достовірно на відміну від групи Лорісти HD, із добовим індексом ДАТ та рівнем глюкози на початку. Індекс маси тіла та рівень глюкози прямо корелювали з рівнем досягнутого цСАТ у групі Лорісти HD та зворотно — зі ступенем зниження цСАТ у групі бісопролол + ГХТ. Лоріста HD достовірно не впливала на середні величини показників, що характеризують пружно-еластичні властивості артерій, тоді як комбінація бісопролол + ГХТ достовірно збільшувала АІх, що свідчить про збільшення частки саме додаткового компонента навантаження на серце при застосуванні комбінації бета-блокатор + діуретик. На фоні лікування комбінацією Лоріста HD ступінь зменшення ШПРХe, ШППХм та АІх був достовірно більшим, ніж на фоні лікування комбінацією бісопролол + ГХТ. Більш низька ЧСС на фоні лікування асоціювалася з вищим цСАТ та більшим додатковим навантаженням (АІх) лише у групі бісопролол + ГХТ. У групі Лорісти HD зменшення ЧСС призводило до деякого нівелювання позитивної дії даної комбінації на еластичні властивості артерій великого калібру (менше зниження ШППХе), але не викликало достовірного збільшення цСАТ.
Артеріальна гіпертензія, комбінована терапія, лозартан, центральний артеріальний тиск, пружно-еластичні властивості артерій.
Обґрунтування
Артеріальний тиск (АТ), виміряний на плечовій артерії за допомогою сфігмоманометра, є важливим предиктором виникнення кардіоваскулярних подій [71]. Дані багатьох епідеміологічних та клінічних спостережень показали, що систолічний (САТ), діастолічний (ДАТ) та пульсовий (ПАТ) АТ змінюються протягом життя людини [6, 7, 26, 27, 29, 34, 41, 57, 63, 67]. ДАТ, що в основному визначається периферичним опором, збільшується до досягнення людиною середнього віку, а потім дещо знижується. САТ та ПАТ, що визначаються більшою мірою жорсткістю великих артерій, периферичним відбиванням пульсової хвилі та функцією лівого шлуночка, підвищується з віком постійно. Зміни жорсткості великих артерій (аорти та її основних гілок) в основному й обумовлюють зміни САТ, ДАТ та ПАТ після 50 років. Хоча ДАТ традиційно знаходився у фокусі лікування артеріальної гіпертензії (АГ), в останні роки почали наголошувати, що саме САТ та ПАТ мають більше значення для визначення прогнозу у людей, а особливо в осіб похилого віку. Завдяки виникненню нових технологічних можливостей спостерігається підвищений інтерес дослідників до вивчення відносин між жорсткістю артерій та кардіоваскулярною захворюваністю. Це пов’язане з декількома причинами. По-перше, доведено, що САТ має більш сильний вплив, ніж ДАТ, на частоту виникнення ішемічної хвороби серця (ІХС) в осіб старше 60 років [7, 26, 57]. По-друге, ПАТ має незалежне значення у прогнозі пацієнтів старшого віку та у пацієнтів із повторним інфарктом міокарда й серцевою недостатністю [7, 26]. Його зміни від впливом терапії також можуть мати клінічне значення [7]. По-третє, частота виникнення ізольованої систолічної АГ збільшується з віком та є основним фактором ризику виникнення інсульту, ІХС та кардіоваскулярної смерті [57, 63]. Формування ізольованої систолічної гіпертензії тісно пов’язане зі зміною жорсткості артерій. У цьому випадку, якщо діагноз АГ ставити тільки на основі САТ, то більше 90 % АГ можна діагностувати. У той же час якщо діагностичним критерієм буде тільки ДАТ, то АГ буде виявлена тільки у 20 % від загальної кількості хворих [27]. По-четверте, численні спостереження показали, зниження як САТ, так і ДАТ забезпечує зменшення ризику розвитку серцево-судинних ускладнень. У той же час клінічна практика доводить, що адекватний контроль САТ може бути досягнутий набагато рідше, ніж ДАТ. По-п’яте, із віком спостерігається тенденція до зниження фракції викиду лівого шлуночка і жорсткість артерій стає основною детермінантою підвищення САТ і ПАТ.
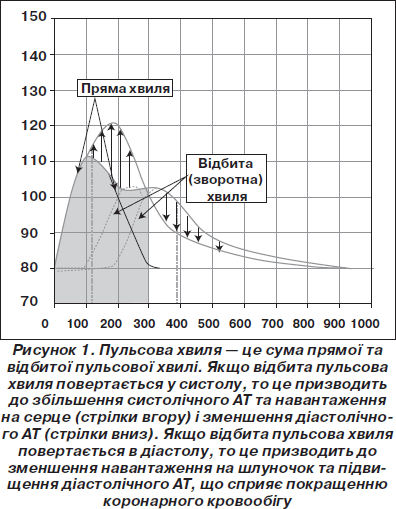
Еластичність судин залежить від структури стінки та від тиску розтягування, що в основному визначається середнім АТ [41]. Чим вищим є середній АТ, тим більше розтягнуті артерії і тим менша в них можливість розтягуватися ще більше під час серцевого викиду. Серцевий викид крові ініціює пульсову хвилю, що поширюється в напрямку на периферію. У місці, де опір найбільший, а це частіше в артеріолах, пульсова хвиля відбивається й починає рухатися у зворотному напрямку до серця, зустрічається з прямою хвилею. Сумація двох хвиль, прямої та зворотної, становить форму результуючої хвилі (рис. 1). Еластичність артерій, амплітуда та час серцевого викиду та умови відбивання пульсової хвилі (час поширення у прямому та зворотному напрямках, місце відбивання) обумовлюють форму результуючої пульсової хвилі. Чим більший час поширення пульсової хвилі та еластичність судин, тим пізніше пряма та зворотна хвилі зустрічаються. У молодих осіб ця зустріч відбувається в діастолу і САТ визначається лише серцевим викидом. Коли ж пульсова хвиля повертається раніше — в систолу (у людей похилого віку та при захворюваннях) — відбувається сумація хвиль (амплітуда результуючої пульсової кривої збільшується) і САТ, обумовлений серцевим викидом, додатково збільшується завдяки цій сумації. При цьому на серце буде припадати додаткове навантаження через таке збільшення рівня САТ.
У зв’язку з тим, що рівень САТ частково залежить від відбиття пульсової хвилі [56], то він може бути різним у різних місцях артеріального дерева. Тому центральний (аортальний) САТ (цСАТ) може відрізнятися від САТ, який був виміряний на плечовій артерії. Ця різниця може коливатися від 1 до 33 мм рт.ст. [54, 70]. При цьому через сумацію (у літературі вона носить назву «ампліфікація») у молодих та високих людей рівень периферичного САТ може бути вищим за норму, тоді як центральний САТ може бути нормальним [82]. Це може призвести до гіпердіагностики артеріальної гіпертензії (АГ) та вплинути на вибір професії або подальшу кар’єру цих молодих людей. У людей похилого віку, навпаки, ступінь зниження АТ на плечовій артерії під впливом терапії може не збігатися зі зниженням центрального АТ. При однаковому досягнутому рівні АТ на плечовій артерії цСАТ може значно відрізнятися, що призводить до недооцінки кардіоваскулярного ризику при збереженні цСАТ високим.
Як показали клінічні дослідження, саме центральний САТ та центральний ПАТ (цПАТ) більшою мірою визначають прогноз, ніж АТ, виміряний на плечовій артерії [18, 22, 28, 40, 49, 50, 58, 60, 64, 65, 69, 74, 85]. Так, у дослідженні CAF (Conduit Artery Function Evaluation) рівень цПАТ незалежно від інших факторів ризику асоціювався з гіршим перебігом [40, 49, 74, 85]. Аналіз відмінностей між групами, у яких або виникли серцево-судинні ускладнення, або не виникли, у дослідженні SHS (Strong Heart Study) продемонстрував, що цПАТ > 50 мм рт.ст., але не ПАТ, виміряний на плечовій артерії, був незалежним предиктором виникнення кардіоваскулярних подій [64, 65]. У дослідженні SAFFIHRE (Study of Atrial Fibrillation in High Risk Elderly) центральний, але не периферичний АТ визначав виникнення фібриляції передсердь у 800 пацієнтів похилого віку (старше 65 років) протягом 1,5 ± 1,1 року спостереження [76]. Окрім судинних ускладнень, цПАТ і цСАТ визначають ураження органів-мішеней (гіпертрофію лівого шлуночка, товщину комплексу інтима-медія, діастолічну дисфункцію лівого шлуночка, збільшення розміру лівого передсердя) та прогресування атеросклерозу (виникнення ішемічної хвороби серця, периферичного атеросклеротичного ураження) [28, 38, 64]. Супутні захворювання (ІХС, цукровий діабет, синдром обструктивного апное) та стани (дисліпідемія, куріння) супроводжуються збільшеним центральним АТ [55]. Існують також расові відмінності — у чорних молодих людей центральний АТ вищий, ніж у білих, що може пояснювати деякі відмінності у частоті виникнення тих або інших серцево-судинних подій.
В декількох дослідженнях останнього десятиріччя було показано, що різні антигіпертензивні препарати при однаковому зниженні АТ на плечовій артерії мають різний вплив на частоту виникнення серцево-судинних ускладнень [15, 21, 24, 30, 32, 42, 43, 45, 47, 48, 52, 53, 61, 62, 77]. При цьому висловлювалася думка, що переваги деяких препаратів пов’язані з їх незалежними від артеріального тиску ефектами. Але з багатьох короткострокових досліджень відомо, що різні класи антигіпертензивних препаратів по-різному впливають на вигляд (морфологію) пульсової хвилі та, відповідно, на параметри центральної гемодинаміки при однаковому впливі на АТ на плечовій артерії. І саме недостатня кількість даних у широкомасштабних дослідженнях щодо впливу різних препаратів на центральний АТ й породила багато дискусій щодо «унікальності» деяких із них. Ці дискусії стали менш значними після того, як завдяки застосуванню валідної неінвазивної методики оцінки центрального АТ з’явилися результати дослідження CAF. Це дослідження було частиною великого випробування ASCOT, і в ньому вперше продемонстровано, що різниця у впливі на прогноз двох режимів лікування (на основі атенололу та амлодипіну) була пов’язана з різним впливом на центральний АТ та морфологію пульсової хвилі. Окрім дослідження CAF, з’явилися дані декількох інших рандомізованих спостережень, у яких продемонстровано переваги одних препаратів над іншими у зниженні саме цСАТ і цПАТ. Навіть більш детальний аналіз результатів дослідження LIFE показав, що між групами лікування існувала різниця у зниженні ПАТ на користь лозартану [20]. А при порівнянні раміприлу та атенололу в дослідженні К. Hirata виявилося, що раміприл на 5 мм рт.ст. більше знижував аортальний АТ, ніж атенолол, що ставить під сумніви висновок дослідження НОРЕ — існування позитивного впливу раміприлу поза його властивостями знижувати АТ [31].
У дослідженні REASON було показано, що вплив антигіпертензивної терапії на рівень САТ залежить від багатьох факторів, у тому числі й від пружно-еластичних властивостей артерій: швидкість поширення пульсової хвилі (ШППХ) виявилася незалежним предиктором антигіпертензивної відповіді пацієнтів на лікування [42, 61]. ШППХ в основному пов’язана зі структурою стінок артерій та середнім АТ (тиск розтягування). При більшій ШППХ пульсова хвиля повертається з периферії до серця скоріше, у систолу, що обумовлює збільшення цСАТ та навантаження на серце (рис. 1). Тому зменшення ШППХ має асоціюватися зі зменшенням цСАТ.
ШППХ тісно пов’язана із такими факторами серцево-судинного ризику, як вік, паління, підвищений рівень холестерину (ХС), цукровий діабет, АГ та малорухливий спосіб життя [10, 12, 17, 37, 44, 51, 66, 72, 78]. При АГ ШППХ є незалежним фактором ризику кардіоваскулярної та загальної смерті [3, 11–13, 23, 43, 68, 69, 72]. Збільшення ШППХ по артеріях еластичного типу (ШППХе) на 5 м/с відповідає зростанню ризику загальної смерті в 1,34 раза та серцево-судинної смерті в 1,51 раза. Проте слід зазначити, що зміна ШППХ на 5 м/с — це дуже значне коливання, адже відомо, що у здорових осіб віком від 24 до 62 років ШППХ у середньому коливається в межах від 6 до 10 м/с [66].
У гіпертензивних пацієнтів навіть без інших ознак кардіоваскулярних захворювань ШППХ виявилася предиктором розвитку несприятливих подій [3, 8, 10, 15, 48, 79]. Тобто є класичним фактором ризику, незалежним від інших. При цьому особливо поганим є прогноз у пацієнтів із величиною ШППX більше 12 м/с та 20 м/с [11, 12, 41, 68]. У пацієнтів із цукровим діабетом при одному й тому ж рівні САТ кількість смертей була більшою серед осіб, у яких ШППХ була більшою за середню в популяції [18]. У хворих із нирковою недостатністю, як відомо, є дуже високий ризик виникнення серцево-судинних подій та загальної смерті. При цьому в дослідженні J. Blacher зі співавторами виявилося, що ШППХ по артеріях еластичного типу була незалежним фактором ризику загальної смерті та несприятливих подій у хворих з кінцевою стадією ниркової недостатності [11, 12, 41, 42, 69]. Зменшення ШППХ в обстежених хворих в даному дослідженні на 1 м/с під впливом терапії призводило до зменшення загальної смерті на 29 %.
Таким чином, вивчення впливу антигіпертензивної терапії на центральний АТ та пружно-еластичні властивості артерій є перспективним напрямком дослідження, що дозволить розробити підходи до вибору лікування АГ та максимально врахувати індивідуальний ризик пацієнта.
Мета дослідження
Дана стаття присвячена оцінці впливу двох схем комбінованого лікування на пружно-еластичні властивості артерій та центральний АТ у пацієнтів із неускладненою помірною та тяжкою АГ. Ця оцінка проводилася в межах дослідження ЕЛІЗА — «Ефективність та безпечність лікування на основі препарату ЛорІста HD (лозаратан 100 мг + гідрохлортіаЗид 25 мг) у порівнянні із комбінацією бісопролол 10 мг + ГХТ 25 мг у пацієнтів з помірною та важкою АГ» [1]. Особливістю цього дослідження було те, що застосовували високодозові комбінації (високі дози і лозартану, і бісопрололу, і ГХТ), лікування було достатньо агресивним (максимальні дози з перших днів, додавання інших антигіпертензивних препаратів до досягнення цільового АТ), довготривалим (6 місяців спостереження), оцінювали антигіпертензивну ефективність за даними декількох методів: офісного вимірювання АТ, добового моніторування АТ (ДМАТ), неінвазивного вимірювання центрального САТ та, окрім того, вивчали вплив на метаболізм та пружно-еластичні властивості артерій (швидкість поширення пульсової хвилі, індекс приросту).
Вибір антигіпертензивної терапії базувався на деяких міркуваннях. По-перше, саме для лозартану в дослідженні LIFE вперше було продемонстровано позитивний вплив на прогноз, при однаковому з атенололом зниженні АТ на плечовій артерії. При цьому вплив на центральний АТ, особливо у складі комбінації, не вивчався. По-друге, деякі опоненти дослідження LIFE говорили про те, що порівняння лозартану з атенололом є виграшним для лозартану заздалегідь, адже атенолол — препарат, що не є найкращим для порівняння: має негативний вплив на метаболізм глюкози та ліпідів, знижує незначною мірою або навіть не впливає на частоту виникнення несприятливих подій, особливо інсультів [9, 59]. Однією з причин цього є те, що атенолол не є високоселективним, особливо у високих дозах, та не має вазодилатуючих властивостей. Можливо, якби порівнювали з високоселективними бета-адреноблокаторами, то не відомо, чи мав би лозартан якісь переваги. Тому лозартан у нашому дослідженні порівнювали з бісопрололом — одним із найбільш селективних бета-адреноблокаторів. За своїм співвідношенням b1-/b2-блокуючої дії він поступається лише небівололу. Завдяки тривалому періоду напіввиведення (10–12 годин) він, як і лозартан, може призначатися один раз на добу [10, 16, 46, 73, 75, 80]. Серед інших селективних бета-адреноблокаторів він є метаболічно відносно нейтральним. Це єдиний бета-адреноблокатор, що зареєстрований FDA у вигляді фіксованої комбінації з гідрохлортіазидом (ГХТ) 6,25 мг для лікування АГ. Окрім того, бісопролол входить до складу небагатьох представників даної групи (метопролол сукцинат, карведилол, небіволол), рекомендованих для лікування серцевої недостатності. По-третє, нам уявлялося цікавим визначити, чи може додавання антагоністу кальцію (АК) (амлодипіну) вплинути на зміни центрального АТ, особливо у групі бета-блокатора.
Матеріали і методи
У дослідження було включено 60 пацієнтів з помірною та тяжкою АГ (середній рівень систолічного/діастолічного АТ — 173,3 ± 1,7/98,4 ± 1,2 мм рт.ст.). Один пацієнт у подальшому був виключений із дослідження через те, що він не прийшов на повторні обстеження (на етапах 2 та 3 місяці). Критеріями включення у дослідження були:
— чоловіча та жіноча стать, вік від 18 до 75 років;
— есенціальна артеріальна гіпертензія;
— рівень офісного САТ на момент включення > 160, але < 220 мм рт.ст. та ДАТ > 90, але < 120 мм рт.ст.;
— відсутність критеріїв виключення.
Критеріями виключення були: ангіоневротичний набряк в анамнезі, гіперкаліємія (> 5,5 ммоль/л) або гіпокаліємія (< 3,5 ммоль/л), стенотичне двостороннє ураження судин нирок, гостра серцева недостатність, порушення серцевого ритму (хронічна фібриляція передсердь, часта екстрасистолічна аритмія, шлуночкові або надшлуночкова тахікардія (ЧСС більше 100 уд. за 1 хв), порушення АВ-провідності, або синусова брадикардія, або синдром слабкості синусового вузла, наявність вад серця, вагітність або лактація, злоякісний перебіг АГ, вторинна АГ, виражена артеріальна гіпотонія (САТ нижче 90 мм рт.ст.), бронхіальна астма, декомпенсовані захворювання печінки (рівень АСТ, АЛТ вищий за верхню границю норми у 3 рази), гостра або хронічна ниркова недостатність (рівень креатиніну сироватки крові 133 мкмоль/л), серцева недостатність вище II функціонального класу (згідно з Нью-Йоркською класифікацією), інфаркт міокарда в анамнезі строком менше ніж 6 місяців до моменту включення у дослідження, гостре порушення мозкового кровообігу в анамнезі, наявність стенокардії напруження ІІІ–IV функціонального класу або вазоспастичної стенокардії, інфекційні та онкологічні захворювання, стани, що супроводжуються ендогенною депресією (чи наявність депресивних станів у сім’ї), цукровий діабет, ожиріння (ІМТ > 35 кг/м2), виражені захворювання периферичних судин, синдром Рейно, стан після хірургічного втручання (менше одного місяця), прийом стероїдних та нестероїдних протизапальних засобів, контрацептивів, значні психічні розлади, неможливість відмінити попередню антигіпертензивну терапію, участь в іншому дослідженні.
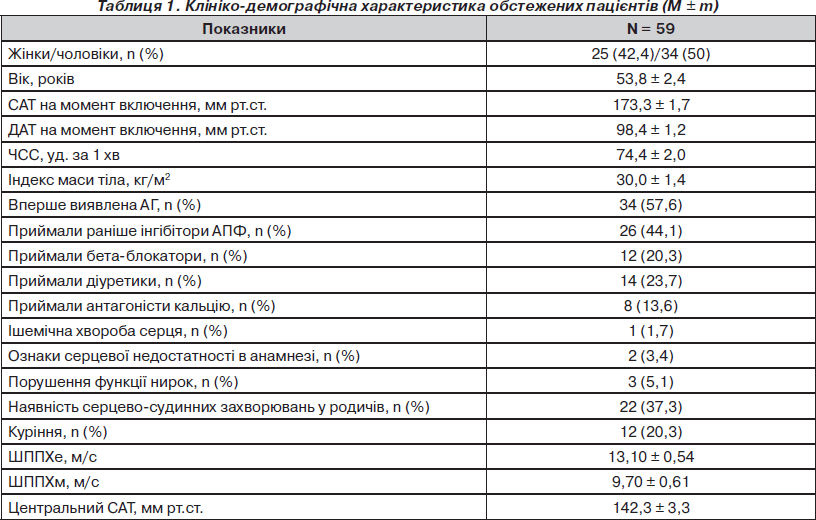
Характеристика включених у дослідження пацієнтів подана в табл. 1.
Як видно з табл. 1, у дослідження включено майже однакову кількість жінок та чоловіків, середній рівень АТ відповідав критеріям включення, більшість хворих мали надлишкову масу тіла. Окрім того, більше половини пацієнтів мали вперше виявлену АГ. Ті, які раніше лікувалися, найчастіше приймали інгібітори АПФ. У 37,3 % хворих близькі родичі мали серцево-судинні захворювання у віці до 55 років. Звертало також увагу те, що більшість включених у дослідження пацієнтів мали високу ШППХе — середня величина швидкості перевищувала 12 м/с, це означає, що більшість пацієнтів мали ураження судин як органа-мішені. Рівень цСАТ значно перевищував нормальне значення (120 мм рт.ст.), але був дещо нижчим від рівня офісного САТ. Це є цілком закономірним, адже з віком амплітуда поширення пульсової хвилі від аорти на периферію зменшується, а рівень АТ, що вимірюється на плечовій артерії, не завжди відображає центральний тиск [35, 82, 83]. Різниця може досягати 1–33 мм рт.ст. [27, 35, 66], як і в нашому дослідженні.
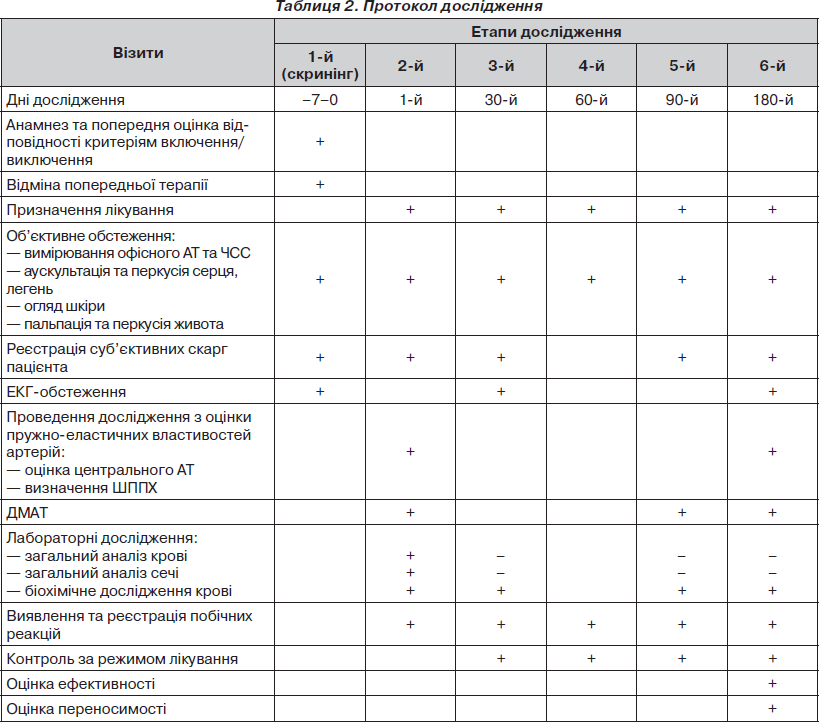
Протокол дослідження. Протокол дослідження поданий у табл. 2. Усім пацієнтам на початку дослідження та на етапах лікування проводили такі дослідження: вимірювання маси тіла та зросту, вимірювання офісного САТ, ДАТ (оДАТ) та ЧСС, добове моніторування АТ, визначення ШППХ по артеріях еластичного та м’язового (ШППХм) типу, визначення цСАТ, біохімічне дослідження крові (визначення рівнів калію, натрію, креатиніну, сечової кислоти, АЛТ, АСТ, білірубіну, глюкози, загального холестерину, тригліцеридів (ТГ), холестерину високої та низької щільності сироватки крові), ЕКГ.
Вимірювання САТ та ДАТ проводили на початку дослідження, після семиденної (у разі необхідності) відміни всіх антигіпертензивних препаратів та на етапах спостереження. Вимірювали АТ у положенні сидячи тричі з інтервалом 1–2 хвилини. Визначали середнє з трьох вимірів. ЧСС визначали після другого вимірювання.
Індекс маси тіла (ІМТ) визначали за формулою: ІМТ = маса тіла/(ріст)2, кг/м2.
Реєстрацію ЕКГ проводили на шестиканальному самописі «Юнікард» (Україна). Визначали наявність загальноприйнятих ознак ГЛШ (індекс Соколова (SV1 + RV5/RV6 > 35 мм), вольтажний індекс Корнелла (R aVL + S V3 > 28 мм у чоловіків та > 20 мм — у жінок), індекс тривалості Корнелла (вольтаж помножити на тривалість) > 2400 мм • мс, індекс Ромхілт — Estes > 5 балів) та порушення ритму [2].
ДМАТ проводили на портативному апараті АВРМ-04 (Meditech, Угорщина). При цьому вивчали такі показники: середньодобовий (24), денний (д), нічний (н) та максимальний (Макс.) САТ і ДАТ, ЧСС. При комп’ютерному аналізі ДМАТ для САТ і ДАТ розраховували Час.Ін., що характеризує часове перевантаження тиском упродовж доби і визначається як відсоток вимірів АТ, що перевищує 140/90 мм рт.ст. удень і 120/80 мм рт.ст. уночі. Також визначали Ін.Пл., що є площею між кривою підвищеного АТ та лінією границі норми, а також Вар. обчислювали як стандартне відхилення величини АТ. Крім того, за допомогою програмного забезпечення вираховували добовий індекс (ДІ) — процент зниження нічного АТ порівняно з денним. ДМАТ проводили в такому режимі: у денний час — кожні 15 хв, уночі (з 22.00 до 6.00) — кожні 30 хв. Хворі вели звичайний спосіб життя, з побутовими фізичними і психоемоційними навантаженнями [81].
Величину ранкового підйому АТ (ВРП) розраховували як різницю між Макс.САТ або Макс.ДАТ у ранкові часи (від 06.00 до 12.00) та, відповідно, мінімальний (Мін.) САТ або Мін.ДАТ під час сну:
ВРП = Макс.АТ – Мін.АТ (мм рт.ст.).
Швидкість ранкового підйому (ШРП) вираховували за формулою:
ШРП = (Макс.АТ – Мін.АТ)/(Макс.t – Мін.t) (мм рт.ст. за 1 год),
де t — час максимального (ранкового з 6.00 до 12.00) чи мінімального (під час сну) АТ, год [36].
Біохімічні аналізи виконувалися на автоматичному фотометрі Livia (Сormay, Польща) у лабораторії ННЦ «Інститут кардіології імені академіка М.Д. Стражеска» АМН України (завідуюча відділенням Г.В. Пономарьова). Визначали рівень креатиніну, електролітів (калію та натрію), глюкози, загального ХС, тригліцеридів, ХС ліпопротеїдів високої щільності (ХС ЛПВЩ), ХС ліпопротеїдів низької щільності (ХС ЛПНЩ), ХС ліпопротеїдів дуже низької щільності (ХС ЛПДНЩ) сироватки крові. Кліренс креатиніну, що відображає швидкість клубочкової фільтрації, визначали розрахунково за формулою Cockroft — Gault. Проводили також загальноклінічні дослідження крові та сечі.
ШППХ та центральний АТ визначалися на апараті Sphygmocor-PVx (AtCor Medical Pty Ltd, Австралія), з’єднаному з персональним комп’ютером, що дозволяє проводити аналіз форми пульсової хвилі та визначати ШППХе та ШППХм. П’єзодатчики встановлювали на загальній правій артерії, на стегновій артерії та на радіальній артерії правого передпліччя під візуальним (на моніторі) та автоматичним контролем якості, що здійснювався за допомогою відповідної програми приладу. Час запізнювання пульсової хвилі та швидкість поширення пульсової хвилі, центральний АТ визначалися автоматично за допомогою програмного забезпечення приладу після введення величини відстані між датчиками, яка вимірювалася сантиметровою смужкою. Для оцінки пружно-еластичних властивостей артерій еластичного типу ШППХ визначали на сегменті «сонна артерія — стегнова артерія», для оцінки пружно-еластичних властивостей артерій м’язового типу — на сегменті «сонна артерія — радіальна артерія». Окрім ШППХ, визначали також центральний АТ за допомогою програмного забезпечення приладу на основі артеріального тиску на плечовій артерії та форми отриманої пульсової хвилі у висхідній аорті (формула визначена виробником, та проведена стандартизація при інтрааортальному вимірюванні артеріального тиску).
Робота приладу Sphygmocor-PVx базується на методі апланаційної тонометрії, що дозволяє отримувати криву периферичної пульсової хвилі. Записана крива зміни тиску на а.radialis та а.carotis автоматично калібрувалася до АТ, що вимірюється на a.brachialis. При аналізі систолічної частини кривої поряд із цСАТ визначали такий показник, як індекс приросту (АIх) та час вигнання (ЕТ) (рис. 2).
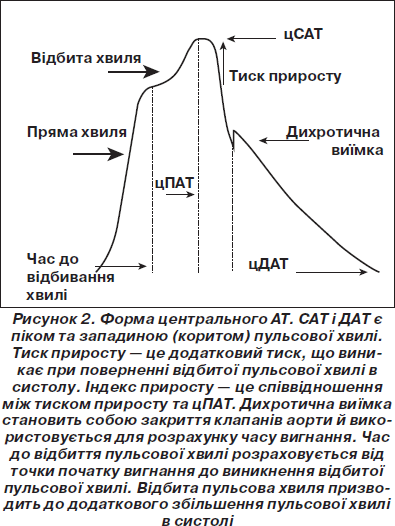
Індекс приросту є співвідношенням різниці між другим та першим систолічним піком кривої пульсової хвилі до ПАТ, відображеним у відсотках. Він може мати негативне значення (зі знаком мінус), частіше в дуже молодих людей із еластичними судинами. AIx залежить від інтенсивності відбивання пульсової хвилі, тривалості періоду вигнання крові із шлуночків серця, часу відбивання пульсової хвилі (час поширення пульсової хвилі від серця на периферію та у зворотному напрямку). Останній фактор тісно пов’язаний із ШППХ. Чим більша швидкість, тим раніше зустрічається відбита пульсова хвиля з прямою, тим раніше виникає перший систолічний пік і тим більша різниця між другим та першим систолічним піком. Інтенсивність відбивання залежить від діаметра та еластичності малих артерій та артеріол. Окрім того, AIx збільшується при підвищенні середнього АТ, зменшується при збільшенні частоти серцевих скорочень [33, 84], негативно корелює з ростом людини — чим більший зріст, тим менша величина індексу приросту [55]. Останнім фактом пояснюється більше значення показника в осіб жіночої статі у популяції [55]. Дослідження з близнюками виявили, що величина індексу приросту частково успадковується [44, 55]. ЕТ — час вигнання визначався у відсотках як співвідношення між тривалістю систоли та загальним періодом систола + діастола.
За даними літератури, проведення аналізу пульсової хвилі у пацієнтів із різними факторами ризику виявило, що незалежно від рівня АТ індекс приросту підвищується з віком, у пацієнтів з цукровим діабетом першого типу та з гіперхолестеринемією [17, 51, 83, 84]. У багатьох клінічних проспективних дослідженнях (ASCOT, SEARCH, FIELD та інших) вивчалося прогностичне значення АІх. Виявилося, що приріст величини індексу на 10 % супроводжується збільшенням ризику виникнення серцево-судинних подій в 1,28 раза незалежно від інших факторів [23]. При цьому в пацієнтів із кінцевою стадією ниркової недостатності вплив індексу приросту на прогноз не залежав від величини ШППХ [41, 44].
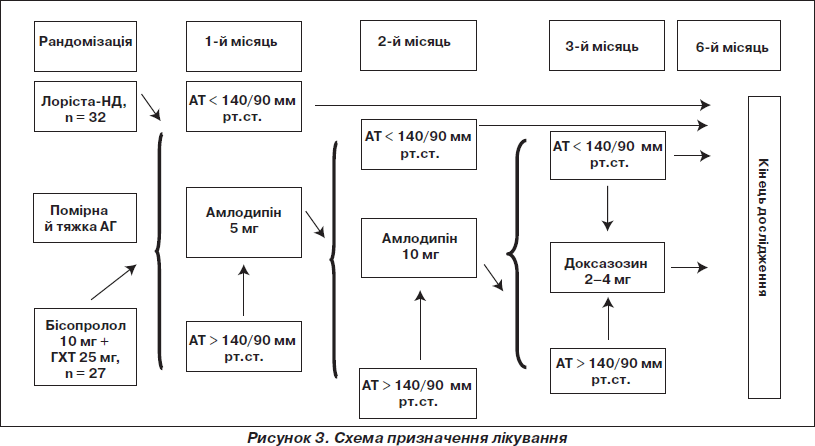
Методи лікування. Якщо пацієнти не приймали ліки на момент скринінгу, то в день рандомізації пацієнтам методом сліпих конвертів призначали фіксовану комбінацію Лорісти HD (лозартан + ГХТ у добовій дозі 100 та 25 мг відповідно) виробництва компанії KRKA (Словенія) або нефіксовану комбінацію бісопролол (конкор у добовій дозі 10 мг виробництва компанії Nycomed (Німеччина)) та гідрохлортіазид (гіпотіазид у добовій дозі 25 мг виробництва Sanofi-Aventis (Франція)). Перший прийом ліків відбувався в офісі лікаря-дослідника. Оцінку антигіпертензивної ефективності проводили через місяць лікування. Якщо рівень АТ через 1 місяць лікування становив більше ніж 140/90 мм рт.ст., то до лікування основним препаратом додавали амлодипін 5 мг (препарат тенокс виробництва компанії KRKA, Словенія), дозу якого збільшували до 10 мг при неефективності терапії на 2-му місяці лікування. Якщо на 3-му місяці лікування рівень АТ залишався вищим за 140/90 мм рт.ст., то до лікування додавали доксазозин (препарат кардура виробництва компанії Pfizer, США) у добовій дозі 2–4 мг. Схема лікування наведена на рис. 3.
Якщо пацієнт до включення у дослідження отримував антигіпертензивні препарати, то рандомізації передував період відміни, що становив 7 днів. У кінці періоду відміни повторно оцінювали критерії включення в дослідження. Якщо пацієнт відповідав критеріям включення і не мав критеріїв виключення, то відбувалася рандомізація пацієнта за наведеною вище схемою.
Супутнє лікування включало модифікацію способу життя, прийом статинів та ацетилсаліцилової кислоти. Групи рандомізації були порівнянними за кількістю пацієнтів, яким призначали супутні препарати.
Статистична обробка. Статистичну обробку результатів проводили після створення баз даних у системах Microsoft Excel. Середні показники обстежених пацієнтів визначали за допомогою пакету аналізу в системі Microsoft Excel. Усі інші статистичні розрахунки проводили за допомогою програми SPSS 13.0. Достовірність різниці середніх між групами визначалася методом незалежного t-тесту для середніх. Порівняння динаміки показників на етапах лікування проводили за допомогою парного двовибіркового t-тесту для середніх. Кореляційний аналіз проводили після визначення характеру розподілу за Spearman.
Результати дослідження
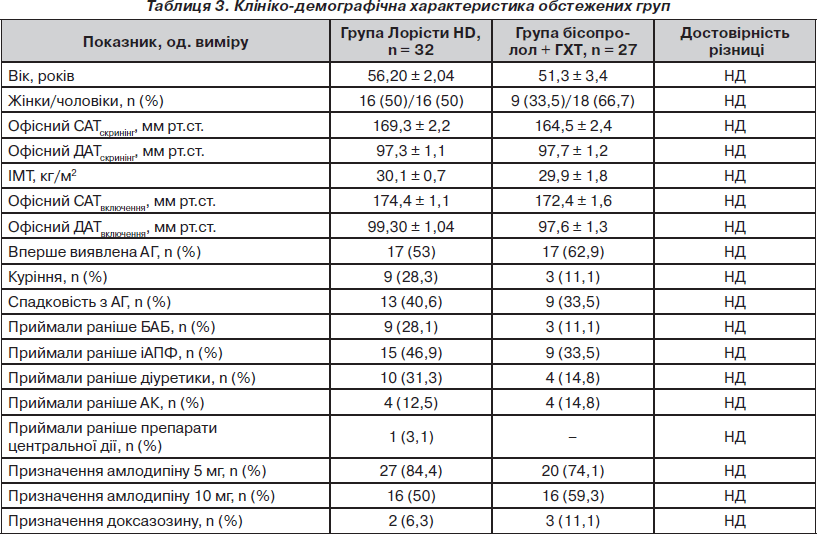
Клініко-демографічна характеристика груп, що порівнювалися, подана в табл. 3. Як видно з табл. 3, групи достовірно не відрізнялися між собою за основними демографічними характеристиками, рівнем АТ на момент скринінгу та рандомізації, терапією, яку вони приймали до включення у дослідження та протягом періоду участі у дослідженні. Слід зазначити, що суттєва частка пацієнтів (46,9 та 33,5 % у групах Лорісти HD і бісопролол + ГХТ відповідно) в обох групах мали досвід застосування інгібіторів АПФ.
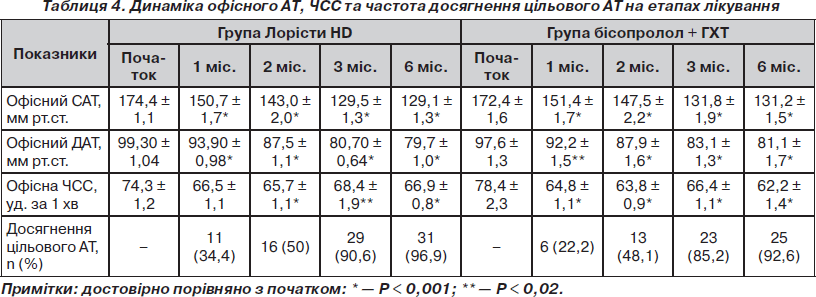
Ефективність терапії за даними офісного вимірювання АТ. Динаміка офісного АТ і ЧСС наведена в табл. 4. Як видно з табл. 4, в обох групах уже на першому місяці прийому призначеної комбінації спостерігалося достовірне зниження офісних САТ і ДАТ. На 6-му місяці терапії офісний САТ/ДАТ у середньому знизився на 44,7 ± ± 0,9/18,4 ± 1,1 мм рт.ст. у групі Лорісти HD та на 42,2 ± 1,1/16,5 ± 0,8 мм рт.ст. у групі бісопролол + ГХТ (Р = НД/НД). Окрім того, у групі бісопролол + ГХТ спостерігалося достовірне зменшення ЧСС починаючи з першого місяця лікування. У групі Лорісти HD також спостерігалося достовірне зниження ЧСС, але починаючи з 2-го місяця терапії. ЧСС у групі Лорісти HD знизилася в середньому на 5,9 ± 1,6, а у групі бісопролол + ГХТ — на 12,9 ± 3,9 уд. за 1 хв (Р = НД).
Отримані нами дані щодо ступеня зниження АТ дещо відрізняються від даних дослідження LIFE, у якому за перші 6 місяців лікування у групі лозартану рівень САТ/ДАТ достовірно знизився лише на 25,1/12,6 мм рт.ст. У нашому ж дослідженні цей показник становив 45,3/19,6 мм рт.ст. Це можна пояснити декількома причинами. По-перше, вибіркою пацієнтів, адже в наше дослідження було включено багато пацієнтів, які раніше зовсім не лікувалися і, відповідно, вони могли добре реагувати на будь-яку призначену терапію. Окрім того, середній вік хворих, включених у наше дослідження, був дещо меншим (53,8 року), ніж у дослідженні LIFE (66,9 року). Відповідно, меншою була частка пацієнтів з ізольованою систолічною гіпертензією, при якій, як відомо, важко швидко досягнути цільового АТ. По-друге, лікування в дослідженні LIFE починали з 50 мг лозартану, а потім поступово збільшували дозу, додавали ГХТ та інші антигіпертензивні препарати протягом перших 6 місяців. У нашому ж дослідженні з самого початку призначали високі дози й лозартану, і ГХТ. Через 1 місяць до лікування зразу додавали амлодипін. Тобто тактика ведення хворих була більш агресивною. По-третє, у дослідження LIFE було включено значно більшу кількість пацієнтів (n = 4126), ніж у наше, що, безумовно, могло позначитися на даних при статистичній обробці.
Загалом цільового офісного АТ (< 140/90 мм рт.ст.) було досягнуто у 34,4; 50; 90,6 та 96,9 % (відповідно на 1, 2, 3 та 6-му місяці) пацієнтів на фоні лікування на базі препарату Лорісти HD та у 22,2; 48,1; 85,2; 92,6 % (відповідно на 1, 2, 3 та 6-му місяці) пацієнтів, у яких лікування базувалося на комбінації бісопролол + ГХТ. Різниця між групами у частоті досягнення цільового АТ на відповідних етапах була недостовірною.
Більшості пацієнтів обох груп було додатково до основної терапії (табл. 3) призначено амлодипін 5 мг (84,4 та 74,1 % відповідно, Р = НД), та половина обстежених потребувала підвищення дози амлодипіну до 10 мг (50 та 59,3 %, Р = НД), що свідчить про тяжкість АГ у пацієнтів, включених у дослідження. Лише 2 (6,3 %) пацієнти групи Лорісти HD та 3 (11,1 %) пацієнти групи бісопролол + ГХТ (Р = НД) не досягли цільового рівня АТ на етапі 3 місяці лікування, і їм було додатково призначено доксазозин. При цьому в одного пацієнта з групи Лорісти HD та в одного пацієнта з групи бісопролол + ГХТ не вдалося досягнути цільового рівня АТ і на 6-му місяці лікування. Вони були направлені на додаткове обстеження для виключення можливих причин резистентної АГ (стенозу ниркових артерій, пухлин надниркових залоз тощо).
Таким чином, обидві схеми лікування були ефективними щодо зниження офісного АТ. Тобто якщо лікар зацікавлений у результатах роботи та проводить агресивну антигіпертензивну терапію, то цільовий АТ можна досягнути у значної більшості хворих з неускладненою помірною та тяжкою АГ.
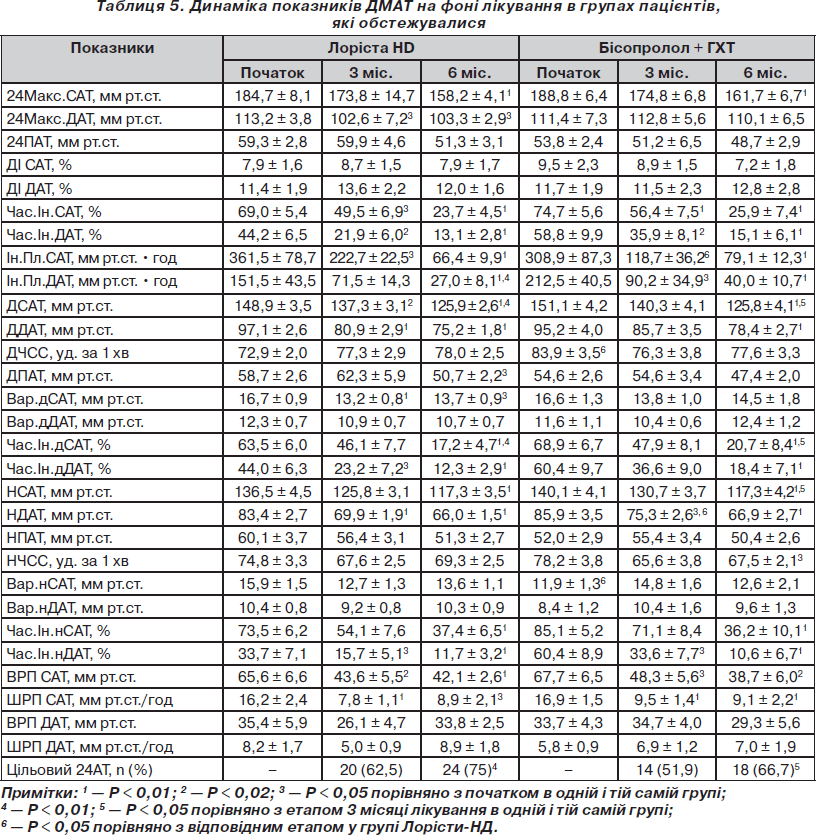
Ефективність за даними ДМАТ. Динаміка 24 САТ/ДАТ та ЧСС наведена на рис. 4. Як видно з рис. 4, у групі Лорісти HD 24САТ/24ДАТ достовірно знизився вже на 3-му місяці лікування. У групі бісопролол + ГХТ зниження цих показників було значним, але недостовірним. До 6-го місяця прийому терапії спостерігалося достовірне зниження САТ/ДАТ в обох групах. Загалом середнє зниження САТ/ДАТ становило 24,6 ± 1,3/17,6 ± 1,1 у групі Лорісти HD та 24,1 ± 1,8/16,9 ± 1,2 мм рт.ст. у групі бісопролол + ГХТ (Р = НД). За даними ДМАТ у групі Лорісти HD 24ЧСС достовірно не змінилася, тоді як в іншій групі достовірно зменшилася на 12 уд. за 1 хв, як і слід було очікувати при прийомі бета-адреноблокатора.
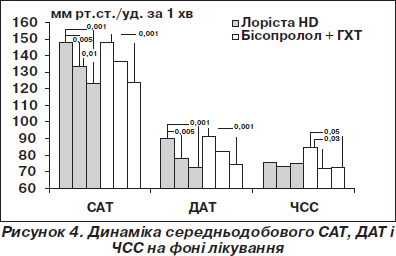
Цільового середньодобового АТ (табл. 5) було досягнуто у 62,5 та 51,9 % осіб (Р = НД) на 3-му місяці лікування, у 75 та 66,7 % пацієнтів (Р = НД) на 6-му місяці відповідно у групах Лорісти HD та бісопролол + ГХТ. Як видно, ефективність терапії за даними ДМАТ була дещо нижчою, ніж за даними офісного вимірювання, що є порівнянним із даними літератури, згідно з якими .частота досягнення цільового АТ за даними офісного вимірювання завжди нижча, ніж при ДМАТ, адже офісне вимірювання — це лише частинка, що характеризує підвищений протягом доби АТ.
Динаміка інших показників ДМАТ наведена в табл. 5. Як видно з табл. 5, на фоні лікування обома препаратами достовірно знизився Макс.САТ. Макс.ДАТ достовірно знизився лише у групі Лорісти HD. Обидві схеми лікування достовірно не впливали на добовий профіль АТ: ДІ достовірно не змінився в жодній групі.
Денні САТ і ДАТ, як і 24САТ/24ДАТ, достовірно зменшилися в обох групах на етапі 6 місяців лікування та на етапі 3 місяці в групі Лорісти HD. Достовірне зниження нічних САТ і ДАТ спостерігалось в обох групах на етапі 6 місяців лікування. У групі Лорісти HD на відміну від групи порівняння спостерігалося достовірне зменшення дПАТ та варіабельності дСАТ. Зниження ПАТ може непрямо свідчити про покращення пружно-еластичних властивостей аорти [29]. Зниження ж варіабельності АТ у подальшому може мати позитивне прогностичне значення, адже відомо, що підвищена (а на початку дослідження вона була підвищена порівняно з нормою в обох групах) варіабельність асоціюється із збільшенням частоти виникнення несприятливих подій [81].
Ефективність обох схем лікування підтверджувалася достовірним зменшенням Час.Ін. та Ін.Пл. для САТ і ДАТ за добу, денний період і нічний.
Важливим також є те, що препарати призначалися один раз на добу і при обох схемах лікування спостерігалося достовірне зниження ВРП САТ і ШРП САТ, що в подальшому може мати сприятливий вплив на прогноз, адже саме ранковий підйом АТ є однією з причин більш частого виникнення серцево-судинних подій саме в ранкові часи [36, 81].
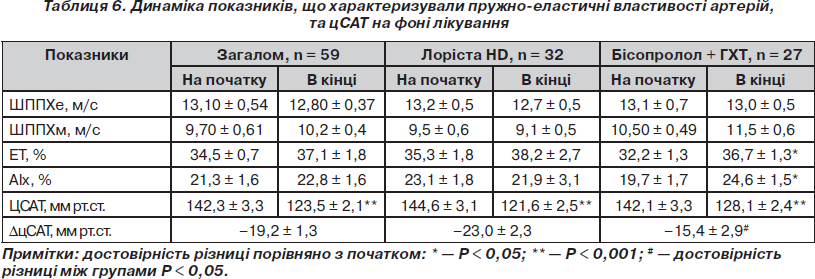
Оцінка пружно-еластичних властивостей артерій та змін центрального артеріального тиску. Динаміка параметрів, що вивчалися, подана в табл. 6. Як видно з табл. 6, загалом у всіх хворих, включених у дослідження, спостерігалося достовірне зниження лише цСАТ, що в середньому становило 19,2 ± 1,3 мм рт.ст. Незважаючи на зниження АТ за даними усіх методів вимірювання (офісне, добове, апланаційна тонометрія), ми не спостерігали в нашому дослідженні в загальній групі достовірного зменшення ні ШППХ, ні АІх, що викликало деяке здивування. Адже зменшення АТ має знизити тиск розтягування й тим самим зменшити хоча би ШППХ. Можливо, отримані результати були пов’язані з малим строком спостереження за достатньо тяжкою категорією пацієнтів (з помірною та тяжкою АГ), адже більшість подібних досліджень включали хворих із меншим рівнем АТ, у яких достовірні позитивні зміни ШППХе з’являлися лише на 3–6-му місяці лікування. Тому, імовірно, у більш тяжкої категорії пацієнтів ці достовірні зміни можуть виникнути після 6 місяців ефективного лікування АГ.
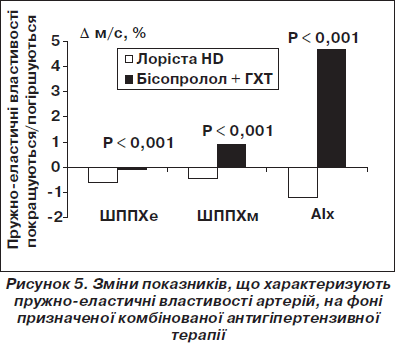
При порівнянні динаміки показників, що характеризують жорсткість артерій, та рівня цСАТ у групах лікування (табл. 6) виявилося, що на фоні терапії, яка базувалася на Лорісті HD, як і в загальній групі, достовірно не змінилися середні величини ШППХе, ШППХм, EТ та АІх. У групі бісопролол + ГХТ спостерігалося достовірне збільшення величини EТ, що свідчить про подовження систоли в більшості пацієнтів цієї групи, та достовірне збільшення АІх, що свідчить про збільшення у складі результуючої пульсової хвилі саме частки додаткового систолічного навантаження на серце за рахунок сумації прямої та відбитої хвилі та може пояснювати різницю між рівнем досягнутого цСАТ на фоні Лорісти HD та бісопролол + ГХТ — 6,5 мм рт.ст. при майже однаковому рівні досягнутого АТ на плечовій артерії. Звертало на себе увагу те, що у групі Лорісти HD спостерігалася все ж таки тенденція до зменшення ШППХе (покращення еластичності аорти), а у групі порівняння — тенденція до збільшення ШППХм (погіршення еластичності артерій м’язового типу). При цьому DШППХе, DШППХм та DАІх у групі Лорісти HD були достовірно більшими, ніж у групі бісопролол + ГХТ: відповідно 0,63 ± 0,09 м/с, 0,46 ± 0,08 м/с, 1,2 ± 0,5 % проти 0,1 ± 0,1 м/с, –0,91 ± 0,1 м/с, –4,7 ± 0,4 % (Р < 0,001 при порівнянні всіх трьох показників) (рис. 5). Ці дані свідчать, що лікування на основі комбінації Лорісти HD на відміну від комбінації бісопролол + ГХТ сприяло більш вираженому покращенню пружно-еластичних властивостей артерій.
Рівень цСАТ достовірно знизився в обох групах, але в групі Лорісти HD на величину, дещо більшу за середню в загальній групі та достовірно більшу, ніж у групі бісопролол + ГХТ (табл. 6, рис. 6). Різниця в досягнутому рівні цСАТ, як уже було сказано вище, між групами становила 6,5 мм рт.ст. Вона була недостовірною (Р < 0,1), можливо, через малу кількість обстежених. У дослідженні ASCOT було обстежено 2199 пацієнтів і різниця між групами лікування становила всього 4,3 мм рт.ст., але з огляду на велику кількість обстежених вона була достовірною [85].
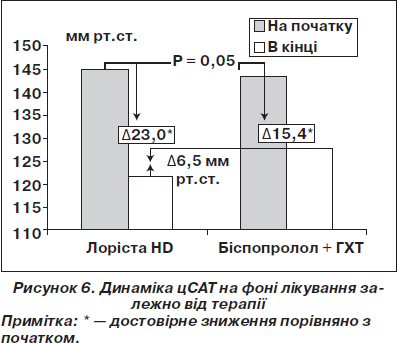
Таким чином, будь-яке ефективне за даними вимірювання АТ на плечовій артерії лікування АГ супроводжувалося достовірним зниженням цСАТ. При цьому при однаковому зниженні АТ на плечовій артерії лікування на базі препарату Лорісти HD забезпечувало достовірно більший ступінь зниження цСАТ та досягнення на 6,5 мм рт.ст. меншого рівня цСАТ, ніж терапія на базі комбінації бісопролол + ГХТ. Лоріста HD достовірно не впливала на середні величини показників, що характеризують пружно-еластичні властивості артерій, тоді як комбінація бісопролол + ГХТ достовірно збільшувала АІх, що свідчить про збільшення частки саме додаткового компонента навантаження на серце при застосуванні комбінації бета-блокатор + діуретик. На фоні лікування комбінацією Лорісти HD ступінь зменшення ШППХe, ШППХм та АІх був достовірно більшим, ніж на фоні лікування комбінацією бісопролол + ГХТ.
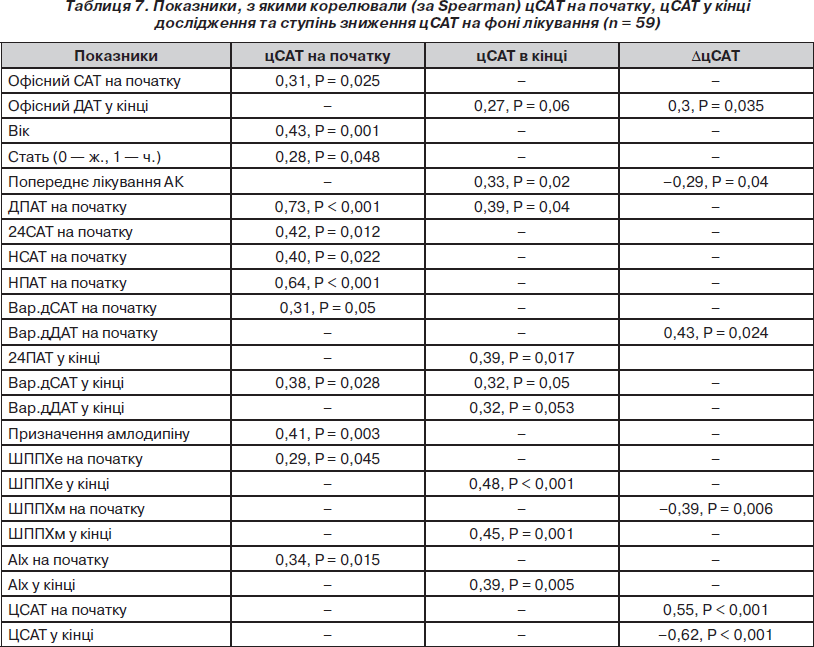
Фактори, що пов’язані із цСАТ. Для визначення факторів, що пов’язані із цСАТ та ступенем його зниження в загальній групі обстежених, нами проведено кореляційний аналіз за Spearman. Ці дані наведені у табл. 7. На початку дослідження цСАТ значною мірою достовірно корелював із рівнем дПАТ та нПАТ, що є логічним, адже саме ПАТ є показником, який пов’язаний із пружно-еластичними властивостями артерій. При цьому звертає на себе увагу те, що цСАТ корелював саме з ПАТ, який визначався при ДМАТ, а не офісному вимірюванні. Окрім ПАТ, цСАТ достовірно корелював із віком та рівнем 24САТ. Призначення амлодипіну в подальшому також асоціювалося із більшим цСАТ на початку. Імовірно, більш високий цСАТ потребує більших зусиль для його зниження. Меншою мірою, але також достовірно цСАТ корелював із рівнем офісного САТ, Вар.дСАТ, ШППХе та АІх. Окрім того, у жінок рівень цСАТ був меншим, ніж у чоловіків. Як указувалося вище, ШППХе більшою мірою характеризує саме еластичні властивості стінки артерій та залежить від тиску розтягування. Тому, з одного боку, більш високий цСАТ означає віщий тиск розтягування та, відповідно, більшу ШППХе, з іншого — більш висока ШППХе означає більш швидке повернення пульсової хвилі та, відповідно, ранню сумацію прямої та відбитої хвилі і збільшення цСАТ. Це підтверджується і тим, що цСАТ прямо корелював із АІх.
ЦСАТ у кінці дослідження більшою мірою корелював із показниками, що характеризують пружно-еластичні властивості артерій — із ШППХе, ШППХм та АІх у кінці дослідження. Окрім того, при більш високому 24ПАТ, більшій варіабельності як дСАТ, так і дДАТ також спостерігався більший рівень цСАТ. Прийом антагоністів кальцію до включення у дослідження асоціювався із більшим рівнем цСАТ у кінці дослідження, це частково пов’язане з тим, що АК частіше призначали більш тяжким пацієнтам, у яких були труднощі в досягненні цільового АТ. Ці труднощі, можливо, у свою чергу, пов’язані з більш вираженими змінами пружно-еластичних властивостей артерій.
Ступінь зниження цСАТ (DцСАТ) достовірно корелював із рівнем цСАТ на початку та в кінці дослідження. Окрім того, відмічався зв’язок із рівнем офісного ДАТ у кінці дослідження та Вар.дДАТ на початку: чим більшою була варіабельність дДАТ на початку та офісний ДАТ у кінці, тим більшим було зниження цСАТ. ШППХм спочатку зворотно корелювала із DцСАТ: чим більшою вона була, тим менше знижувався DцСАТ на фоні лікування.
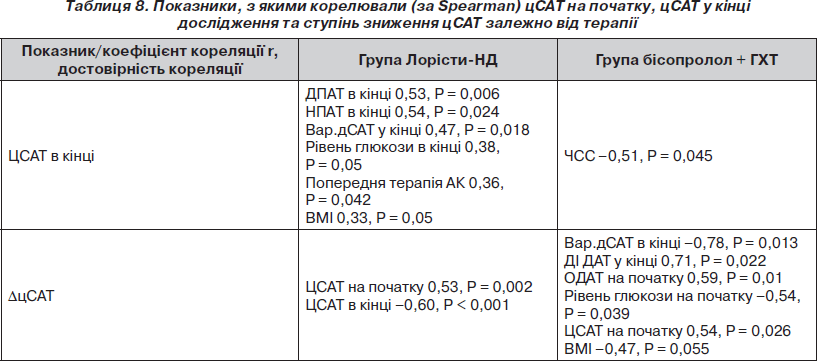
Ми також проаналізували, з чим були пов’язані зміни цСАТ залежно від призначеного лікування (табл. 8). Виявилося, що цСАТ у кінці дослідження у групі Лорісти HD корелював із рівнем дПАТ і нПАТ, Вар.дСАТ в кінці, індексом маси тіла, рівнем глюкози в кінці та попереднім прийомом АК. У той же час у групі бісопролол + ГХТ кінцевий цСАТ негативно корелював лише з ЧСС: чим більшою була ЧСС в кінці дослідження, тим меншим був цСАТ. DцСАТ у групі Лорісти HD був пов’язаний лише із рівнем цСАТ на початку та в кінці дослідження, у групі бісопролол + ГХТ — із Вар.дСАТ та ДІ ДАТ, офісним ДАТ, рівнем глюкози крові в кінці, цСАТ та індексом маси тіла на початку.
Таким чином, цСАТ пов’язаний із віком, статтю, рівнем АТ, а особливо САТ і ПАТ, які виміряні при ДМАТ, Вар.дСАТ та з показниками, що характеризують пружно-еластичні властивості артерій. У різних групах лікування спостерігалися різні фактори, що достовірно корелювали з кінцевим цСАТ та ступенем його зниження. У групі Лорісти HD кінцевий цСАТ був пов’язаний із рівнем кінцевих дПАТ та нПАТ, Вар.дСАТ, які достовірно зменшувалися на фоні лише даного лікування. У групі бісопролол + ГХТ кінцевий цСАТ достовірно був зворотно пов’язаний із досягнутою на фоні лікування ЧСС, яка більш виражено, особливо за даними ДМАТ, зменшувалася саме при даній терапії. Ступінь зниження цСАТ у групі Лорісти HD достовірно був пов’язаний із рівнем цСАТ на початку та в кінці лікування, а у групі бісопролол + ГХТ, окрім рівня цСАТ на початку, із Вар.дСАТ у кінці, який не змінювався достовірно, на відміну від групи Лорісти HD, із ДІ ДАТ та рівнем глюкози на початку. Індекс маси тіла та рівень глюкози прямо корелювали з рівнем досягнутого цСАТ у групі Лорісти HD та зворотно — зі ступенем зниження цСАТ у групі бісопролол + ГХТ, що свідчить про необхідність проведення модифікації способу життя для кращого контролю АТ.
Обговорення
Як показало наше дослідження, при однаковому зниженні АТ на плечовій артерії різні антигіпертензивні препарати забезпечують різне зниження цСАТ та зміни показників, що характеризують пружно-еластичні властивості артерій.
Як уже зазначалося, у дослідженні ASCOT також було показано, що лікування на основі амлодипіну забезпечувало однакове з атенололом зниження АТ на плечовій артерії, але достовірно менший рівень цСАТ (на 4 мм рт.ст.) та цПАТ. У цьому дослідженні виявлено, що рівень цСАТ на фоні лікування пов’язаний із ЧСС: чим меншою була ЧСС, тим більшим був цСАТ. Це і стало одним із пояснень, чому бета-адреноблокатори менше знижують цСАТ, адже вони більше зменшують ЧСС. Зменшення ЧСС, згідно з дослідженням ASCOT, на 10 уд. за 1 хв забезпечує підвищення цСАТ на 3 мм рт.ст. та АІх на 2,5 % [85]. Причинами цього є три основні фактори. По-перше, зменшення ЧСС призводить до подовження систоли і відбита пульсова хвиля повертається в систолу, підсумовується з прямою хвилею та збільшує цСАТ. По-друге, бета-блокатори можуть викликати периферичний вазоспазм і тим самим зміщати точку відбиття пульсової хвилі більш проксимально, сприяючи більш ранньому поверненню пульсової хвилі. Окрім того, підвищення резистивності судин збільшує амплітуду пульсової хвилі. По-третє, згідно з законом Пуазеля, АТ = серцевий викид х периферичний опір, де серцевий викид = ударний об’єм х ЧСС. Коли ЧСС знижується під випливом терапії, середній АТ підтримується за рахунок збільшення ударного об’єму. Цей феномен часто спостерігається у пацієнтів із повною атріовентрикулярною блокадою. У більш молодих пацієнтів з еластичними ємнісними судинами підвищення ударного об’єму не викликає суттєвого збільшення АТ, адже ємнісні судини здатні значно розтягуватися та, окрім того, периферичні судини дилатуються, зменшуючи опір та знижуючи АТ. У людей більш старшого віку та тих, хто страждає від АГ або атеросклерозу, зменшення ЧСС також призводить до збільшення ударного об’єму, але воно не компенсується розтягуванням ємнісних судин (через вікові та патологічні зміни у стінках), що призводить до збільшення цСАТ та ПАТ. Іншими словами, із цього витікає, що будь-який препарат, що зменшує ЧСС, може бути менш ефективним щодо зниження центрального АТ. Проте є дані, що бета-блокатори з вазодилатуючими властивостями більш ефективні щодо зниження цСАТ, ніж представники даної групи, але без таких властивостей [14, 15]. Окрім того, у дослідженні Y. Matsui зі співавторами під впливом лікування комбінацією олмесартан + азелнідипін спостерігалося більш виражене зниження цСАТ при більшому зниженні ЧСС порівняно з комбінацією олмесартан + ГХТ [48]. Автори пояснювали це більш вираженим позитивним впливом першої комбінації на периферичний опір та ШППХ. Тобто, можливо, існують додаткові позитивні ефекти антигіпертензивних препаратів (вплив на еластичні властивості ємнісних судин та функції ендотелію, зменшення периферичного вазоспазму), що нівелюють ефект зменшення ЧСС.
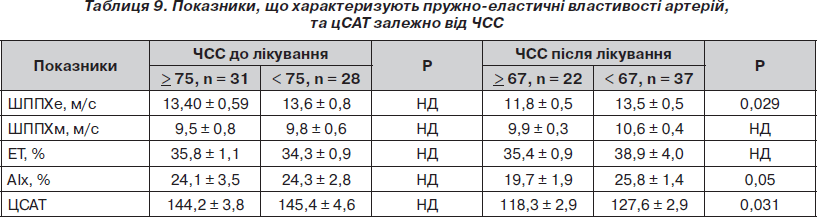
У нашому дослідженні ми спробували порівняти показники, що характеризують пружно-еластичні властивості артерій, та цСАТ до та в кінці лікування залежно від ЧСС. Ці дані наведені в табл. 9. Середній рівень ЧСС у загальній групі на початку дослідження становив 74,4 уд. за 1 хв. Відповідно, пацієнти були розподілені на дві підгрупи: з ЧСС < 75 та > 75 уд. за 1 хв. На початку дослідження не спостерігалося достовірної різниці між підгрупами за показниками, що вивчалися.
Середній рівень ЧСС в кінці дослідження становив 66,6 уд. за 1 хв. Відповідно пацієнти були розподілені на підгрупи: з ЧСС < 67 та > 67 уд. за 1 хв. Виявлено, що на фоні лікування менша ЧСС асоціювалася з більшою ШППХе, більшими АІх та цСАТ. Тобто на показники, що вивчалися на фоні лікування, впливала саме ЧСС на фоні лікування. У дослідженні ASCOT не проводили аналізу залежності центрального АТ від ЧСС до включення пацієнтів у дослідження, лише на фоні лікування. В інших дослідженнях ми також не знайшли подібного аналізу, хоча в оглядах вказується, що ЧСС має впливати на центральний АТ.
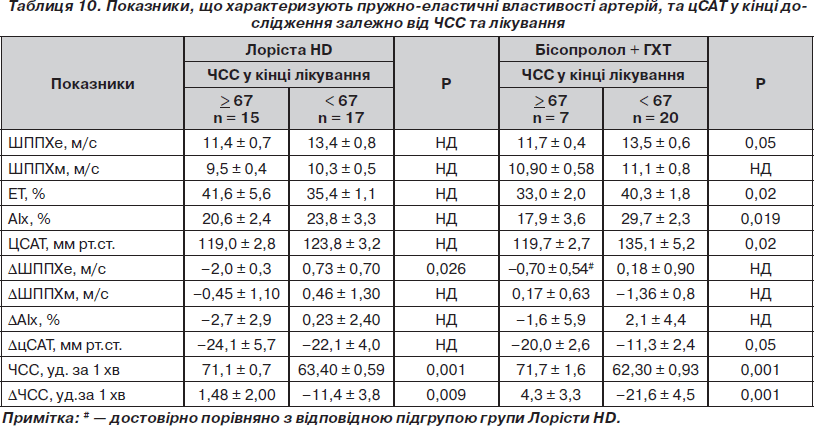
У дослідженні ASCOT при стандартизації за ЧСС не спостерігалося достовірної різниці в рівні цСАТ між групами лікування. У нашому дослідженні ми спробували оцінити показники, що вивчалися, залежно від терапії та ЧСС на фоні лікування (табл. 10). Виявилося, що у групі Лорісти HD не спостерігалося достовірної різниці між показниками залежно від досягнутої ЧСС, за винятком змін ШППХе: при меншій частоті ШППХе збільшувалася, а при більшій ЧСС зменшувалася в середньому на 2 м/с (Р = 0,026). У групі ж бісопролол + ГХТ спостерігалася достовірна різниця між підгрупами за ШППХе, EТ та АІх у кінці дослідження: у пацієнтів із ЧСС 67 уд. за 1 хв і більше ці показники були достовірно меншими. Звертало на себе увагу і те, що у групі Лорісти HD не було достовірної різниці за ступенем зниження та рівнем досягнутого цСАТ між підгрупами з різною ЧСС, а у групі бісопролол + ГХТ спостерігався достовірно більший цСАТ та менший ступінь зниження цСАТ у пацієнтів з більш низькою ЧСС на фоні терапії. Середні величини ЧСС на фоні терапії достовірно не відрізнялися між групами у відповідній підгрупі.
Загалом, якщо припустити, що зниження ЧСС на 10 уд. за 1 хв забезпечує підвищення цСАТ на 3 мм рт.ст., то виявляється, що в середньому за даними офісного вимірювання ЧСС у групі Лорісти HD знизилася на 5,9 ± 1,6 уд. за 1 хв, а у групі бісопролол + ГХТ — на 12,9 ± 3,9 уд. за 1 хв. Таким чином, різниця у зниженні ЧСС між групами становила 7 уд. за 1 хв, що мало забезпечити різницю, як згадано вище, у рівні досягнутого цСАТ трохи менше 3 мм рт.ст., а в нашому дослідженні вона становила 6,5 мм рт.ст. Окрім того, у нашому дослідженні цСАТ на фоні лікування не корелював зі ступенем зниження ЧСС, а лише з досягнутою на фоні лікування ЧСС, за якою групи ні за даними офісного вимірювання, ні за даними ДМАТ достовірно не відрізнялися. Це дає змогу припустити, що лікуванню на основі Лорісти HD на відміну від бісопролол + ГХТ притаманні властивості, які нівелюють вплив зниження ЧСС на цСАТ.
Як було показано вище, у групі бісопролол + ГХТ спостерігалося достовірне збільшення АІх на 4,7 %, що також могло бути спричинено зменшенням ЧСС. Згідно з даними дослідження I.B. Wilkinson зі співавторами, зменшення ЧСС на 10 уд. за 1 хв від 75 призводить до збільшення АІх на 3,9 % [84]. У нашому дослідженні ЧСС у групі бісопролол + ГХТ зменшилася до 62,2 уд. за 1 хв, тобто майже на 13 уд. за 1 хв від 75, що і могло забезпечити збільшення АІх на 4,7 %. Таким чином, наші дані відповідають даним літератури. У групі ж Лорісти HD ЧСС від 75 зменшилася на 8,1 уд. за 1 хв, але АІх не змінився. Це також підтверджує думку про позитивні властивості саме комбінації Лорісти HD, які нівелюють негативний вплив зниження ЧСС.
Таким чином, більш низька ЧСС на фоні лікування асоціювалася з вищим цСАТ та більшим додатковим навантаженням (АІх) лише у групі бісопролол + ГХТ. У групі Лорісти HD зменшення ЧСС призводило до деякого нівелювання позитивної дії даної комбінації на еластичні властивості артерій великого калібру (менший ступінь зменшення ШППХе), але не викликало достовірного збільшення цСАТ. Іншими словами, з огляду на результати нашого дослідження цСАТ залежить не тільки від ЧСС на фоні терапії, але й від того, яка терапія призначається. Лікуванню на основі комбінації Лорісти HD, вірогідно, були притаманні додаткові позитивні властивості, які сприяли більш вираженому зменшенню цСАТ, незважаючи на зменшення ЧСС.
Взагалі вивчення впливу блокаторів рецепторів ангіотензину ІІ (БРА) на пружно-еластичні властивості артерій почалося не так давно, хоча переваги даних препаратів у попередженні серцево-судинних ускладнень порівняно з іншими препаратами були відомі значно раніше з клінічних досліджень (LIFE, MOSES, RENAAL, IDNT). Логічно припустити, що препарат, який зменшує середній АТ та має вазодилатуючі властивості, а БРА є саме такими препаратами, може покращувати пружно-еластичні властивості. Проте в експериментах показано, що блокада рецепторів ангіотензину ІІ асоціюється із ремоделюванням малих та великих артерій, яке виникає через специфічні механізми — антизапальний ефект та зміни зв’язування a5b1-інтегрин із фібронектином [33]. Це призводить до зменшення жорсткості артерій незалежно від впливу на АТ. Так, у гіпертензивних щурів, які знаходилися на низькосольовій дієті, валсартан у низькій дозі зменшував цПАТ, але не середній АТ [39]. Згідно з даними досліджень G.M. London зі співавторами та Е. Agabiti-Rosei зі співавторами, блокада ангіотензину ІІ покращує або навіть нормалізує структуру малих резистивних судин та зменшує відбиття пульсової хвилі [4, 5, 41, 42]. У дослідженні Y. Matsue зі співавторами комбінація олмесартан + азелнідипін забезпечувала більш виражене зменшення ШППХе, що не залежало від ступеня зниження середнього АТ, ніж комбінація олмесартан + ГХТ [48]. А під час проведення дослідження EXPLOR показано, що комбінація валсартан + амлодипін при однаковому зниження АТ на плечовій артерії призводила до більш вираженого зменшення цСАТ та АІх, ніж комбінація атенолол + амлодипін [15]. Причому ця різниця зберігалася при стандартизації за ЧСС. Автори цього дослідження, як і дослідження Y. Matsue, пояснювали цю різницю при призначенні різного лікування перш за все різними змінами тонусу артерій: більша вазодилатація забезпечує більший позитивний вплив на пульсову хвилю. Певно, що бета-блокатор не впливає або забезпечує меншу дилатацію (при комбінації з АК), ніж БРА. Тому можна зробити висновок, що додавання АК у нашому дослідженні не нівелювало недостатній вплив бета-блокатора на центральний АТ та додаткове навантаження на серце за рахунок ранньої сумації прямої та відбитої пульсової хвилі.
Обмеження дослідження
Певне, що проведення даного дослідження мало деякі обмеження. По-перше, пацієнти до включення в дослідження вже приймали антигіпертензивні препарати. Тобто ми оцінювали на початку дослідження пружно-еластичні властивості артерій, які на той момент могли бути обумовлені не тільки захворюванням, але й тим, які ліки приймали до цього хворі. У подальшому при порівнянні саме впливу лікування цей фактор мав менше значення, адже групи достовірно не відрізнялися за попередньою терапією. По-друге, дослідження хоча і було рандомізованим, але не сліпим. Дослідники, у тому числі і ті, які проводили апланаційну тонометрію, знали, які препарати отримували пацієнти. Але автоматизація методу отримання та обробки інформації за допомогою апаратів ДМАТ та Sphygmocor дозволяє максимально виключити суб’єктивність нашого дослідження. По-третє, існували деякі певні методологічні обмеження, адже визначали параметри пульсової хвилі після її калібрування на основі даних вимірювання АТ на плечовій артерії, а відстань між точками на артеріях вимірювали сантиметровою стрічкою. Проте вимірювання АТ на плечовій артерії проводив один і той же дослідник за викладеною вище методикою однаково в кожній із груп лікування. По-четверте, окрім антигіпертензивної терапії пацієнти у нашому дослідженні отримували статини, які теоретично могли вплинути на еластичні властивості артерій та цСАТ, що могло позначитися на результатах у загальній групі. Проте групи достовірно не відрізнялися за часткою пацієнтів, яким призначали статини. Окрім того, у дослідженні ASCOT при тривалому спостереженні не було відмічено достовірної різниці за рівнем центрального АТ та показниками, що характеризували жорсткість артерій, між групами хворих, які отримували або не отримували аторвастатин [86]. По-п’яте, строк спостереження в нашому дослідженні становив лише 6 місяців, що було, можливо, мало для отримання достовірних змін пружно-еластичних властивостей артерій у даної категорії хворих. По-шосте, у даному дослідженні ми використовували хоча і високоселективний, але бета-блокатор без вазодилатуючих властивостей. Можливо, при застосуванні таких препаратів, як небіволол, карведилол, ми мали б інші результати. По-сьоме, це дослідження проводилося лише в одному центрі (відділення симптоматичних артеріальних гіпертензій ННЦ «Інститут кардіології імені академіка М.Д. Стражеска») — єдиному місці в Україні, де є сертифікований прилад Sphygmocor і де, як правило, концентруються пацієнти, які мають певні проблеми з ефективністю попереднього лікування, що накладає певні обмеження в генералізації отриманих даних.
Клінічне значення
У зв’язку з тим, що центральний АТ є незалежним предиктором виникнення кардіоваскулярних подій, cлід проводити оцінку можливостей антигіпертензивних препаратів знижувати саме цСАТ, навіть при однаковому зниженні АТ на плечовій артерії. Лікування пацієнтів із неускладненою помірною та тяжкою АГ на основі комбінації Лорісти HD при однаковому зниженні АТ на плечовій артерії за даними й офісного вимірювання, і ДМАТ забезпечувало більш виражене зниження цСАТ, ніж терапія на основі бісопрололу + ГХТ, що не залежало від зниження ЧСС. Додаткове призначення амлодипіну не призводить до нівелювання недостатнього впливу бета-блокатора на цСАТ. Подальші клінічні дослідження мають підтвердити, що центральний АТ та показники жорсткості артерій можуть бути більш важливими критеріями оцінки ефективності антигіпертензивної терапії, ніж АТ, виміряний на плечовій артерії.
Висновки
1. За даними і офісного вимірювання АТ, і ДМАТ комбіноване лікування на основі препарату Лоріста HD було таке ж ефективне, як і лікування на основі комбінації бісопролол + ГХТ: офісного цільового АТ було досягнуто у 96,9 та 92,6 % осіб та цільового середньодобового АТ у 75 та 66,7 % пацієнтів (Р = НД) на 6-му місяці відповідно у групах Лорісти HD та бісопролол + ГХТ. Але лише під впливом лікування на основі Лорісти HD спостерігалося достовірне зменшення дПАТ і варіабельності дСАТ, що при подальшому лікуванні може мати позитивне прогностичне значення.
2. Будь-яке ефективне за даними вимірювання АТ на плечовій артерії лікування АГ супроводжувалося достовірним зниженням цСАТ. При цьому при однаковому зниженні АТ на плечовій артерії лікування на базі препарату Лоріста HD забезпечувало достовірно більший ступінь зниження цСАТ (23,0 ± 2,3 мм рт.ст. проти 15,4 ± 2,9 мм рт.ст., Р < 0,05) та досягнення на 6,5 мм рт.ст. меншого рівня цСАТ, ніж терапія на базі комбінації бісопролол + ГХТ.
3. Центральний САТ пов’язаний із віком, статтю, рівнем АТ, а особливо САТ і ПАТ, які виміряні при ДМАТ, Вар.дСАТ та із показниками, що характеризують пружно-еластичні властивості артерій. У різних групах лікування спостерігалися різні фактори, що достовірно корелювали з кінцевим цСАТ та ступенем його зниження.У групі Лорісти HD кінцевий цСАТ був пов’язаний із рівнем кінцевих дПАТ та нПАТ, Вар.дСАТ, які достовірно зменшувалися на фоні лише даного лікування. У групі бісопролол + ГХТ кінцевий цСАТ достовірно був зворотно пов’язаний із досягнутою на фоні лікування ЧСС, яка більш виражено, особливо за даними ДМАТ, зменшувалася саме при даній терапії.
4. Ступінь зниження цСАТ у групі Лорісти HD достовірно був пов’язаний із рівнем цСАТ на початку та в кінці лікування, а у групі бісопролол + ГХТ, окрім рівня цСАТ на початку, із Вар.дСАТ у кінці, який не змінювався достовірно на відміну від групи Лорісти HD, із ДІ ДАТ та рівнем глюкози на початку. Індекс маси тіла та рівень глюкози прямо корелювали з рівнем досягнутого цСАТ у групі Лорісти HD та зворотно — із ступенем зниження цСАТ у групі бісопролол + ГХТ.
5. Лоріста HD достовірно не впливала на середні величини показників, що характеризують пружно-еластичні властивості артерій, тоді як комбінація бісопролол + ГХТ достовірно збільшувала АІх, що свідчить про збільшення частки саме додаткового компонента навантаження на серце при застосуванні комбінації бета-блокатор + діуретик. На фоні лікування комбінацією Лоріста HD ступінь зменшення ШППХe, ШППХм та АІх був достовірно більшим, ніж на фоні лікування комбінацією бісопролол + ГХТ.
6. Більш низька ЧСС на фоні лікування асоціювалася із вищим цСАТ та більшим додатковим навантаженням (АІх) лише у групі бісопролол + ГХТ. У групі Лорісти HD зменшення ЧСС призводило до деякого нівелювання позитивної дії даної комбінації на еластичні властивості артерій великого калібру (менше зниження ШППХе), але не викликало достовірного збільшення цСАТ.
1. Радченко Г.Д., Міхєєва К.В., Сіренко Ю.М., Кушнір С.М., Пономарьова Г.В. Ефективність лікування на основі препарату Лоріста HD — лозартан 100 мг + гідрохлортіазид 25 мг — порівняно з комбінацією бісопролол 10 мг + гідрохлортіазид 25 мг у пацієнтів з помірною та тяжкою артеріальною гіпертензією: дослідження ЕЛІЗА (результати 6-місячного спостереження) // Артеріальна гіпертензія. — 2010. — № 6. — С. 23-35.
2. Сіренко Ю.М. Артеріальна гіпертензія (посібник для лікарів). — К.: Морион, 2002. — 201 с.
3. 2007 European Society of Hypertension — European Society of Cardiology guidelines for management of arterial hypertension // J. Hypertension. — 2007. — Vol. 25. — P. 1105-1187.
4. Agabiti-Rosei E., Heagerty A.M., Rizzoni D. Effects of antihypertensive treatment on small artery remodeling // J. Hypertens. — 2009. — Vol. 27. — P. 1107-1114.
5. Agabiti-Rosei E., Porteri E., Rizzoni D. Arterial stiffness, hypertension, and rational use of nebivolol // Vascular Health and Risk Management. — 2009. — Vol. 5. — P. 353-360.
6. Alli C., Avanzini F., Bettelli G., Colombo F., Torri V., Tognoni G. The long-term prognostic significance of repeated blood pressure measurements in the elderly: SPAA (Studio sulla Pressione Arteriosa nell’Anziano) 10-year follow-up // Arch. Intern. Med. — 1999. — Vol. 159. — P. 1205-1212.
7. Antikainen R., Jousilahti P., Tuomilehto J. Systolic blood pressure, isolated systolic hypertension and risk of coronary heart disease, strokes, cardiovascular disease and all-cause mortality in the middle-aged population // J. Hypertens. — 1998. — Vol. 16. — P. 577-583.
8. Asmar R., Benetos A., Topouchian J. et al. Assessment of arterial distensibility by automatic pulse wave velocity measurement: validation and clinical application studies // Hypertension. — 1995. — Vol. 26. — P. 485-490.
9. Bangalore S., Wild D., Parkar S. et al. Beta-blockers for Primary Prevention of Heart Failure in Patients with Hypertension: Insights From a Meta-Analysis // Am. Coll Cardiol. — 2008. — Vol. 52. — P. 1062-1072.
10. Benetos A., Adamopoulos C., Bureau J.M. et al. Determinants of accelerated progression of arterial stiffness in normotensive subjects and in treated hypertensive subjects over a 6-year period // Circulation. — 2002. — Vol. 105. — P. 1202-1207.
11. Blacher J., Asmar R., Djane S., London G.M., Safar M.E. Aortic pulse wave velocity as a marker of cardiovascular risk in hypertensive patients // Hypertension. — 1999. — Vol. 33. — P. 1111-1117.
12. Blacher J., Guerin A.P., Pannier B. et al. Arterial calcifications, arterial stiffness, and cardiovascular risk in end-stage renal disease // Hypertension. — 2001. — Vol. 38. — P. 938-942.
13. Blacher J., Pannier B., Guerin A.P. et al. Carotid arterial stiffness as a predictor of cardiovascular and all-cause mortality in end-stage renal disease // Hypertension. — 1998. — Vol. 32. — P. 570-574.
14. Boutouyrie P., Tropeano A.I., Asmar R. et al. Aortic stiffness is an independent predictor of primary coronary events in hypertensive patients: a longitudinal study // Hypertension. — 2002. — Vol. 39. — P. 10-15.
15. Boutouyrie P., Achouba A., Trunet P. et al. for the EXPLOR Trialist Group. Amlodipine-Valsartan Combination Decreases Central Systolic Blood Pressure More Effectively Than the Amlodipine-Atenolol Combination The EXPLOR Study // Hypertension. — 2010. — Vol. 55. — P. 1314-1322.
16. Brion R., Carre F., Verdier J. et al. Comparative effects of bisoprolol and nitrendipine on exercise capacity in hypertensive patients with regular physical activity // J. Cardiovasc. Pharmacol. — 2000. — Vol. 35. — P. 78-83.
17. Cameron J.D., McGrath B.P., Dart A.M. Use of radial artery applanation tonometry and a generalized transfer function to determine aortic pressure augmentation in subjects with treated hypertension // J. Am. Coll. Cardiol. — 1998. — Vol. 32. — P. 1214-1220.
18. Cohn J. Is it the blood pressure or the blood vessel? // Journal of American Society of Hypertension. — 2007. — Vol. 1. — P. 5-16
19. Cruickshank J. Beta-blockers continue to surprise us // Eur. Heart J. — 2000. — Vol. 21. — P. 354-364.
20. Dahloёf B., Devereux R.B., Kjeldsen S.E., Julius S., Beevers G., de Faire U. et al. Cardiovascular morbidity and mortality in the Losartan Intervention for Endpoint reduction in hypertension study (LIFE): a randomized trial against atenolol // Lancet. — 2002. — Vol. 359. — P. 995-1003.
21. Dart A., Cameron J., Gatzka C. et al. Similar Effects of Treatment on Central and Brachial Blood Pressures in Older Hypertensive Subjects in the Second Australian National Blood Pressure Trial // Hypertension. — 2007. — Vol. 49. — P. 1242-1247.
22. Dart A., Gatzka C., Kingwell B. et al. Brachial Blood Pressure But Not Carotid Arterial Waveforms Predict Cardiovascular Events in Elderly Female Hypertensives // Hypertension. — 2006. — Vol. 47. — P. 785-790.
23. Davies J., Struthers A. Pulse wave analysis and pulse wave velocity: a critical review of their strenghs and weaknesses // J. Hypertens. — 2003. — Vol. 21. — P. 463-472.
24. Dhakam Z., McEniery C., Yasmin et al. Atenolol and Eprosartan: Differential Effects on Central Blood Pressure and Aortic Pulse Wave VelocityAtenolol and Eprosartan: Differential Effects on Central Blood Pressure and Aortic Pulse Wave Velocity (CAVI) // American Journal of Hypertension. — 2006. — Vol. 19. — P. 214-219.
25. Everly M., Heaton P., Cluxton R. b-Blocker Underuse in Secondary Prevention of Myocardial Infarction // Annals Pharmacotherapy. — 2004. — Vol. 38. — P. 286-293.
26. Franklin S.S., Khan S.A., Wong N.D., Larson M.G., Levy D. Is pulse pressure useful in predicting risk for coronary heart disease? The Framingham heart study // Circulation. — 1999. — Vol. 100. — P. 354-360.
27. Franklin S.S. Blood pressure and cardiovascular disease: what remains to be achieved? // J. Hypertens. — 2001. — Vol. 19, Suppl. 3. — P. S3-S8.
28. Gуmez-Marcos M., Recio-Rodrнguez J., Rodrнguez-Sбnchez E. et al. Central blood pressure and pulse wave velocity: relationship to target organ damage and cardiovascular morbidity-mortality in diabetic patients or metabolic syndrome. An observational prospective study. LOD-DIABETES study protocol // BMC Public Health. — 2010. — Vol. 10. — P. 143.
29. Greenwald S. Pulse pressure and arterial elasticity // Q. J. Med. — 2002. — Vol. 95. — P. 107-112.
30. Guido Grass G.I., Quarti-Trevano F., Mancia G. Cardioprotective effects of telmisartan in uncomplicated and complicated hypertension // Journal of Renin-Angiotensin-Aldosterone System. — 2008. — Vol. 9. — P. 66-74.
31. Hirata K., Vlachopoulos C., Adji A., O’Rourke M.F. Benefits from angiotensin-converting enzyme inhibitor «beyond blood pressure lowering»: beyond blood pressure or beyond the brachial artery? [published correction appears in J. Hypertens. — 2005. — 23. — 903-904] // J. Hypertens. — 2005. — Vol. 23. — P. 551-556.
32. Ichihara A., Hayashi M., Kaneshiro Y. et al. Low doses of losartan and trandolapril improve arterial stiffness in hemodialysis patients // Am. J. Kidney Dis. — 2005. — Vol. 45. — P. 866-874.
33. Kakou A., Bйzie Y., Mercier N. et al. Selective reduction of central pulse pressure under angio-tensin blockage in SHR: role of the fibronectin-a5b1 integrin complex // Am. J. Hypertens. — 2009. — Vol. 22. — P. 711-717.
34. Kannel W., Gordon T., Schwartz M. Systolic versus diastolic blood pressure and risk of coronary heart disease: the Framingham study // Am. J. Cardiol. — 1971. — Vol. 27. — P. 335-346.
35. Karamanoglu M., O’Rourke M.F., Avolio A.P., Kelly R.P. An analysis of the relationship between central aortic and peripheral upper limb pressure waves in man // Eur. Heart J. — 1993. — Vol. 14. — P. 160-167.
36. Kario. Early morning risk management in hypertension. — London: Science press, 2004. — 68 p.
37. Kingwell B.A., Waddell T.K., Medley T.L., Cameron J.D., Dart A.M. Large artery stiffness predicts ischemic threshold in patients with coronary artery disease // J. Am. Coll. Cardiol. — 2002. — Vol. 40. — P. 773-779.
38. Kullo I., Bielak L., Turner S., Sheedy P. II, Peyser P. Aortic Pulse Wave Velocity Is Associated With the Presence and Quantity of Coronary Artery Calcium A Community-Based Study // Hypertension. — 2006. — Vol. 47. — P. 174-179.
39. Labat C., Lacolley P., Lajemi M. et al. Effects of valsartan on mechanical properties of the carotid artery in spontaneously hypertensive rats under high-salt diet // Hypertension. — 2001. — Vol. 38. — P. 439-443.
40. Laurent S., Boutouyrie P., Asmar R. et al. Aortic stiffness is an independent predictor of all-cause and cardiovascular mortality in hypertensive patients // Hypertension. — 2001. — Vol. 37. — P. 1236-1241.
41. London G. Central blood pressure reduction: a key to organ protection // Medicographia. — 2005. — Vol. 27. — P. 144-147.
42. London G.M., Asmar R.G., O’Rourke M.F., Safar M.E., REASON Project Investigators. Mechanism(s) of selective systolic blood pressure reduction after a low-dose combination of perindopril/indapamide in hypertensive subjects: comparison with atenolol // J. Am. Coll. Cardiol. — 2004. — Vol. 43. — P. 92-99.
43. Mackenzie I., McEniery C., Dhakam Z. et al. Comparison of the Effects of Antihypertensive Agents on Central Blood Pressure and Arterial Stiffness in Isolated Systolic Hypertension // Hypertension. — 2009. — Vol. 54. — P. 409-413.
44. Mackenzie I., Wilkinson I., Cockcroft J. Assessment of arterial stiffness in clinical practice // Q. J. Med. — 2002. — Vol. 95. — Р. 67-74.
45. Mahmud A., Feely J. Antihypertensive drugs and arterial stiffness // Expert Rev.Cardiovas. Ther. — 2003. — Vol. 1. — P. 65-78.
46. Mancia G. Prevention of risk factors: beta-blockade and hypertension // Eur. Heart J. — 2009. — Vol. 11. — P. A3-A8.
47. Manisty C., Zambanini A., Parker K. et al. on behalf of the Anglo-Scandinavian Cardiac Jutcome Trial Investigators. Differences in the Magnitude of Wave Reflection Account for Differential Effects of Amlodipine — Versus Atenolol-Based Regimens on Central Blood Pressure An Anglo-Scandinavian Cardiac Outcome Trial Substudy // Hypertension. — 2009. — Vol. 54. — P. 724-730.
48. Matsui Y., Eguchi K., O’Rourke M. et al. Differential Effects Between a Calcium Channel Blocker and a Diuretic When Used in Combination With Angiotensin II Receptor Blocker on Central Aortic Pressure in Hypertensive Patients // Hypertension. — 2009. — Vol. 54. — P. 716-723.
49. McEniery C., McDonnell Y., Munnery M. et al. on Behalf of the Anglo-Cardiff Collaborative Trial Investigators Central Pressure: Variability and Impact of Cardiovascular Risk Factors The Anglo-Cardiff Collaborative Trial II // Hypertension. — 2008. — Vol. 51. — P. 1476-1482.
50. McEniery C., Yasmin, Hall I. et al. on behalf of the ACCT Investigators Normal Vascular Aging: Differential Effects on Wave Reflection and Aortic Pulse Wave Velocity The Anglo-Cardiff Collaborative Trial (ACCT) // J. Am. Coll. Cardiol. — 2005. — Vol. 46. — P. 1753-1760.
51. McVeigh G.E., Bratteli C.W., Morgan D.J. et al. Age-related abnormalities in arterial compliance identified by pressure pulse contour analysis: aging and arterial compliance // Hypertension. — 1999. — Vol. 33. — P. 1392-1398.
52. Morgan T., Lauri J., Bertram D., Anderson A. Effect of different antihypertensive drug classes on central aortic pressure // Am. J. Hypertens. — 2004. — Vol. 17. — P. 118-123.
53. Munir S., Guilcher A., Kamalesh T. et al. Peripheral Augmentation Index Defines the Relationship Between Central and Peripheral Pulse Pressure // Hypertension. — 2008. — Vol. 51. — P. 112-118.
54. Nakamura M., Sato K., Nagano M. Estimation of aortic systolic blood pressure in community-based screening: the relationship between clinical characteristics and peripheral to central blood pressure differences // J. Hum. Hypertens. — 2005. — Vol. 19. — P. 251-253.
55. Nelson M., Stepanek J., Cevette M. et al. Noninvasive Measurement of Central Vascular Pressures With Arterial Tonometry: Clinical Revival of the Pulse Pressure Waveform? // Mayo Clin. Proc. — 2010. — Vol. 85. — P. 460-472.
56. Nichols W., O’Rourke M., McDonald’s Blood Flow in Arteries: theoretical, experimental and clinical principles. — London, United Kingdom: Hodder Arnold, 2005. — P. 166-267
57. Nielsen W.B., Vestbo J., Jensen G.B. Isolated systolic hypertension as a major risk factor for stroke and myocardial infarction and an unexploited source of cardiovascular prevention: a prospective population-based study // J. Hum. Hypertens. — 1995 — Vol. 9 — P. 175-180.
58. O’Rourke Seward J. Central Arterial Pressure and Arterial Pressure Pulse: New Views Entering the Second Century After Korotkov // Mayo Clin. Proc. — 2006. — Vol. 81. — P. 1057-1068.
59. Panjrath G., Messerli F. b-blockers for primary prevention in hypertension: era bygone? // Prog. Cardiovasc. Dis. — 2006. — Vol. 49. — P. 76-87.
60. Pini R., Cavallini M., Palmieri V. et al. Central But Not Brachial Blood Pressure Predicts Cardiovascular Events in an Unselected Geriatric Population The ICARe Dicomano Study // J. Am. Coll. Cardiol. — 2008. — Vol. 51. — P. 2432-2439.
61. Protogerou А., Blacher J., Stergiou G. et al. Blood Pressure Response Under Chronic Antihypertensive Drug Therapy:rax in Regression of Arterial The Role of Aortic Stiffness in the REASON (Preterax in Regression of Arterial Stiffness in a Controlled Double-Blind) Study // J. Am. Coll Cardiol. — 2009. — Vol. 53. — P. 445-451.
62. Rehman A., Ismail S., Naing L. et al. Reduction in arterial stiffness with angiotensin II antagonism and converting enzyme inhibition. A comparative study among malay hypertensive subjects with a known genetic profile // Am. J. Hypertens. — 2007. — Vol. 20. — P. 184-189.
63. Resnick L.M., Militianu D., Cunnings A.J. et al. Pulse waveform analysis of arterial compliance: relation to other techniques, age, and metabolic variables // Am. J. Hypertens. — 2000. — Vol. 13. — P. 1243-1249.
64. Roman M., Devereux R., Kizer J. et al. High Central Pulse Pressure Is Independently Associated With Adverse Cardiovascular Outcome The Strong Heart Study // J. Am. Coll Cardiol. — 2009. — Vol. 54. — P. 1730-1734.
65. Roman M., Devereux R., Kizer J. et al. Central Pressure More Strongly Relates to Vascular Disease and Outcome Than Does Brachial Pressure The Strong Heart Study // Hypertension. — 2007. — Vol. 50. — P. 197-203.
66. Safar M. Macro- and Microcirculation in Hypertension. — London: Lippincott Williams & Wilkins, 2005. — 151 p.
67. Safar M., Protogerou A., Blacher J. Central Blood Pressure Under Angiotensin and Calcium Channel Blockade // Hypertension. — 2009. — Vol. 54. — P. 704-706.
68. Safar M., Levy B., Struijker-Boudier H. Current perspectives on arterial stiffness and pulse pressure in hypertension and cardiovascular disease // Circulation. — 2003. — Vol. 107. — P. 2864-2869.
69. Safar M.E., Blacher J., Pannier B. et al. Central pulse pressure and mortality in end-stage renal Disease // Hypertension. — 2002. — Vol. 39. — P. 735-738.
70. Sharman J.E., Stowasser M., Fassett R.G., Marwick T.H., Franklin S.S. Central blood pressure measurement may improve risk stratification // J. Hum. Hypertens. — 2008. — Vol. 22. — P. 838-844.
71. Stamler J., Stamler R., Neaton J. Blood pressure, systolic and diastolic and cardiovascular risk: US population data // Arch. Int. Med. — 1993. — Vol. 153. — P. 598-615.
72. Sutton-Tyrrell K., Mackey R.H., Holubkov R. et. al. Measurement variation of aortic pulse wave velocity in the elderly // Am. J. Hypertens. — 2001. –Vol. 14. — P. 463-468.
73. Task Force Members, Lopez-Sendon J., Swedberg K., McMurray J. et al. Expert consensus document on b-adrenergic receptor blockers // Eur. Heart J. — 2004. — Vol. 25. — P. 1341-1362.
74. The CAFE Investigators, for the Anglo-Scandinavian Cardiac Outcomes Trial (ASCOT) Investigators CAFE Steering Committee and Writing Committee. Differential Impact of Blood Pressure-Lowering Drugs on Central Aortic Pressure and Clinical Outcomes Principal Results of the Conduit Artery Function Evaluation (CAFE) Study // Circulation. — 2006. — Vol. 113. — P. 1213-1225.
75. The Task force members. Guidelines in diabetes, prediabetes and cardiovascular disease: full text // Eur. Heart J. — doi:10.1093/eurheartj/ehl261.
76. Tsang T.S., Verzosa G.C., Barnes M.E. et al. Abstract 3163: central pulse pressure as a robust predictor of first atrial fibrillation: Study Of Atrial Fibrillation In High Risk Elderly (SAFFIHRE) // Circulation. — 2008. — Vol. 118. — P. 1106.
77. Uehara G., Takeda H. Relative effects of telmisartan, candesartan and losartan on alleviating arterial stiffness in patients with hypertension complicated by diabetes mellitus: an evaluation using the cardio-ankle vascular index // J. Int. Med. Res. — 2008. — Vol. 36. — P. 1094-1102.
78. Vlachopoulos C., Alexopoulos N., Panagiotakos D. et al. Cigar smoking has an acute determental effect on arterial stiffness // Am. J. Hypertens. — 2004. — Vol. 17. — P. 299-303.
79. Vlachpoulos C., Hirata K., O’Rourke M. Pressure altering agents affect central aortic pressure more than is apparent from upper limb measurements in hypertensive patients. The role of arterial wave reflections // Hypertens. — 2001. — Vol. 38. — P. 1456-1460.
80. Wang B., Song W., Liu G. et al. The effect long-term administration of a selective beta1 blocker bisoprolol on glucose metabolism in patients with essential hypertensive and type 2 diabetes mellitus // Zhonghua Nei Ke Za Zhi. — 2005. — Vol. 44. — P. 503-505.
81. White W. Blood pressure monitoring in Cardiovascular Medicine and Therapeutics. — N. Jersy: Humana Press, 2001. — 308 p.
82. Wilkinson I., Franklin S., Hall I. et al. Pressure Amplification Explains Why Pulse Pressure is unrelated to risk in young subjects // Hypertens. — 2001. — Vol. 38. — P. 1461-1466.
83. Wilkinson I., Ian R., Hall I., MacCallum H. et al. Pulse-Wave Analysis Clinical Evaluation of a Noninvasive, Widely Applicable Method for Assessing Endothelial Function // Arterioscler. Thromb. Vasc. Biol. — 2002. — Vol. 22. — P. 147-152.
84. Wilkinson I.B., MacCallum H., Flint L. et al. The influence of heart rate on augmentation index and central arterial pressure in humans // J. Physiol. — 2000. — Vol. 525. — P. 263-270.
85. Williams B., Lacy P. for the CAFE and the ASCOT (Anglo-Scandinavian Cardiac Outcomes Trial) Investigators Impact of Heart Rate on Central Aortic Pressures and Hemodynamics Analysis From the CAFE (Conduit ArteryFunction Evaluation) Study: CAFE-Heart Rate // J. Am. Coll. Cardiol. — 2009. — Vol. 54. — P. 705-713.
86. Williams B., Lacy P., Cruickshank J. et al. Impact of Statin Therapy on Central Aortic Pressures and Hemodynamics Principal Results of the Conduit Artery Function Evaluation-Lipid-Lowering Arm (CAFE-LLA) Study // Circulation. — 2009. — Vol. 119 . — P. 53-61.