Международный неврологический журнал 2 (40) 2011
Вернуться к номеру
Катамнестические результаты применения препарата ботулотоксина типа А у больных детским церебральным параличом с формой спастическая диплегия в течение десятилетнего периода наблюдения
Авторы: Власенко С.В., Евпаторийский центральный детский клинический санаторий Министерства обороны Украины, Кушнир Г.М., Крымский государственный медицинский университет им. С.И. Георгиевского
Рубрики: Неврология
Версия для печати
В условиях Евпаторийского центрального детского клинического санатория Министерства обороны Украины препарат ботулотоксина типа А применялся на протяжении 10 лет. Проведен анализ эффективности использования препарата у 653 больных детским церебральным параличом с формой спастическая диплегия. Разработана оригинальная методика введения препарата в зависимости от преобладающего влияния патологических тонических рефлексов у детей раннего возраста и ведущего патологического синдрома спастичности отдельной мышечной группы у детей старшего возраста. Доказано, что постоянное применение препарата ботулотоксина типа А позволяет эффективно снизить мышечную спастичность, повысить эффективность консервативной реабилитации данной категории больных, уменьшить риск возникновения ортопедических осложнений, отсрочить проведение операций или вообще их не допустить.
Детский церебральный паралич, реабилитация, токсин ботулизма.

 Введение
Введение
Увеличение показателей детской инвалидности отмечается во всем мире. С 2000 года количество детей-инвалидов возросло в два раза. В Украине в 2008 году зарегистрировано 166 213 детей-инвалидов, среди которых патология нервной системы составляет 19,2 %, большая часть из них — больные детским церебральным параличом (ДЦП) (17 847 детей), в возрасте от 0 до 18 лет [22], что представляет собой значительную социальную проблему. Восстановительное лечение данной категории пациентов продолжается в течение десятилетий, итоговым результатом которого должна быть социальная адаптация человека, подразумевающая владение определенными профессиональными навыками, полное самообслуживание и др. [2, 3]. Выполнение вышеперечисленных функций невозможно без достаточного развития всех двигательных систем организма, реабилитация которых имеет свои специфические особенности в детском возрасте. Развитие ребенка должно осуществляться согласно его возрастным периодам, при этом у больных ДЦП одновременно необходимо нивелировать патологическую неврологическую симптоматику. Формирование физиологического двигательного акта у больного ДЦП осложняется несколькими патологическими факторами: отсутствием сформированных установочных, вертикализующих рефлексов, активностью нередуцированных патологических тонических рефлексов, спастичностью определенных мышечных групп на фоне слабости их антагонистов. Совокупность вышеперечисленных синдромов формирует уникальную картину патологии движения, постоянно изменяющуюся с ростом ребенка и под влиянием различных методов лечения. Клинически это проявляется усилением тонуса определенных групп мышц, нарастанием выраженности контрактур, ограничением двигательной активности ребенка. В более позднем возрастном периоде этому способствуют изменения, наступающие в мышцах, особенно в спастичных: фиброзное их перерождение, укорочение и отставание в росте [4, 8, 10, 11, 13, 19, 25, 26, 28, 31, 34, 39, 40]. Поэтому в реабилитации данной категории больных невозможно формировать единые шаблоны. Подбор необходимых лечебных мероприятий должен осуществляться после оценки настоящего статуса, анализа эффективности проведенных ранее терапевтических схем.
Однако существуют общие принципы терапии определенных патологических симптомокомплексов, единые во все возрастные периоды. К таковым относится лечение спастичности. Патогенез развития данного состояния у больных ДЦП является сложным и многогранным в зависимости от того, какие и на каком из уровней (корковом, подкорковом, стволовом, спинномозговом) пути повреждены. Общим мнением является то, что у больных ДЦП на сегментарно-периферический аппарат оказывают патологическое влияние практически все нисходящие системы мозга (пирамидная, мозжечковая и стриопаллидарная), обусловливающие возникновение тонических реакций, препятствующих реализации движения или в значительной степени деформирующих его [4, 8, 19, 28]. В ситуации, когда преобладает тонус в одной группе мышц, их антагонисты всегда ослаблены. Формируются порочные положения конечностей, которые усугубляют влияние патологических тонических рефлексов. Даже после того, как сформированы установочные вертикализирующие рефлексы и ребенок может самостоятельно передвигаться, патологические тонические рефлексы раннего детского возраста трансформируются в различные патологические двигательные синергии, синдромы (аддукторный, ректус, гамстринг, трицепс), обусловленные спастичностью какой-либо из мышечных групп [7, 23, 25, 27, 30]. Следует также помнить о развивающихся со временем тяжелых ортопедических осложнениях (контрактуры, деформации конечностей, сколиоз), требующих совершенно других подходов к лечению (операций). Остается открытым до настоящего времени вопрос о морфологической сохранности мышечной структуры у больных ДЦП. Проведенные многочисленные исследования, в том числе и у больных, перенесших инсульт, показывают возможность перерождения мышц с течением времени. На этом фоне говорить о какой-либо консервативной реабилитации не приходится [4, 8, 10, 34].
Таким образом, проблема снижения спастичности, формирования движений, сохранения мышечной структуры является одной из ведущих в терапии данного заболевания на протяжении десятилетий жизни ребенка. Возможное начало восстановления и развития физиологических локомоций у детей должно происходить с изменения потока восходящих импульсов с «периферии», «обучения» мышечного аппарата преодолевать патологическое влияние всех нисходящих структур. Для этого необходимо создать ситуацию равнозначного тонуса и силы антагонистов, после которой можно начинать «обучение» мышц.
Разработанный и впервые примененный в 1981 году американскими учеными препарат токсина ботулизма типа А широко используется во всем мире ведущими центрами реабилитации. Механизм действия ботулотоксина заключается в блокаде выделения ацетилхолина из везикул пресинаптических терминалей периферического мотонейрона, что приводит к химической денервации и прерывает поток патологической импульсации к мышце на период от 4 до 6 месяцев, после чего явления спастики рецидивируют и требуется повторение инъекции. Это связано с тем, что в зоне упомянутой выше трансмиттерной блокады прорастают новые терминали периферического мотонейрона, ацетилхолин начинает вновь поступать в синаптическую щель, импульсация восстанавливается и степень мышечной спастичности возвращается практически к исходной. Однако по сравнению со всеми применявшимися до ботулинистического токсина миорелаксирующими средствами последний обладает максимально пролонгированным действием, и это его отличительное качество успешно используется реабилитологами для выработки новых двигательных навыков и умений у больных с ДЦП [1, 3, 5, 6, 14–16, 20, 21, 24, 29, 33, 35–38, 41].
Метод лечения ДЦП локальными инъекциями препарата ботулотоксина типа А обладает значительными преимуществами перед другими: препарат не оказывает генерализованного миорелаксирующего действия, не приводит к необратимому перерождению мышц; позволяет воздействовать на отдельные мышцы или различные группы мышц в зависимости от степени их участия в патологической синергии; возможен индивидуальный подбор дозировки в зависимости от объема мышц, возраста ребенка; может применяться в любом возрасте; сочетается с любыми другими методами лечения; отсутствуют побочные эффекты.
Цель исследования — анализ эффективности применения препарата ботулотоксина типа А в лечении больных ДЦП в условиях хирургического отделения Центрального детского клинического санатория Министерства обороны Украины г. Евпатории.
Материал и методы
Под нашим наблюдением находилось 653 ребенка, больных ДЦП с формой спастическая диплегия, дети в возрасте от 2 до 10 лет — 382 человека, старше 10 лет — 271 больной. Всем больным проводились инъекции препарата ботулотоксина типа А. Больные проходили различные курсы реабилитации в условиях санатория. Без применения этапного гипсования курс лечения составлял не менее 24 дней. С использованием различных нейроортопедических методик — не менее 60 суток. Изучались выполняемые ранее реабилитационные мероприятия с оценкой их эффективности. Всем больным проводилось комплексное клиническое исследование с изучением влияния на позу ребенка патологических тонических рефлексов, развитость установочных. В возрастные периоды после 10 лет — преимущественное влияние на позу того или иного синдрома мышечной спастичности. В клиническом статусе выявлялись следующие синдромы на момент осмотра и их динамика по данным выписных эпикризов: ограничение объема движений в суставах разделялось на пять степеней (первая — 100% объем активных и пассивных движений, вторая — ограничение объема движений от 0 до 25 %, третья — ограничение объема движений от 26 до 50 %, четвертая — ограничение объема движений от 51 до 75 %, пятая — ограничение объема движений на 100 %); двигательная активность оценивалась по критериям классификации больших моторных функций (Gross Motor Function Classification System for Cerebral Palsy (GMFCS)) [12,18]; степень спастичности мышц оценивалась по шкале Эшуорта; степень выраженности пареза — по пятибалльной шкале.
Группа сравнения не отличалась от основной группы по степени двигательных нарушений, ее составили 147 детей, больных ДЦП с формой спастическая диплегия, которым не применялся препарат ботулотоксина типа А.
Результаты и их обсуждение
Санаторно-курортное лечение больных ДЦП с использованием преформированных природных факторов в сочетании с различными нейроортопедическими видами лечения является классическим этапом реабилитации данной категории пациентов с научно доказанной эффективностью. Применение препарата ботулотоксина типа А в условиях Евпаторийского детского клинического санатория было начато с 2000 года. В нашей клинике мы применяем препарат ботулотоксина типа А на любом возрастном этапе развития ребенка (с двух лет), сочетаем инъекции препарата со всеми видами санаторно-курортного лечения, с этапным гипсованием, а также и после проведенного хирургического лечения. Разработаны дифференцированные подходы к локальному снижению мышечной спастичности в зависимости от возрастных этапов формирования физиологических локомоций и преимущественного влияния отдельных мышц на патологию движения.
Все мышцы конечностей, включаясь в ту или иную физиологическую синергию, обладают способностью при своем сокращении производить движения по двум-трем осям, участвуя в функции одного или двух суставов. Эти же мышцы, вовлеченные в сложную цепь патологических синергий, под влиянием примитивных тонических рефлексов, нарушения процесса антигравитации теряют часть своих функций, что приводит к определенным изменениям движений, создавая своеобразную патологическую картину. При этом мышцы со сложной функцией могут действовать в каком-то одном направлении или выполнять лишь часть присущей им функции. Другая же функция, может быть, даже основная, у больных детей оказывается ослабленной или выпадает полностью.
У детей до 10 лет остаются выраженными патологические позотонические реакции, имеющие характерную клиническую картину (патологический симметричный шейно-тонический и лабиринтный рефлексы). Поэтому снижение мышечной спастичности ботулотоксином должно учитывать преимущественное влияние того или иного рефлекса на ее распределение по группам мышц.
I. При максимальной выраженности шейного симметричного тонического рефлекса доза препарата распределяется с учетом наиболее вовлеченных в патологическую синергию мышц: большие грудные мышцы, приводящие мышцы бедер и икроножные. У больных с преобладающей активностью шейного симметричного тонического рефлекса формируется разгибательная синергия нижних конечностей. Основные мышцы — разгибатели, двусуставные мышцы стимулируются рефлекторно, благодаря чему осуществляется разгибание коленных суставов. Важным и существенным при этой синергии является формирование эквинусных установок стоп и возможные разнообразные сочетания двигательных нарушений в тазобедренных суставах. Превалирующая активность шейного симметричного тонического рефлекса рефлекторно усиливает при сгибании головы тонус всех разгибателей нижних конечностей, а также трехглавых мышц голеней, в основном как подошвенных сгибателей стоп, формируя их эквинусные положения.
II. При преобладающем влиянии лабиринтного тонического рефлекса препарат распределяется между приводящими мышцами бедер и сгибателями голени. Преобладание лабиринтного тонического рефлекса вызывает развитие сгибательной синергии нижних конечностей. Особенностью этой патологии является снижение тонуса и функциональной активности основных односуставных разгибателей нижних конечностей (больших ягодичных, трех головок четырехглавых мышц и камбаловидных). Перечисленные мышцы не получают достаточно как рефлекторной, так и произвольной стимуляции. Двусуставные мышцы, включаясь в сгибательную синергию, нарушают в той или иной степени разгибательную и стабилизирующую функцию суставов. При превалирующем влиянии лабиринтного тонического рефлекса трехглавая мышца голени включается в сгибательную синергию нижней конечности, принимает участие в формировании сгибательных контрактур в коленных суставах и эквинусной деформации стоп. Особенностью сгибательной синергии является формирование синдрома сгибания конечности в тазобедренном и коленном суставах. Ведущей контрактурой в данной синергии является сгибательная в коленных суставах. В данном случае в процессе лечения необходимо подавлять активность лабиринтного тонического рефлекса и создать все условия для проявления более благоприятной для восстановления разгибательной синергии. С этой целью рекомендуется ходить в замковых аппаратах на разогнутых в коленных суставах ногах и слегка эквинусных установках стоп (к аппаратам крепятся ортопедические ботинки с ограничением тыльного сгибания стоп до 90–95°). Небольшое эквинусное положение стоп во время ходьбы способствует пассивному замыканию коленных суставов, если предварительно полностью устранены контрактуры. Распределение препарата по мышечным группам в зависимости от преобладающего влияния патологических позотонических рефлексов представлено в табл. 1.
Структуры центральной нервной системы у больных ДЦП созревают с задержкой. Со временем формируются установочные рефлексы, ребенок начинает с помощью приспособлений стоять, ходить, тем самым преодолевая глобальное влияние тонических рефлексов. Однако, несмотря на положительную динамику, остаточное влияние тонических рефлексов сохраняется. На их основе происходит формирование локальных патологических нейроортопедических синдромов ограничений движений в сегментах конечностей, связанных с ведущей спастичностью определенной группы мышц: аддукторного синдрома, ректус-синдрома, гамстринг-синдрома, трицепс-синдрома.
Аддукторный синдром обусловлен спастичностью односуставных мышц — группы приводящих мышц бедра, и подвздошно-поясничной, двухсуставной мышцы — нежной мышцы бедра. При этом синдроме ребенок стоит и ходит с приведенными бедрами до плотного соприкосновения их или перекреста на уровне средней и нижней трети бедер, коленных суставов и голеней. Самостоятельное нахождение в вертикальной позе и передвижение сильно затруднены. Дифференциальная диагностика проводится с парезом ягодичных мышц, нестабильностью и вывихом в тазобедренном суставе.
Ректус-синдром. Прямая мышца бедра является двухсуставной в составе четырехглавой мышцы бедра и выполняет функции разгибания голени и сгибания бедра. При данном синдроме отмечается патологический комплекс в виде наклона таза вперед, компенсаторного гиперлордоза в поясничном отделе позвоночника и вторичной флексии или экстензии в коленных суставах. Дифференциальная диагностика проводится со сгибательной контрактурой тазобедренного сустава иного генеза, участие в которой помимо прямой мышцы бедра принимают подвздошно-поясничная мышца, а также мышцы, натягивающие широкую фасцию бедра, портняжная, гребешковая, длинная, малая и короткая, приводящие бедро.
Гамстринг-синдром обусловлен патологическим тонусом внутренней группы двусуставных мышц сгибателей голени: нежной, полусухожильной и полуперепончатой. При данном синдроме характерно положение больного с согнутыми в коленных суставах ногах и внутренней ротацией бедер. Дифференциальная диагностика проводится с посттравматической десмогенной или костной сгибательной контрактурой коленного сустава.
Трицепс-синдром — синдром двигательных нарушений, обусловленный спастичностью трехглавой мышцы голени. Клинически характеризуется эквинусом стопы в положении стоя. Эквинус стопы, степень которого не изменяется от сгибания коленного сустава, обусловлен спастичностью всех трех головок трехглавой мышцы голени.
Распределение дозы препарата осуществляется таким образом, чтобы максимально устранить влияние данной группы мышц в зависимости от выявленной ведущей патологической синергии на двигательные локомоции, возможно также сочетание введения препарата с этапным гипсованием. Распределение препарата по мышечным группам в зависимости от преобладающего влияния патологических синдромов представлено в табл. 2.
Таким образом, дифференцированное снижение спастичности позволяет всю последующую реабилитацию проводить на фоне физиологического мышечного нормотонуса. При этом такого результата можно добиться без оперативных вмешательств или длительного применения каких-либо препаратов, оказывающих системное действие на весь организм. Немаловажным является отсутствие влияния препарата ботулотоксина типа А на центральную нервную систему в виде торможения или возбуждения, что позволяет закрепить двигательный стереотип.
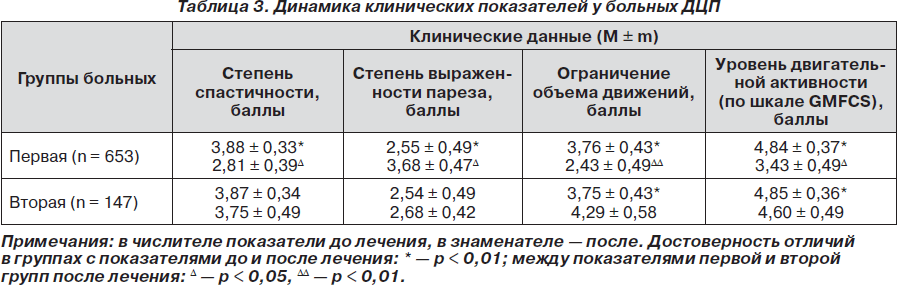
Анализ динамики состояния клинических синдромов у детей к 10-летнему возрасту представлен в табл. 3.
Таким образом, у детей, получавших терапию препаратом ботулотоксина типа А отмечаются достоверно высокие показатели двигательного развития на фоне снижения спастичности и увеличения мышечной силы. Это связано с тем, что снижение спастичности на более длительный период позволяло более эффективно проводить комплексы консервативной реабилитации.
Следует подчеркнуть, что применением данного препарата невозможно полностью устранить влияние патологических тонических рефлексов и связанных с ними синдромов, так как они обусловлены патологией со стороны структур центральной нервной системы. Нашей целью было обучить ребенка с помощью различных методов развития локомоций на фоне устранения спастичности активно преодолевать их влияние. Кроме того, центральной задачей в позднем возрастном периоде было предупреждение развития контрактур и деформаций.
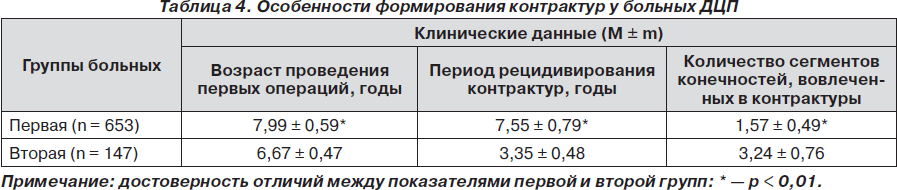
Формирование контрактур является типичным в клинической картине спастических форм ДЦП. В среднем, по данным анамнеза, контрактуры формируются уже к 6,88 ± 1,35 года. Сформированная в одном из сегментов, она провоцирует образование в других биомеханически связанных с ним суставах. При этом патологический стереотип движений закрепляется, что при ходьбе усиливает выраженность ограничения движений. Поэтому в настоящее время актуальным является превентивный хирургический подход к лечению контрактур [13, 17, 23, 25, 30, 32]. Своевременное устранение контрактуры в одном суставе предупреждает развитие деформаций в других сегментах конечностей, не допускает формирования патологического стереотипа движения, его закрепления в функциональных системах мозга. Однако, даже если возникает необходимость хирургического устранения ограничения движений в сегменте конечности, цели консервативной реабилитации следующие: во-первых — отложить операции до более позднего возрастного периода; во-вторых — к моменту ее проведения сформировать физиологически «правильный» стереотип движения; в-третьих — нивелировать влияние патологических мышечных синкинезий (рефлексов), желательно в виде активного их преодоления самим ребенком; в-четвертых — уменьшить степень пареза мышц антагонистов спастичных групп. Таким образом, ребенок, которому планируется оперативное вмешательство по устранению контрактуры, должен быть готов к новым функциональным двигательным возможностям и требованиям по формированию движений. Особенности ортопедического статуса до и после хирургического лечения в исследуемых группах представлены в табл. 4.
Согласно полученным результатам, несмотря на то, что по клиническим проявлениям заболевания обе группы значимо не отличались между собой в начале нашего исследования, у больных первой группы хирургическое лечение начато позже. При этом к данному возрасту была сформирована контрактура только в одном из сегментов конечностей, тогда как во второй группе в контрактуру вовлекались несколько суставов, что потребовало проведения нескольких хирургических вмешательств и, соответственно, более длительного восстановительного периода в отличие от первой группы, где объемы вмешательств были меньше. В дальнейшем, после проведенной операции, рецидив патологических установок возникал в первой группе позже и не у всех пациентов. Соответственно необходимость в повторном оперативном вмешательстве возникла у 317 (48,55 %) больных первой группы (рецидивирование мы объясняем интенсивным ростом ребенка), тогда как во второй группе все больные были повторно прооперированы. Таким образом, необходимость снижения спастичности сохраняется и после оперативных вмешательств, что позволило эффективно снизить вероятность рецидивирования контрактур. Кроме того, 64 (9,8 %) больным первой группы в течение всего периода наблюдений вообще не проводились операции в связи с отсутствием у них контрактур.
Таким образом, введение препарата ботулотоксина типа А больным со спастическими формами ДЦП является методом выбора. На данный момент не существует других консервативных методов локального снижения спастики в каждой конкретной мышце на достаточно длительный период, без побочных эффектов. Кроме того, мы обратили внимание, по данным катамнестических наблюдений, что результатом введения данного препарата являлось отсутствие возвращения прежних, первичных, показателей спастичности и пролонгирование длительности эффекта при повторных введениях. Данное наблюдение, по нашему мнению, является малоизученным. Скорее всего, оно обусловлено более быстрым формированием активных целенаправленных движений по преодолению спастичности антагонистов на фоне лечебной гимнастики, вертикализации и подавлением тонических рефлексов. Данный эффект позволяет снизить частоту введения препарата. Так, в 123 (18,84 %) случаях с 2–3-кратного ежегодного введения мы перешли на однократное.
Другой проблемой использования препарата являются случаи его неэффективности. Проведенный анализ показал, что истинные причины, связанные с развитием иммунорезистентности, редки и составили, по нашим данным, не более 5,5 %. Актуальной является «ложная» резистентность, обусловленная технически неграмотным проведением инъекции, неправильным определением показаний к применению препарата, что составляет не менее 80 % от всех неэффективных инъекций. Неэффективность вследствие мышечного перерождения встречается в 15 % случаев. Необходимо повышать уровень образовательных программ и улучшать диагностические возможности специалистов. С целью более точного определения локализации инъекции в нашей клинике активно используются возможности стимуляционной электромиографии, ультразвукового исследования мышц.
В настоящий момент единственным минусом применения препарата ботулотоксина типа А является высокая стоимость препарата. В странах Европы, Северной Америки препарат является бесплатным для больного и включен в систему стандартов лечения спастичности.
Выводы
1. Препарат ботулотоксина типа А является препаратом, позволяющим дифференцированно снижать мышечную спастичность на длительный срок, без выраженных побочных эффектов.
2. Введение препарата у больных ДЦП должно осуществляться дифференцированно в зависимости от преобладания в клинической картине заболевания патологических тонических рефлексов или спастических нейроортопедических синдромов. Возможно сочетание введения препарата с проведением этапного гипсования нижних конечностей.
3. Регулярное применение препарата позволяет добиться лучших клинических показателей и, соответственно, двигательного развития ребенка, способствует недопущению развития контрактур в конечностях.
1. Артемьев Д.В., Орлова О.Р., Маринкова А.Э. Использование ботокса в медицинской практике // Неврологический журнал. — 2000. — Т. 5, № 4. — С. 46-51.
2. Гросс Н.А. Развитие двигательных навыков у детей с ДЦП // Курортное дело. — 2007. — Т. 1, № 2. — С. 21-24.
3. Губертус фон Фосс. Дитячий церебральний паралiч — панорама лiкувальних можливостей // Phisiotherapie. — 2006. — № 5. — P. 5-8.
4. Дамулин И.В. Синдром спастичности и основные направления его лечения // Журнал неврологии и психиатрии. — 2003. — № 12. — С. 4-9.
5. Евтушенко О.С., Лисовский Е.В., Евтушенко С.К., Шаймурзин М.Р. Опыт 4-хлетнего применения диспортовых блокад в детской нейрореабилитологии // Соціальна педіатрія: Мат-ли VII Міжнар. укр.-бавар. симпоз. «Медико-соціальні аспекти реабілітації дітей з органічним ураженням нервової системи». — К. — 2005. — Вип. III. — С. 176-178.
6. Евтушенко О.С., Евтушенко С.К. Сучаснi методи лiкування м’язової спастичностi у дiтей з органiчними захворюваннями нервової системи: Методичнi рекомендацiї. — Донецьк, 2006. — 26 с.
7. Журавлев A.M. О хирургической коррекции гамстринг-синдрома, осложненного слабостью трехглавой мышцы голени, у больных детским церебральным параличом // Вестник травматологии и ортопедии им. Н.Н. Приорова. — 2006. — № 3. — С. 40-43.
8. Завалишин И.А. Спастичность // Русский медицинский журнал. — 2004. — № 5. — С. 261-265.
9. Заикина Г.Т. Обзор методов физической реабилитации детей с церебральным параличом // Педагогико-психологические и медико-биологические проблемы физической культуры и спорта. — 2006. — Т. 1, № 1. — С. 156-162.
10. Зиновьева О.Е., Шенкман Б.С., Катушкина Э.А. Состояние скелетных мышц при церебральной спастичности // Неврологический журнал. — 2008. — Т. 13, № 6. — С. 42-48.
11. Зиновьева О.Е., Шенкман Б.С., Катушкина Э.А. Патогенез церебральной спастичности // Український неврологiчний журнал. — 2009. — № 1(10). — С. 11-17.
12. Качмар О.О. Система класифiкацiї великих моторних функцiй у дiтей iз церебральним паралiчем // Мiжнародний неврологiчний журнал. — 2008. — № 1(17). — С. 90-94.
13. Кенис В.М.Этапные гипсовые коррекции в лечении детей с детским церебральным параличом // Амбулаторная хирургия. Стационарозамещающие технологии. — 2006. — № 1. — С. 53-56.
14. Кислякова Е.А., Алимова И.Л., Стоянова Н.С. Эффективность применения ботулинического токсина типа А в комплексной реабилитации детей и подростков с детским церебральным параличом // Вопросы современной педиатрии. — 2006. — № 5. — С. 267.
15. Кислякова Е.А., Алимова И.Л., Маслова Н.Н. Особенности роста и развития больных детским церебральным параличом при проведении комплексной реабилитации с применением ботулинического токсина типа А // Российский вестник перинатологии и педиатрии. — 2007. — Т. 52, № 5. — С. 43-51.
16. Крамчанiнова О.Г., Машуренко В.I., Брагина Н.В. Досвiд використання нейром’язових блокад при лiкуваннi спастичностi за допомогою препарату Диспорт // Приложение к журналу «НЕЙРО NEWS»: Материалы Международного и IX Украинского конгресса детских неврологов «Диагностика, лечение, реабилитация и профилактика заболеваний нервной системы у детей». — Киев, 2009. — С. 25-26.
17. Кривобоков В.Н., Бабина Л.М., Кривобоков Н.Г. Восстановительное лечение на курорте детей, оперированных по поводу детского церебрального паралича // Вопросы курортологии, физиотерапии и лечебной физической культуры. — 2008. — № 5. — С. 40-41.
18. Диагностические и экспертные шкалы в неврологической практике (методические рекомендации) / Г.М. Кушнир, В.В. Могильников, Л.Л. Корсунская, А.А. Микляев. — Симферополь, 2004. — 34 с.
19. Мак-Комас А.Дж. Скелетные мышцы. — К.: Олимпийская литература, 2001. — 407 с.
20. Мартынюк В.Ю., Краснов В.В. К вопросу о постмаркетинговой оценке эффективности медикаментозных препаратов в лечении заболеваний нервной системы у детей // Современная педиатрия. — 2005. — № 3(8). — С. 35-41.
21. Михайленко В.Е. Нейротоксинотерапия в комплексном восстановительном лечении детей со спастическим церебральным параличом // Новости медицины и фармации в Украине. — 2006. — № 20–22(202–204). — С. 7-8.
22. Моiсеєнко Р.А., Терещенко А.В. Окремi показники дiяльностi дитячої неврологiчної служби // Приложение к журналу «НЕЙРО NEWS»: Материалы Международного и IX Украинского конгресса детских неврологов «Диагностика, лечение, реабилитация и профилактика заболеваний нервной системы у детей». — Киев, 2009. — С. 61.
23. Ненько А.М., Дерябин А.В. Оригинальные методы хирургического лечения детей с церебральным параличом, разработанные в специализированном клиническом санатории // Вестник физиотерапии и курортологии. — 2007. — № 2. — С. 54-56.
24. Парфенов В.А. Спастичность // Применение ботокса (токсина ботулизма типа А) в клинической практике: руководство для врачей / Под ред. О.Р. Орловой, Н.Н. Яхно. — М.: Каталог, 2001. — С. 108-123.
25. Перхурова И.С., Лузинович В.М., Сологубов Е.Г. Регуляция позы и ходьбы при детском церебральном параличе и некоторые способы коррекции. — М.: Книжная палата, 1996. — С. 153-219.
26. Петрухин А.С. Этиология двигательных и психических нарушений у детей раннего возраста, принципы реабилитации и профилактики // Зб. праць «Соцiальна педiатрiя i реабiлiтологiя». — Київ, 2007. — С. 88-92.
27. Сальков В.Н., Лильин Е.Т., Степанченко О.В., Степанченко А.В., Меланченко Е.А. Ботокс при трицепс синдроме у детей с ДЦП // Журнал неврологии и психиатрии имени С.С. Корсакова. — 2002. — Т. 102, № 5. — С. 24-25.
28. Семенова К.А. Восстановительное лечение больных с резидуальной стадией детского церебрального паралича. — М.: Антидор, 1999. — 375 с.
29. Сковронська А.О., Дякiв О.Б., Ревчук В.С., Процiв Л.I. Диспорт — нове слово у комлекснiй реабiлiтацiї дiтей зi спастичними формами дитячого церебрального паралiчу // Зб. праць «Соцiальна педiатрiя i реабiлiтологiя». — Київ, 2007. — С. 309-311.
30. Умнов В.В., Кенис В.М. Ортопедо-нейрохирургическая концепция комплексного лечения детей со спастическими параличами // Вестник травматологии и ортопедии им. Н.Н. Приорова. — 2007. — № 4. — С. 9-14.
31. Хатькова С.Е. Постинсультная спастичность: применение ботулотоксина // Клиническая геронтология. — 2007. — Т. 13, № 8. — С. 30-34.
32. Щеколова Н. Б., Белокрылов Н.М., Ненахова Я.В. Ортопедические аспекты коррекции двигательных нарушений у детей с церебральным параличом // Российские медицинские вести. — 2009. — Т. 14, № 2. — С. 14-22.
33. Яковлев А.Н. Различные топографические варианты введения ботулотоксина в лечении спастических форм детского церебрального паралича // Приложение к журналу «НЕЙРО NEWS»: Материалы Международного и IX Украинского конгресса детских неврологов «Диагностика, лечение, реабилитация и профилактика заболеваний нервной системы у детей». — Киев, 2009. — С. 35-36.
34. Ярошевская Е.Н., Михайловская Л.А. Обменные процессы в мышцах при детских церебральных параличах // Мат-лы к научн.-практич. конф. по сан. лечению детей с ДЦП / Ленинградский научн.-исслед. детский ортопед. инст. им. Г.И. Турнера. — Ленинград, 1966. — С. 63-67.
35. Abstracts from the 6th International Conference on Basic and Therapeutic Aspects of Botulinum and Tetanus Toxins 2008. — Baveno, Lake Maggiore, Italy, June 12-14 // Toxicon. — 2(2008). — 51. — Р1-54.
36. Bakheit A.M., Thilmann A.F., Ward A.B. et al. A randomized, double-blind, placebo-controlled, dose-ranging study to compare the efficacy and safety of three doses of botulinum toxin type A (Dysport) with placebo in upper limb spasticity after stroke // Stroke. — 2000. — Vol. 31. — P. 2402-2406.
37. Bayram S., Sivrioglu K., Karli N. еt al. Low-dose botulinum toxin with short-term electrical stimulation in poststroke spastic drop foot: a preliminary study // Am. J. Phys. Med. Rehabil. — 2006. — Vol. 85. — P. 75-81.
38. Cardoso E., Pedreira G., Prazeres A. et al. Does botulinum toxin improve the function of the patient with spasticity after stroke? // Arg. Neuropsiquiatr. — 2007. — Vol. 65(3-A). — P. 592-595.
39. Guy Monnier, Bernard Parratte. Spasticity in children with cerebral palsy // Practical Handbook on Botulinum Toxin. SOLAL, Marseille — France, 2007. — P. 79-99.
40. Ito J., Araki A., Tanaka H. et al Muscle histopathology in spastic cerebral palsy // Brain & Development. — 1996. — Vol. 18. — P. 299-303.
41. Ozcakir S., Sivrioglu K. Botulinum toxin in poststroke spasticity // Clin. Med. Res. — 2007. — Vol. 5. — P. 132-138.