Международный неврологический журнал 2 (40) 2011
Вернуться к номеру
Применение карбамазепина для лечения нейропатической боли: обзор исследований
Авторы: Савустьяненко А.В., к.м.н., Донецкий национальный медицинский университет им. М. Горького
Рубрики: Неврология
Версия для печати
Карбамазепин является противоэпилептическим средством, используемым также для лечения нейропатической боли. Основной механизм действия карбамазепина сводится к блокаде потенциалзависимых натриевых каналов. При невралгии тройничного нерва: карбамазепин ослабляет выраженность боли у 70–80 % пациентов, частота развития побочных эффектов составляет 25–50 %, для него характерно самое высокое соотношение эффективность/безопасность по сравнению с другими препаратами (уровень доказательности А, препарат первого выбора при лечении невралгии тройничного нерва). При болевой форме диабетической полинейропатии: карбамазепин ослабляет выраженность боли у 30–50 % пациентов, частота развития побочных эффектов составляет 25–50 %, соотношение эффективность/безопасность является более низким, чем у многих других лекарственных средств (препарат третьей линии терапии при лечении болевой формы диабетической полинейропатии). При других синдромах нейропатической боли карбамазепин либо плохо исследован, либо малоэффективен/неэффективен.
Карбамазепин, невралгия тройничного нерва, диабетическая полинейропатия.
 Карбамазепин был открыт в 1953 г. швейцарским ученым Walter Schindler, работавшим в фармацевтической компании Geigy AG (Базель, Швейцария). Спустя семь лет, в 1960 г., Walter Schindler удалось синтезировать карбамазепин, и уже в 1962 г. препарат был выпущен на рынок в качестве средства для лечения невралгии тройничного нерва (НТН). Противоэпилептические свойства препарата были выяснены несколько позже: с 1965 г. он начал использоваться в качестве антиконвульсанта в Великобритании, а с 1974 г. — и в США [1].
Карбамазепин был открыт в 1953 г. швейцарским ученым Walter Schindler, работавшим в фармацевтической компании Geigy AG (Базель, Швейцария). Спустя семь лет, в 1960 г., Walter Schindler удалось синтезировать карбамазепин, и уже в 1962 г. препарат был выпущен на рынок в качестве средства для лечения невралгии тройничного нерва (НТН). Противоэпилептические свойства препарата были выяснены несколько позже: с 1965 г. он начал использоваться в качестве антиконвульсанта в Великобритании, а с 1974 г. — и в США [1].
В настоящее время карбамазепин с успехом применяют для лечения генерализованных тонико-клонических судорог (grand mal), а также простых и сложных парциальных припадков [2].
Однако не утратило своего значения и первое направление терапии, по которому применили карбамазепин, — лечение нейропатической боли (невралгия тройничного нерва и пр.). Дело в том, что нейропатическая боль трудно поддается коррекции: исследователи сообщают, что неэффективны нестероидные противовоспалительные средства и даже опиаты, применяемые в обычных клинических дозах [3]. В связи с этим представляет особый интерес возможность использования карбамазепина для облегчения и купирования данного вида боли.
Учитывая актуальность темы, мы посвятили настоящий обзор возможностям применения карбамазепина для лечения нейропатической боли.
Механизмы действия карбамазепина
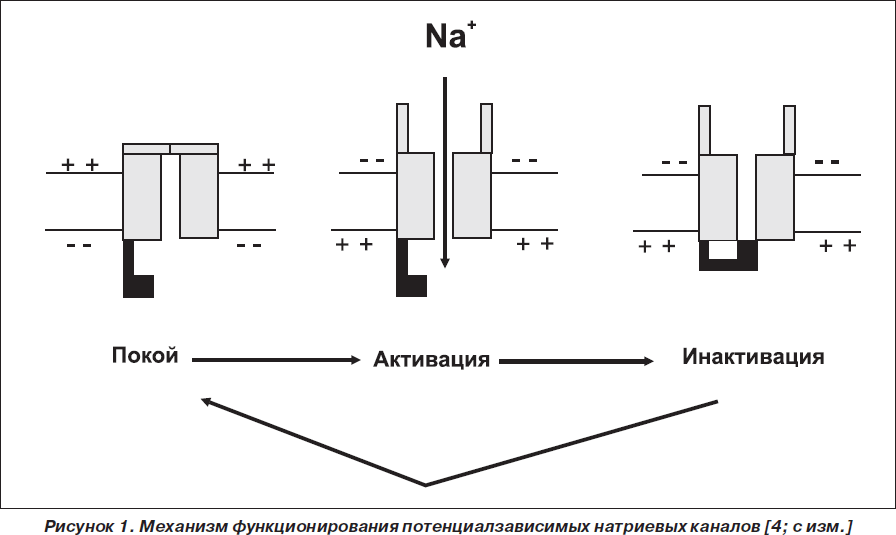
Возбуждение по нервным волокнам распространяется с помощью потенциалзависимых натриевых каналов (рис. 1). Исходно канал находится в состоянии покоя. Однако при изменении мембранного потенциала его наружные (активационные) ворота открываются, и в нервные волокна начинают поступать ионы Na+, что приводит к генерации потенциалов действия. Затем внутренние (инактивационные) ворота (обозначены на рис. 1 черным цветом) закрываются, и канал переходит в состояние инактивации. Прежде чем канал снова сможет открыться, он должен вернуться в состояние покоя [4].
По механизму действия карбамазепин относится к группе мембранодепрессоров (мембраностабилизаторов), поскольку, проникая в нервные волокна, связывается с внутренними (инактивационными) воротами и: 1) ускоряет закрытие этих ворот; 2) увеличивает время, в течение которого эти ворота остаются закрытыми. Как следствие, потенциалзависимые натриевые каналы находятся в состоянии инактивации и не могут открыться, что приводит к нарушению генерации потенциалов действия. С этого момента, если больной, например, испытывал боль, она ослабляется или полностью исчезает [5].
Вышеописанный механизм свидетельствует о том, что карбамазепин не препятствует открытию потенциалзависимых натриевых каналов, но ускоряет их закрытие. Следовательно, чем больше нервных импульсов проводится по нервным волокнам и большее количество каналов открывается (т.е. чем сильнее боль), тем большее количество каналов сможет закрыть карбамазепин (т.е. тем эффективнее карбамазепин). Этот принцип получил название use-dependent механизма [6].
На сегодняшний день науке известно девять типов потенциалзависимых натриевых каналов. Проведение боли связывают с тремя их основными разновидностями: Nav1.3, Nav1.7 и Nav1.8. Как свидетельствуют исследования, карбамазепин блокирует эти три типа натриевых каналов (переводит в состояние инактивации), что и обусловливает его обезболивающую активность. Предполагают, что более углубленное изучение потенциалзависимых натриевых каналов позволит ответить на вопрос, почему карбамазепин высоко эффективен при одних видах нейропатической боли и мало эффективен при других [7, 8].
В обезболивающую активность карбамазепина могут вносить вклад и другие механизмы его действия, например усиление ГАМКергического торможения, угнетение высвобождения глутамата и т.д. [9, 10].
Нейропатическая боль
Как известно, боль бывает острой и хронической. Острая боль почти всегда носит ноцицептивный характер (связана с повреждением или воспалением соматических или висцеральных тканей). Хроническая боль может быть как ноцицептивной, так и нейропатической (связана с повреждением или воспалением нервной ткани в периферической или центральной нервной системе). Ноцицептивную боль обычно лечат с помощью противовоспалительных или обезболивающих средств, в то время как нейропатическую — с помощью средств, влияющих на проведение возбуждения и высвобождение нейромедиаторов (противоэпилептические средства, например карбамазепин; антидепрессанты и т.д.) [11].
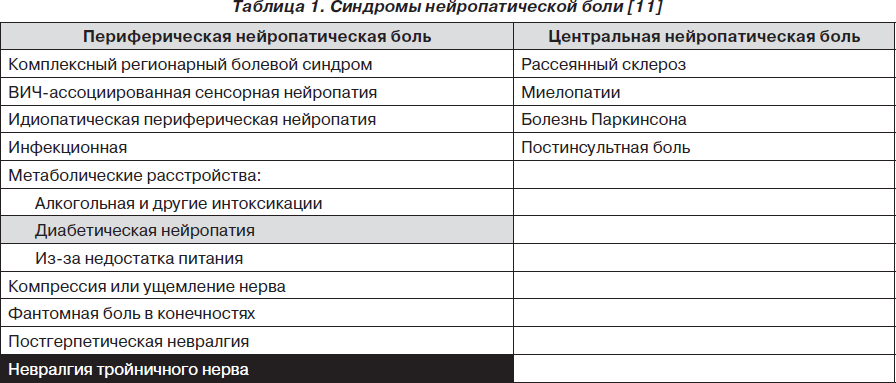
В табл. 1 перечислены основные синдромы нейропатической боли. Если нейропатическая боль связана с повреждением или воспалением нервной ткани в периферической нервной системе, ее называют периферической нейропатической болью, если в центральной нервной системе — центральной нейропатической болью. Данные исследований (см. ниже) свидетельствуют о том, что карбамазепин практически всегда используется для лечения невралгии тройничного нерва, иногда для лечения диабетической нейропатии (поля табл. 1 выделены соответственно черным и серым цветом). При остальных синдромах нейропатической боли карбамазепин либо плохо исследован, либо малоэффективен/неэффективен.
Периферическая нейропатическая боль может носить жгучий, колющий, стреляющий или ноющий характер и сочетаться с дизестезиями (особенно часто — с аллодинией), чувством онемения и другими нарушениями. Боль часто усиливается ночью и может обостряться при физической активности [11]. Поскольку карбамазепин не эффективен при центральной нейропатической боли, мы не будем давать ее характеристику.
Невралгия тройничного нерва
Распространенность невралгии тройничного нерва (НТН) составляет около 4,3 случая на 100 000 населения, причем женщины болеют несколько чаще мужчин (1,74 : 1). Пик встречаемости заболевания приходится на возраст 60–70 лет, причем классическая НТН обычно не встречается до 40 лет [12, 13].
Патогенетическое обоснование применения карбамазепина
Различают классическую и симптоматическую НТН. Причины классической НТН продолжают выясняться. Однако считается, что основным фактором, ведущим к ее развитию, является сдавление нервного корешка аберрантными или извилистыми сосудами. Это ведет к демиелинизации нервных волокон и возникновению в местах демиелинизации эктопических («незапланированных», случайных) нервных импульсов. Они эфаптически (в местах простого сближения нейронов, без участия синапсов) передаются с одного нервного волокна на другое, что ведет к формированию боли [14].
Карбамазепин блокирует потенциалзависимые натриевые каналы, что препятствует возникновению эктопических нервных импульсов и их эфаптическому проведению. В результате боль ослабляется или полностью исчезает.
Симптоматическая НТН развивается вследствие опухолей, рассеянного склероза, структурных нарушений основания черепа и т.д. Карбамазепин при этом виде НТН не эффективен [14]. Далее в настоящей статье симптоматическая НТН рассматриваться не будет — текст будет касаться только классической НТН.
Данные клинических исследований
Чтобы избежать развития токсических эффектов, прием карбамазепина при НТН рекомендуют начинать со 100–200 мг/день. Затем дозу постепенно увеличивают до тех пор, пока боль не ослабнет или не начнут нарастать побочные эффекты. У большинства пациентов эффективное ослабление боли наблюдается при назначении препарата в дозе 200–800 мг/день в два или три приема. Максимальная доза составляет обычно 1000–1200 мг/день, хотя в литературе имеются сообщения о повышении дозы до 2400 мг/день. Поскольку НТН склонна к спонтанной ремиссии, а карбамазепин — к развитию побочных эффектов, то спустя 2–3 месяца после ослабления боли рекомендуют прерывать прием препарата до следующего обострения боли [14, 15].
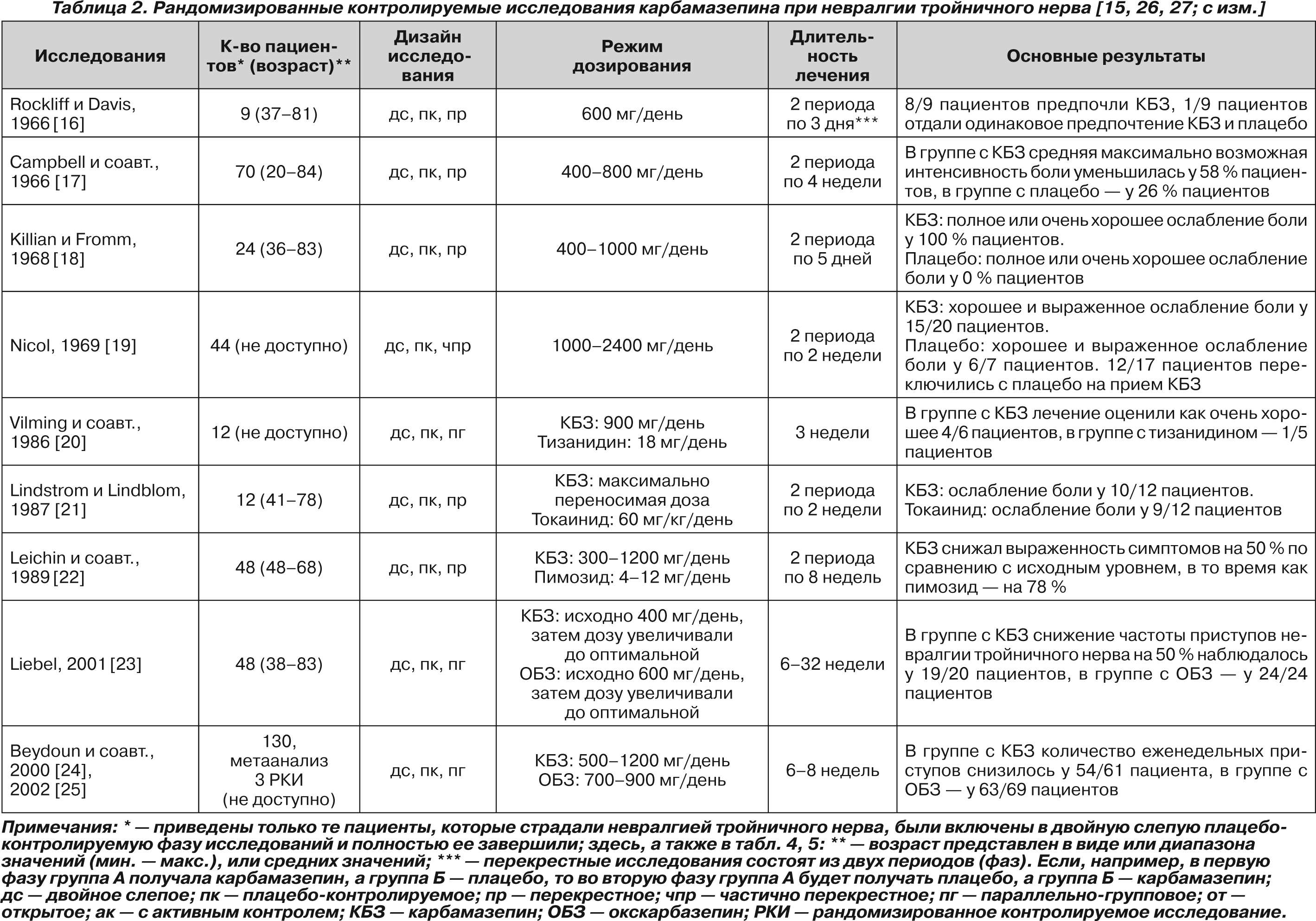
В литературе нам удалось обнаружить 8 рандомизированных контролируемых исследований и 1 метаанализ трех рандомизированных контролируемых исследований, в которых карбамазепин назначали для лечения НТН [16–25]. Краткие сведения об этих исследованиях обобщены в табл. 2.
Результаты процитированных исследований свидетельствуют о том, что в первые недели после назначения карбамазепина выраженное и умеренное ослабление боли наблюдается у 70–80 % пациентов, а также снижается частота приступов НТН. В дополнение к этому карбамазепин может уменьшать выраженность и других проявлений НТН, например аллодинии.
J.C. Taylor и соавт. [28] задались целью ответить на вопрос, как изменится эффективность карбамазепина при его длительном применении для лечения НТН. В исследование было включено 143 пациента, за которыми ранее велось наблюдение в течение 16 лет. В результате оказалось, что первоначально препарат был эффективен у 99 (69 %) пациентов. В течение 2 месяцев — 10 лет резистентность развилась у 19 (13 %) пациентов. Из оставшихся 80 (56 %) пациентов спустя 1–4 года препарат был эффективен у 49 (34 %) пациентов, а спустя 5–16 лет — у 31 (22 %) пациента.
Прием карбамазепина может приводить к развитию ряда побочных эффектов. К наиболее частым относят головную боль, головокружение, атаксию, сонливость, утомляемость, нарушение памяти, диплопию, нистагм, тошноту, запоры, нарушение печеночных проб, лейкопению, кожную сыпь, взаимодействие с варфарином. Препарат вызывает также ряд более редких, но иногда очень тяжелых побочных эффектов [29–31].
Н. Askmark и В.Е. Wiholm [32] сообщили, что при назначении карбамазепина кожные реакции возникали с частотой 48 %, гематологические расстройства — 12 %, дисфункция печени — 10 %. Практически все эти нарушения развивались в течение первых 2 месяцев терапии. Вместе с тем авторы отмечают, что частота развития серьезных гематологических нарушений, таких как панцитопения (0,04 случая/миллион выписанных суточных доз) и агранулоцитоз (0,06 случая/миллион выписанных суточных доз), была крайне низкой, в связи с чем они ставят под сомнение необходимость непрерывного гематологического мониторинга. J.M. Pellock [33] отмечает, что большинство побочных эффектов, связанных с приемом карбамазепина, носит легкий транзиторный характер и может быть обращено путем коррекции дозы или скорости увеличения дозы.
В целом при применении карбамазепина вероятность появления каких-либо побочных эффектов составляет 25–50 % [27].
Уровень доказательности и рекомендации
Как было показано выше, для карбамазепина характерна высокая частота развития побочных эффектов. Так, по данным McQuay и соавт. [27], при применении данного препарата показатель NNH (количество пациентов, которое нужно пролечить, чтобы побочные эффекты развились у 1 пациента по сравнению с контрольной группой) для более легких побочных эффектов составляет 3,4, а для более тяжелых побочных эффектов, требующих прекращения терапии, — 24. В то же время вышеприведенные исследования свидетельствуют о высокой эффективности карбамазепина при НТН. По данным McQuay и соавт. [27], показатель NNT (количество пациентов, которое нужно пролечить, чтобы получить положительный терапевтический эффект у 1 пациента по сравнению с контрольной группой) для данного препарата составляет 2,6, а по данным Sindrup и Jensen [34], а также Wiffen и соавт. [35, 36], его величина равна 1,7–1,8.
Высокая эффективность карбамазепина, несмотря на высокую частоту побочных эффектов, обусловливает наиболее оптимальное соотношение эффективность/безопасность у данного препарата при лечении НТН по сравнению со всеми остальными лекарственными средствами. Об этом свидетельствуют данные систематических обзоров [27, 35, 36], по результатам которых карбамазепину присвоен уровень доказательности А* в отношении применения при НТН. Клинические рекомендации: карбамазепин должен назначаться в качестве терапии первого выбора при лечении классической невралгии тройничного нерва, поскольку он эффективен у большинства пациентов, и ни один другой препарат не был эффективнее карбамазепина по результатам больших исследований [14; с изм.].
Карбамазепин рекомендован в качестве терапии первой линии при НТН. Если он не эффективен, тогда прибегают к хирургическим методам лечения НТН или другим лекарственным средствам (табл. 3) [37].
Диабетическая нейропатия
Диабетическая нейропатия, более часто называемая диабетической полинейропатией (ДПН), встречается у 60–70 % пациентов с сахарным диабетом, причем ее болевая форма встречается у 8–26 % пациентов. Наиболее частая из болевых форм ДПН — хроническая сенсомоторная дистальная симметричная полинейропатия. Наиболее высокая распространенность ДПН наблюдается среди пациентов, страдающих сахарным диабетом более 25 лет [38, 39].
Патогенетическое обоснование применения карбамазепина
Повреждение нервов при ДПН связывают с целым рядом факторов [39]:
— метаболические факторы, такие как высокий уровень глюкозы, длительное течение диабета, нарушение уровня липидов в плазме крови, иногда низкий уровень инсулина;
— нейрососудистые факторы, ведущие к повреждению кровеносных сосудов, доставляющих кислород и питательные вещества к нервам;
— аутоиммунные факторы, вызывающие воспаление в нервах;
— механическое повреждение нервов, например, при синдроме запястного канала;
— врожденные признаки, повышающие чувствительность к заболеваниям нервов;
— негативное влияние образа жизни, например табакокурения и употребления алкоголя.
Механизмы формирования боли при ДПН аналогичны тем, которые были описаны выше при рассмотрении НТН. Соответственно, эффективность карбамазепина при ДПН также связана преимущественно с блокадой потенциалзависимых натриевых каналов [40].
Данные клинических исследований
Общие подходы к назначению карбамазепина при болевой форме ДПН остаются такими же, как и при НТН. Сначала назначают низкие дозы препарата, а затем дозу постепенно увеличивают до достижения лечебного эффекта или развития выраженных побочных эффектов. Из-за малого количества исследований трудно верифицировать оптимальный диапазон доз карбамазепина и их максимальные значения. В целом в доступных рандомизированных контролируемых исследованиях болевой формы ДПН данный препарат назначался в дозах 200–600 мг/день [15, 27].
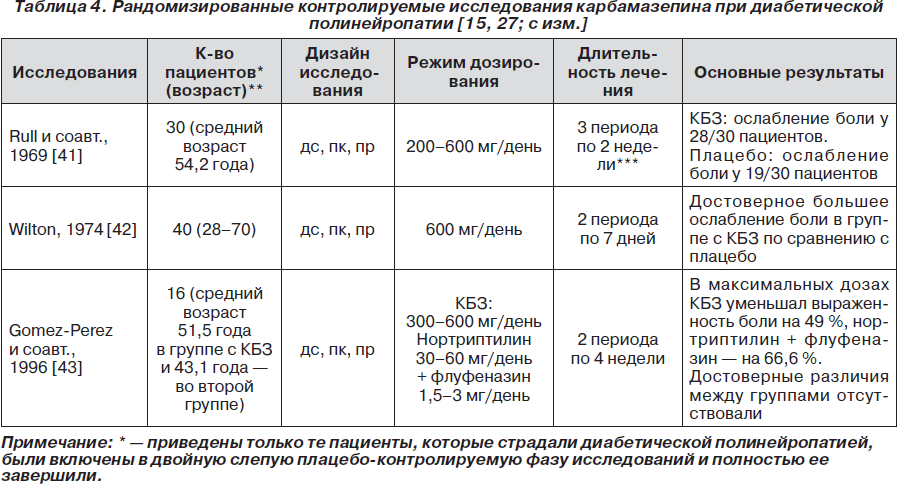
В литературе нам удалось обнаружить 3 рандомизированных контролируемых исследования, в которых карбамазепин назначали для лечения болевой формы ДПН [41–43]. Краткие сведения об этих исследованиях обобщены в табл. 4.
В систематическом обзоре Н. McQuay и соавт. [27] сообщают, что эффективность карбамазепина (оцененного ввиду малого количества исследований совместно с фенитоином) при болевой форме ДПН составляет 30–50 %. В дополнение к этому карбамазепин может уменьшать выраженность и других проявлений ДПН, например аллодинии.
При назначении карбамазепина для лечения болевой формы ДПН развиваются те же побочные эффекты и с той же частотой, что и при лечении НТН [27]. Известна способность карбамазепина вызывать развитие гипонатриемии. Экспериментальные исследования свидетельствуют о том, что карбамазепин в условиях гипонатриемии может повышать уровень глюкозы в плазме крови [44]. Однако в одном из клинических рандомизированных контролируемых исследований было показано, что назначение карбамазепина не влияло на гликемический контроль [42].
Уровень доказательности и рекомендации
В систематическом обзоре Н. McQuay и соавт. [27] сообщают, что показатель NNT для карбамазепина (оцененного ввиду малого количества исследований совместно с фенитоином) при лечении болевой формы ДПН составляет 2,5. Аналогично показатель NNH для более легких побочных эффектов составляет 3,1, а для более тяжелых побочных эффектов, требующих прекращения терапии, — 20.
В доступной литературе нам не удалось найти систематических обзоров, в которых бы оценивался уровень доказательности применения карбамазепина при болевой форме ДПН.
Несмотря на то что карбамазепин эффективен у значительного количества пациентов с болевой формой ДПН (хотя это количество было меньшим, чем при НТН), соотношение эффективность/безопасность у этого препарата оказалось более низким, чем у многих других лекарственных средств. В связи с этим для лечения болевой формы ДПН карбамазепин используют в качестве препарата третьей линии терапии при неэффективности препаратов первой и второй линии терапии, таких как трициклические антидепрессанты (амитриптилин, имипрамин, нортриптилин), селективные ингибиторы обратного захвата серотонина и норадреналина (дулоксетин, венлафаксин), модуляторы a2-d-субъединицы кальциевых каналов (габапентин, прегабалин), опиоидные анальгетики и трамадол [37, 45, 46].
Другие виды нейропатической боли
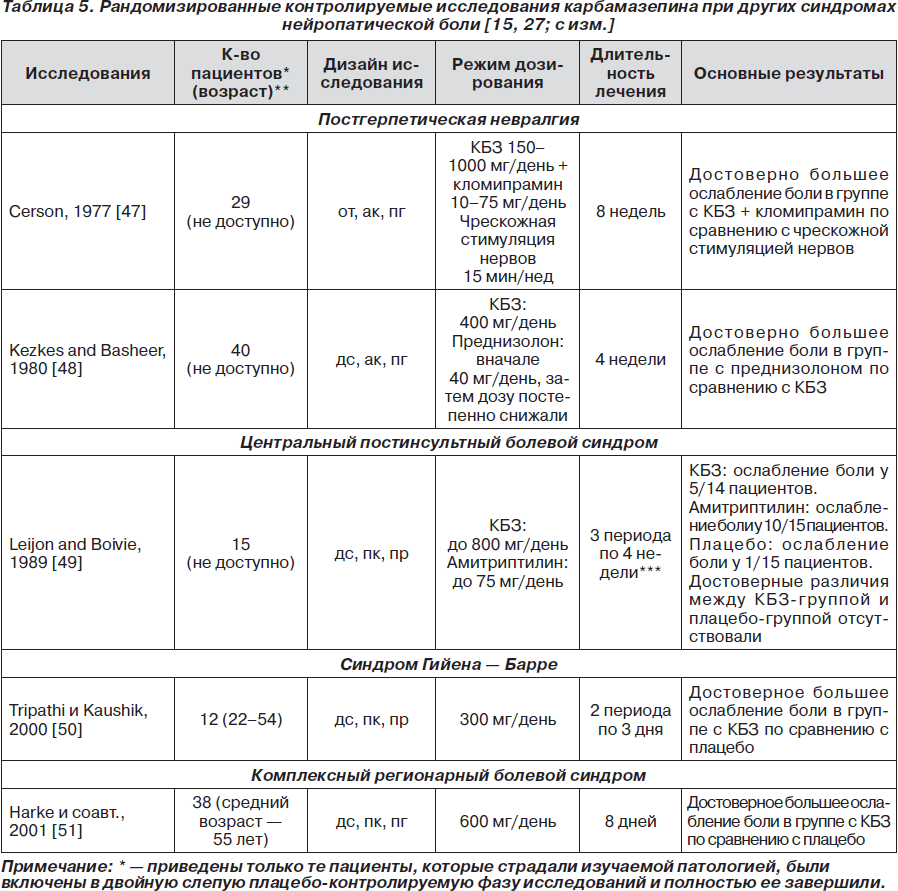
Применение карбамазепина при других видах нейропатической боли ограничено либо вследствие того, что препарат плохо исследован (синдром Гийена — Барре [50], комплексный регионарный болевой синдром [51]), либо из-за его малой эффективности (постгерпетическая невралгия [47, 48]), либо потому, что он вовсе не эффективен (центральный постинсультный болевой синдром [49]). Соответствующие рандомизированные контролируемые исследования приведены в табл. 5.
Из препаратов карбамазепина, имеющихся на фармацевтическом рынке, в течение многих лет хорошо себя зарекомендовал Финлепсин® (Teva, Израиль). В настоящее время доступна его ретардная форма — Финлепсин® ретард, что позволяет оптимизировать длительную терапию тригеминальной невралгии. Финлепсин® ретард обеспечивает стабильную концентрацию препарата в плазме крови и отсутствие «провалов» и «пиков» концентрации активного вещества. Благодаря постепенному и равномерному высвобождению активного вещества из микрокапсул кратность приема снижается до 1–2 раз в сутки. Поддержание стабильной концентрации препарата в плазме крови объясняет его высокую клиническую эффективность (70–80 % успешного лечения). Он более безопасен, чем короткодействующие карбамазепины, выпускается в дозировках, удобных для терапии нейропатических болевых синдромов.
Выводы
1. Карбамазепин является противоэпилептическим средством, используемым также для лечения нейропатической боли. Основной механизм действия карбамазепина сводится к блокаде потенциалзависимых натриевых каналов.
2. При невралгии тройничного нерва карбамазепин ослабляет выраженность боли у 70–80 % пациентов, частота развития побочных эффектов составляет 25–50 %. Для карбамазепина характерно самое высокое соотношение эффективность/безопасность по сравнению с другими препаратами, поэтому карбамазепину присвоен уровень доказательности А в отношении применения при данной патологии. Карбамазепин является препаратом первого выбора при лечении невралгии тройничного нерва.
3. При болевой форме диабетической полинейропатии карбамазепин ослабляет выраженность боли у 30–50 % пациентов, частота развития побочных эффектов составляет 25–50 %. Соотношение эффективность/безопасность у карбамазепина при лечении болевой формы диабетической полинейропатии является более низким, чем у многих других лекарственных средств, поэтому карбамазепин используют в качестве препарата третьей линии терапии при лечении данной патологии.
4. При других синдромах нейропатической боли карбамазепин либо плохо исследован, либо малоэффективен/неэффективен.
1. Smith H.S. Current Therapy in Pain: Expert Consult. — Saundrs, 2008. — 704 p.
2. Goodman & Gilman’s The Pharmacological Basis of Therapeutics, 11th edition. — New York: McGraw-Hill, 2006. — 2021 p.
3. Richeimer S. Understanding Neuropathic Pain. — 2007. www.spineuniverse.com
4. Hupka A. Local Anesthetics. — 2008. www.youpublish.com
5. Singh J.N., Jain G., Ramarao P., Sharma S.S. Inhibition of sodium current by carbamazepine in dorsal root ganglion neurons in vitro // Indian J. Physiol. Pharmacol. — 2009. — V. 53, № 2. — P. 147-154.
6. Rho J.M., Sankar R. The pharmacologic basis of antiepileptic drug action // Epilepsia. — 1999. — V. 40, № 11. — P. 1471-1483.
7. Sheets P.L., Heers C., Stoehr T., Cummins T.R. Differential block of sensory neuronal voltage-gated sodium channels by lacosamide [(2R)-2-(acetylamino)-N-benzyl-3-methoxypropanamide], lidocaine, and carbamazepine // J. Pharmacol. Exp. Ther. — 2008. — V. 326, № 1. — P. 89-99.
8. Pain / Ed. by F. Cervero, T.S. Jensen. // Series «Handbook of clinical neurology». — 2006. — V. 81. — 911 p.
9. Levy R.H. Antiepileptic drugs. — Lippincott Williams & Wilkins, 2002. — 968 p.
10. Granger P., Biton B., Faure C. et al. Modulation of the gamma-aminobutyric acid type A receptor by the antiepileptic drugs carbamazepine and phenytoin // Mol. Pharmacol. — 1995. — V. 47. — P. 1189-1196.
11. Maizels M., McCarberg B. Antidepressants and antiepileptic drugs for chronic non-cancer pain // Am. Fam. Physician. — 2005. — V. 71, № 3. — P. 483-490.
12. Katusic S., Beard C.M., Bergstralh E., Kurland L.T. Incidence and clinical features of trigeminal neuralgia, Rochester, Minnesota, 1945–1984 // Ann. Neurol. — 1990. — V. 27, № 1. — P. 89-95.
13. Cruccu G., Biasiotta A., Galeotti F. et al. Diagnosis of trigeminal neuralgia: a new appraisal based on clinical and neurophysiological findings // Suppl. Clin. Neurophysiol. — 2006. — V. 58. — P. 171-186.
14. Krafft R. Trigeminal Neuralgia // Am. Fam. Physician. — 2008. — V. 77, № 9. — P. 1291-1296.
15. Spina E., Perugi G. Antiepileptic drugs: indications other than epilepsy // Epileptic Disord. — 2004. — V. 6, № 2. — P. 57-75.
16. Rockliff B.W., Davis E.H. Controlled sequential trials of carbamazepine in trigeminal neuralgia // Arch. Neurol. — 1966. — V. 15. — P. 129-136.
17. Campbell F.G., Graham J.G., Zilkha K.J. Clinical trial of carbamazepine (Tegretol) in trigeminal neuralgia // J. Neurol. Neurosurg. Psychiat. — 1966. — V. 29. — P. 265-267.
18. Killian J.M., Fromm G.H. Carbamazepine in the treatment of neuralgia // Arch. Neurol. — 1968. — V. 19. — P. 129-136.
19. Nicol C.F. A four year double blind study of Tegretol in facial pain // Headache. — 1969. — V. 9. — P. 54-57.
20. Vilming S.T., Lyberg T., Lataste X. Tizanidine in the management of trigeminal neuralgia // Cephalalgia. — 1986. — V. 6. — P. 181-182.
21. Lindstrom P., Lindblom U. The analgesic effect of tocainide in effect of tocainide in trigeminal neuralgia // Pain. — 1987. — V. 28. —P. 45-50.
22. Leichin F., van der Dijs B., Lechin M.E. Pimozide therapy for trigeminal neuralgia // Arch. Neurol. — 1989. — V. 46. — P. 960-963.
23. Liebel J.T., Menger N., Langohr H. Oxcarbazepine in der Behandlung der Trigeminusneuralgie // Nervenheilkunde. — 2001. — V. 20. — P. 461-465.
24. Beydoun A. Clinical use of tricyclic anticonvulsants in painful neuropathies and bipolar disorders // Epilepsy Behav. — 2002. — V. 3. — P. S18-S22.
25. Beydoun A. Safety and efficacy of oxcarbazepine: results of randomized, double-blind trials // Pharmacotherapy. — 2000. — V. 20. — P. 152S-158S.
26. Cruccu G., Gronseth G., Alksne J. et al. AAN-EFNS guidelines on trigeminal neuralgia management // Eur. J. Neurol. — 2008. — V. 15, № 10. — P. 1013-1028.
27. McQuay H., Carroll D., Jadad A.R. et al. Anticonvulsant drugs for management of pain: a systematic review // BMJ. — 1995. —V. 311, № 7012. — P. 1047-1052.
28. Taylor J.C., Brauer S., Espir M.L. Long-term treatment of trigeminal neuralgia with carbamazepine // Postgrad. Med. J. — 1981. — V. 57, № 663. — P. 16-18.
29. Siddiqui M.N., Siddiqui S., Ranasinghe J.S., Furgang F.A. Pain management: trigeminal neuralgia // Hospital Physician. — 2003. — P. 64-70. www.turner-white.com
30. Nurmikko T.J., Eldridge P.R. Trigeminal neuralgia — pathophysiology, diagnosis and current treatment // Br. J. Anaesth. — 2001. — V. 87, № 1. — P. 117-132.
31. Jorns T.P., Zakrzewska J.M. Evidence-based approach to the medical management of trigeminal neuralgia // Br. J. Neurosurg. — 2007. — V. 21, № 3. — P. 253-61.
32. Askmark H., Wiholm B.E. Epidemiology of adverse reactions to carbamazepine as seen in a spontaneous reporting system // Acta Neurol. Scand. — 1990. — V. 81, № 2. — P. 131-140.
33. Pellock J.M. Carbamazepine side effects in children and adults // Epilepsia. — 1987. — V. 28 (Suppl. 3). — P. S64-S70.
34. Sindrup S.H., Jensen T.S. Pharmacotherapy of trigeminal neuralgia // Clin. J. Pain — 2002. — V. 18. — P. 22-27.
35. Wiffen P., Collins S., Carroll D. et al. Anticonvulsant drugs for acute and chronic pain // The Cochrane Database of Systematic Reviews. — 2005. — Issue 3. — Art. No.: CD001133. — pub2. DOI: 10.1002/14651858.CD001133.
36. Wiffen P., McQuay H., Moore R. Carbamazepine for acute and chronic pain // The Cochrane Database for Systematic Reviews. — 2005. — Issue 3. — Art. No.: CD005451. DOI: 10.1002/14651858.CD005451.
37. Guidelines for the treatment of neuropathic pain // Western Australian therapeutic advisory group. — 2007. www.watag.org.au
38. Mihai B., Lăcătuşu C., Graur M. et al. Pharmacologic therapy in peripheral diabetic polyneuropathy // Rev. Med. Chir. Soc. Med. Nat. Iasi. — 2010. — V. 114, № 2. — P. 332-341.
39. Diabetic neuropathies: the nerve damage of diabetes. — 2009. — NIH Publication No. 09–3185.
40. Rogawski M.A., Lцscher W. The neurobiology of antiepileptic drugs for the treatment of nonepileptic conditions // Nature Medicine. — 2004. — V. 10. — P. 685-692.
41. Rull J.A., Quibrera R., Gonzalez-Millan H. et al. Symptomatic treatment of peripheral diabetic neuropathy with carbamazepine: double-blind crossover study // Diabetologia. — 1969. — V. 5. — P. 215-220.
42. Wilton T.D. Tegretol in the treatment of diabetic neuropathy // S. Afr. Med. J. — 1974. — V. 48. — P. 869-872.
43. Gomez-Perez F.J., Choza R., Rios M. et al. Nortriptyline-fluphenazine versus carbamazepine in the symptomatic treatment of diabetic neuropathy // Arch. Med. Res. — 1996. — V. 27. — P. 525-529.
44. Tannhauser M., Tannhauser S.L., Barros H.M., Barros E.J. Carbamazepine-induced hyperglycemia in hyponatremic rats // Pharmacology. — 1982. — V. 24, № 2. — P. 123-125.
45. Dworkin R.H., O’Connor A.B., Audette J. et al. Recommendations for the pharmacological management of neuropathic pain: an overview and literature update // Mayo Clin. Proc. — 2010. — V. 85, № 3 (Suppl.). — P. S3-S14.
46. Attal N., Cruccu G., Haanpдд M. et al. EFNS guidelines on pharmacological treatment of neuropathic pain // Eur. J. Neurol. — 2006. — V. 13, № 11. — P. 1153-1169.
47. Gerson G.R. Studies on the concomitant use of carbamazepine and clomipramine for the relief of post-herpetic neuralgia // Postgrad. Med. J. — 1977. — V. 53 (Suppl. 4). — P. 104-109.
48. Keczkes K., Basheer A.M. Do corticosteroids prevent postherpetic neuralgia? // Br. J. Dermatol. — 1980. — V. 102. — P. 551-555.
49. Leijon G., Boivie J. Central post-stroke pain: a controlled trial of amitriptyline and carbamazepine // Pain. — 1989. — V. 36. — P. 27-36.
50. Tripathi M., Kaushik S. Carbamazepine for pain management in Guillain-Barrи syndrome patients in the intensive care unit // Crit. Care Med. — 2000. — V. 28. — P. 655-658.
51. Harke H., Gretenkort P., Ladleif H.U. et al. The response of neuropathic pain and pain in complex regional pain syndrome I to carbamazepine and sustained-release morphine in patients pretreated with spinal cord stimulation: a double-blinded randomized study // Anesth. Analg. — 2001. — V. 92, № 2. — P. 488-495.