Международный неврологический журнал 2 (40) 2011
Вернуться к номеру
Нарушение сфингомиелинового цикла в тканях головного мозга при экспериментальной ишемии головного мозга
Авторы: Маджидова Е.Н., Сагатов Д.Р., Иноятова Ф.Х., Расулова Х.А., Ташкентская медицинская академия, Узбекистан
Рубрики: Неврология
Версия для печати
В статье представлены результаты изучения степени изменений сфингомиелинового пути апоптоза на экспериментальной модели острой ишемии головного мозга. Установлено, что мембранодеструкция приводит к изменению содержания в нейроцитах сфингомиелинов и цереброзидов, соотношения сфингомиелинов и суммарного количества фосфолипидов, активности ферментов сфингомиелинового цикла, что свидетельствует о роли сфингомиелинового пути апоптоза в патогенезе ишемического инсульта. Полученные результаты свидетельствуют о необходимости включения эссенциальных фосфолипидов в существующий протокол лечения ишемического инсульта.
Ишемический инсульт, сфингомиелиновый цикл, фосфолипиды.
Церебральная ишемия является актуальной медико-социальной проблемой. Внимание к сосудистой патологии мозга объясняется не только большой распространенностью, высоким процентом смертности и инвалидизации, но и тенденцией к возникновению цереброваскулярных заболеваний у лиц молодого возраста. Несмотря на всестороннее изучение механизмов развития ишемии головного мозга, некоторые компоненты ее патогенеза требуют более углубленного изучения. Например, невыясненной остается роль нарушений фосфолипидного спектра мембран нейроцитов при гипоксическом состоянии, развивающемся при острой фокальной ишемии мозга. Учитывая значение изменений фосфолипидного спектра в реализации сфингомиелиназного цикла, в частности, его регуляции, необходимо отметить роль последней в активации факторов апоптоза. Интенсивность апоптоза, его регулируемость определяют развитие нейродегенеративных изменений, являются причиной болезни Альцгеймера и Паркинсона.
Сфингомиелины (СФМ) мембран нейронов участвуют в процессе передачи сигнала внутри клетки. Это класс липидов, участвующих в регуляции роста клеток и их дифференцировки. Недавно обнаружена их роль в качестве внутриклеточного рецептора a — фактора некроза опухоли (TNF-a); метаболиты СФМ участвуют в росте клеток и поддержании внутриклеточного гомеостаза кальция [8, 9, 12]. Важный элемент передачи сигнала внутри клетки — церамиды. Нарушение регуляции церамидов на внутриклеточном уровне приводит к росту числа таких заболеваний, как сахарный диабет, СПИД, нейродегенеративных заболеваний и снижению иммунокомпетентности [4]. Необходимо отметить, что чрезмерное накопление церамидов приводит к апоптозу клеток [5, 6], так как их быстрое накопление в клетке ускоряет дифференцировку. В связи с этим ряд авторов полагают, что регулируемый баланс церамидов необходим для нормального функционирования клеток [1, 7, 8].
Целью данного исследования явилось изучение степени изменений сфингомиелинового пути апоптоза на экспериментальной модели острой ишемии головного мозга.
Материал и методы
Экспериментальные исследования проводились на 200 беспородных лабораторных крысах-самцах массой 100–150 граммов, находящихся на стандартном рационе вивария. Операции проводили под наркозом с помощью тиопентала натрия в дозировке 50 мг/кг. При этом часть белых крыс (в количестве 10 штук) оставались интактными. Моделирование ишемии головного мозга проводилось путем разреза по средней линии вдоль трахеи у 160 крыс. Послойно рассекали кожу, подкожную клетчатку, фасции. Осторожно отодвигая нижележащие мышцы и ткани тупым путем, выделяли из фасциального влагалища сосудов общую сонную артерию и накладывали на нее лигатуру. Модель нарушения мозгового кровообращения воспроизводилась путем временного клипирования правого ствола безымянной артерии. Затем клипсу устраняли и ушивали рану. Контролем служили 30 животных, которым вскрывали область шеи, препарировали безымянную артерию с последующим ушиванием операционного поля (ложнооперированные животные). Для исключения влияния суточных ритмов декапитацию животных проводили в одно и то же время суток (утром в 9–10 часов).
В тот же день у крыс объективно наблюдалось сужение глазной щели (полуптоз) на стороне очага, слабость и гипотония лапок на контралатеральной очагу стороне. На стороне пареза животные на уколы не реагировали, на лапки не опирались. Животные теряли аппетит, становились неаккуратными, неряшливыми и агрессивными.
Забой животных проводили в термостатируемой комнате, в которой температура поддерживалась в пределах ± 2 °С. Забой производился путем мгновенной декапитации. Для биохимических исследований брали сыворотку крови животных. Головной мозг выделялся целиком, из участка ишемического инсульта была взята ткань для биохимических, морфологических исследований.
Ткань мозга крыс на участке ишемии была гомогенизирована в 0,125М растворе KCl в термостатируемой комнате при температуре ± 2 °С. Активность сфингомиелиназы определяли по методу Hostetler, Yazaki (1979). В качестве субстрата использовался [N-метил 14С] сфингомиелин (Amersham, Англия). Об активности фермента судили по образованию водорастворимого [14С] холинфосфата.
Разделение фосфолипидов (ФЛ) мембран нейронов проводили методом тонкослойной хроматографии на стеклянных пластинках размером 20 ´ 20 см с закрепленным слоем силикагеля (толщиной 250 мкм, средний размер частиц 2–25 мкм, диаметр пор 60 А°, Silifol, Чехия). Двумерную хроматографию экстракта проводили в специальной камере в системе растворителей «хлороформ : метанол : аммиак» (60 : 35 : 5) и «хлороформ + метанол : уксусная кислота : вода». Липидные пятна проявляли в йодной камере. Идентификация фракции проводилась в сравнении с Rf соответствующего «свидетеля».
Полученные результаты обрабатывались статистически с использованием пакета программ Microsoft Excel (StatSoft, Inc., 2003) для персонального компьютера при проверке нормальности распределения Statistica (data analysis software system), version 6.
Результаты и обсуждение
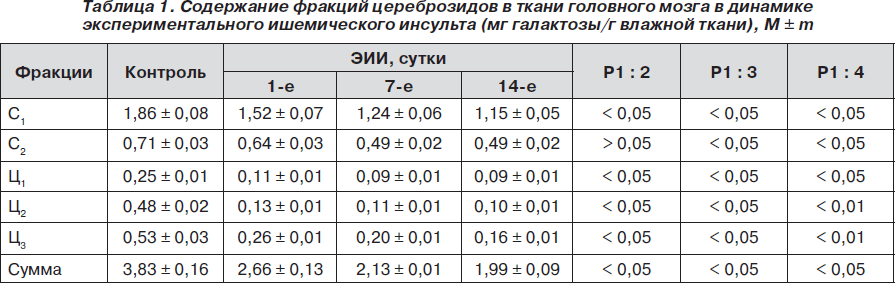
Для оценки сфингомиелиназного цикла в первую очередь необходимо было оценить уровень цереброзидов в ишемизированной зоне головного мозга крыс. Проведенные в этом плане исследования показали соответствие содержания фракций цереброзидов в ткани головного мозга в контрольной группе литературным данным [5, 10, 11]. В то же время у крыс с экспериментальным ишемическим инсультом (ЭИИ) в очаге поражения обнаружено прогрессивное снижение суммарного количества цереброзидов в 1,44; 1,8 и 1,92 раза соответственно срокам 1, 7 и 14 дней воспроизведения модели (табл. 1).
Важно отметить, что снижение суммарного количества цереброзидов в динамике ЭИИ связано с уменьшением фракции С1 в 1,22; 1,5 и 1,62 раза соответственно срокам 1, 7 и 14 суток от начала опыта. Фракция С1 является наибольшей по количеству и наиболее подвижной в хроматографическом поле, что, видимо, связано с ее низкой молекулярной массой. Если содержание фракции С2 через 1 сутки после ишемии-реперфузии имеет лишь тенденцию к снижению, то в дальнейшем достоверно уменьшается в 1,45 раза (Р < 0,05).
Более выраженное снижение было характерно для фракций Ц1–Ц3 : Ц1 — в 2,27; 2,78 и 2,78 раза, Ц2 — в 3,69; 4,36 и 4,8 раза, Ц3 — в 2,04; 2,65 и 3,31 раза соответственно срокам 1, 7 и 14 суток после воспроизведения ЭИИ относительно контрольных значений.
Учитывая, что цереброзиды являются основными компонентами мембран клеток нервной ткани, можно предположить их усиленный распад вследствие ишемии-реперфузии мозга. Они обладают антигенными свойствами, обеспечивают взаимодействие клеток и рецепторные функции. Можно предположить, что снижение их содержания в зоне ишемии приводит к нарушению межклеточного взаимодействия, усиливая процессы апоптоза и некроза клеток. В результате их распада образуются церамиды. Увеличение содержания церамидов связывается рядом авторов [12–14] с недостатком поступления кислорода в ткани головного мозга, наблюдаемым при ишемическом инсульте.
В структуре мембран важное место занимают СФМ. Они являются производными аминоспирта сфингозина и содержат, помимо гидрофобного радикала в составе сфингозина, остаток жирной кислоты, связанный амидной связью с аминогруппой, и остаток фосфохолина (ФХ). Столь специфичное строение СФМ определяет биологические функции, к которым в последние годы чрезвычайно возрос интерес. Установлено, что СФМ является эндогенным ингибитором протеинкиназы С, регулирующим поступление ионов Са2+ в клетку, и оказывает эффект на функции клеток, включая апоптоз.
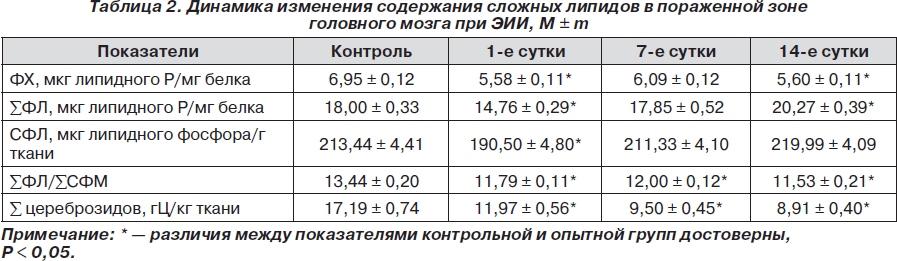
Исследование содержания сфингофосфолипидов в головном мозге в динамике ЭИИ показало достоверное снижение его в пораженной зоне в 1,12 раза в 1-е сутки после воспроизведения модели (табл. 2). В дальнейшем оно постепенно возрастает и к концу эксперимента существенно не отличается от значений контрольной группы животных.
Однако следует упомянуть, что в механизме передачи внеклеточных сигналов важное значение имеет соотношение фосфорсодержащих липидов. В результате экспериментального ишемического инсульта в тканях головного мозга крыс обнаружено достоверное снижение СФМ относительно суммарного количества ФЛ в 1,14; 1,15 и 1,66 раза соответственно срокам 1, 7 и 14 суток после воспроизведения модели. Отмеченный сдвиг в составе мембран нейроцитов наблюдался на протяжении всего эксперимента. СФМ — вторичный посредник при передаче сигналов клеточной пролиферации и апоптоза, и его снижение в нервной ткани, видимо, явилось предрасполагающим фактором к росту нейроглии как типу клеток, имеющих высокую скорость пролиферации.
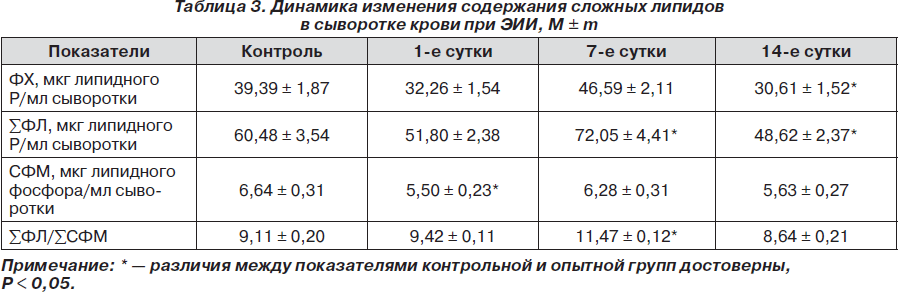
Содержание СФМ в сыворотке крови нормальных крыс оказалось значительно ниже такового в ткани головного мозга опытных животных (табл. 3). В результате ишемии-реперфузии в сыворотке крови достоверно снижалось содержание СФМ в 1,21 раза в 1-е сутки после воспроизведения модели. В дальнейшем его значения несколько возрастали и приближались к значениям контрольной группы. К 14-м суткам ЭИИ содержание СФМ в сыворотке крови вновь снижалось и оказалось ниже уровня контроля в 1,18 раза.
Анализ соотношения суммы ФЛ и суммы СФМ показал тенденцию к их увеличению в 1-е сутки, достоверное превышение контрольных значений в 1,29 раза — на 14-й день после ишемии-реперфузии, а в последующем их снижение относительно показателя контроля.
Следовательно, изменение содержания СФМ в тканях головного мозга и в сыворотке крови значительно отличается. Сохранение СФМ в тканях головного мозга на уровне нормы свидетельствует о значительных адаптивных возможностях СФМ-цикла в нервной системе, тогда как в сыворотке крови резкое снижение содержания СФМ, вероятно, связано с его перераспределением в организме экспериментальных животных.
Вместе с тем снижение мембранных фосфохолина и СФМ может быть связано с накоплением церамида, что, в свою очередь, приводит к апоптозу, т.е. снижение концентрации ФЛ в мембранах является критическим механизмом прерывания жизненного цикла клеток. Следует отметить, что снижение содержания сфингофосфолипидов может быть связано с активацией СМФаз. Согласно данным литературы [8, 15, 16], ишемия ткани сопровождается активацией свободно-радикального окисления, метаболиты которого являются аллостерическими активаторами СФМаз. Кислые (а-Smase) и нейтральные (n-Smase) СФМазы участвуют в разрыве передачи информации внутрь клетки. Активация сфиногомиелиназ приводит к усилению образования церамидов, биологическая роль которых сложна и мультифакторна. В системе передачи сигнала внутрь клетки через рецептор церамид выполняет функцию критического компонента. По мнению Jarvis W.D., Grant S. (1998), церамид — ключевой исполнительный элемент при индукции апоптоза.
Проведенные в этом плане исследования показали статистически значимое увеличение активности нейтральной и кислой СФМаз до 242,2 ± 10,2 и 150,30 ± 3,38 нмоль/мг белка уже на 1-е сутки после воспроизведения ишемии-реперфузии, при значении этого показателя у контрольных животных 180,40 ± 0,74 и 123,6 ± 4,8 нмоль/мг белка соответственно (рис. 1).
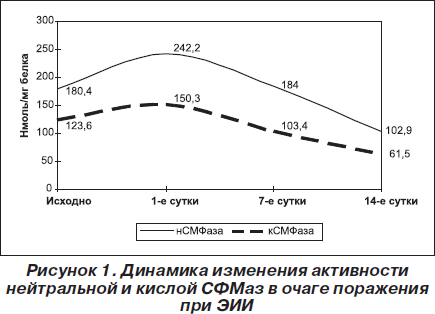
В дальнейшем (на 7-е сутки) активность ферментов снижается до контрольных величин, составляя 184,0 ± 8,3 и 103,4 ± 4,5 нмоль/мг белка, а к концу эксперимента достоверно ниже контрольных значений в 1,75 и 2,01 раза и составляет 102,94 ± 9,2 и 61,5 ± 3,2 нмоль/мг белка (соответственно нейтральная и кислая СФМаза).
Следовательно, при ЭИИ в тканях головного мозга обнаружено уменьшение суммарного количества ФЛ, цереброзидов при стационарном уровне СФМ. Активность СФМаз тканей головного мозга достоверно повышается на 1-е сутки эксперимента с последующим значительным снижением в динамике ЭИИ.
Заключение
Таким образом, при ЭИИ в пораженной зоне головного мозга выявлены изменения ФЛ-спектра мембран, которые способствовали к значительному увеличению легкоокисляемых фракций с максимумом сдвигов на 7-е сутки эксперимента. В отличие от пораженной ткани изменения ФЛ-спектра более выражены и проявляются увеличением ЛФХ, снижением ФХ и суммы ФЛ. Выявленные изменения протекают на фоне изменения СФМ-цикла.
Исходя из вышесказанного, можно сделать следующие выводы:
1. Мембранодеструкция приводит к изменению содержания в нейроцитах сфингомиелинов и цереброзидов, соотношения СФМ/SФЛ, активности ферментов СФМ-цикла, что свидетельствует о роли СФМ-пути апоптоза в патогенезе ЭИИ.
2. Сдвиги в реактивности СФМ-цикла приводят к активации факторов апоптоза.
3. Полученные результаты свидетельствуют о необходимости включения эссенциальных ФЛ в существующий протокол лечения ишемического инсульта.
1. Ижбульдина Г.И. Состояние свободнорадикального окисления липидов, система гемостаза и функция эндотелия у больных в остром периоде ишемического инсульта, эффекты корректоров метаболизма: Автореф. дис… канд. мед. наук. — Пермь: ГОУ ВПО ПГМА, 2009. — 23 с.
2. Левашова О.А. Активность ферментов обмена регуляторных пептидов и некоторые биохимические показатели у больных ишемическим инсультом и в эксперименте: Автореф. дис… канд. биол. наук. — М.: ЦНИЛ ГОУ ДПО «Пензенский ИУВ», 2007. — 28 с.
3. Скворцова В.И. Участие апоптоза в формировании инфаркта мозга // Журн. неврол. и психиатр. им. С.С. Корсакова. Приложение «Инсульт». — 2001. — № 2. — С. 12-18.
4. Федин А.И. Оксидантный стресс и применение антиоксидантов в неврологии // Атмосфера. Нервные болезни. — 2002. — № 1. — С. 15-18.
5. Brass L.M., Alberts M.J. The genetics of cerebrovascular disease // Baillieres. Clin. Neu. — 1995. — Vol. 4, № 2. — P. 221-245.
6. Busse R., Fleming I. Regulation and functional consequences of endothelial nitric oxide formation // Ann. Med. — 1995. — № 27. — P. 331-340.
7. Dahl T., Kontny F., Salagsvold C.E., Christophersen B., Abildgaard U., Odegaard O.R., Morkrid L., Dale J. Lipoprotein (a), other Lipoproteins and hemostatik profiles in patients with ishemic stroke: the relation to cardiogenic embolism // Cerebrovascular Disease. — 2000. — Vol. 10, № 2. — P. 110-117.
8. Eguiagaray J.G., Egea J. et al. Neurotransmitters, Calcium signalling and neuronal communication // Neurocirugia (Astur.). — 2004. — Vol. 15, № 2. — Р. 109-118.
9. Ginsberg M.D. Adventures in pathophysiology of brain ischemia: penumbra, gene expression, neuroprotection // Stroke. — 2003. — Vol. 34, № 1. — Р. 214-223.
10. Kuznetsova S.M., Glazovskaya I.I., Elmanovych S. Dyslipoproteinemas at brain circulation disturbances in elderly people: Long-term observation data // Abstracts of the 5-th international conference on preventive cardiology, Osaka, Japan, May 27–31, 2001. — P. 108.
11. Roth E.J., Lovell L., Siesjo B.K., Siesjo P. Mechanisms of secondary brain injury // Eur. J. Anaesthesiol. — 1996. — Vol. 3, № 13. — P. 247-425.
12. Sacco R.L., Ellenberg J.H., Mohr J.P. et al. Infarcts of undetermined cause: the NINCDS Stroke Data Bank // Ann. Neurol. — 1989. — № 25. — Р. 382-390.
13. Soyama Y., Miura K., Morikawa Y. et al. High-density lipoprotein cholesterol and risk of stroke in Japanese men and women: the Oyabe Study // Stroke. — 2003. — № 34. — Р. 863-868.
14. Walsh K., Smith H., Kim H.S. Vascular cell apoptosis in remodeling, restenosis, and plaque rupture // Circ. Res. — 2000. — № 87. — P. 184-190.
15. Wong K.S., Rossignol D., Rose J.R., Kao R., Carter A., Lynn M. Safety, Pharmacokinetics, and pharmacodynamics of E5564, A lipid A antagonist, during an ascending single-dose clinical study // Journal Clinical Pharmacology. — 2003. — № 43(7). — P. 735-742.
16. Zavalwska M.M., Wilson D.F. Lipid hydroperoxides inhibit reacylation of phospholipids in neuronal membranes // J. Neurochem. — 1998. — № 52.– P. 225-260.