Журнал «» 1(15) 2011
Вернуться к номеру
Нові підходи до фармакологічної корекції артеріальної гіпертензії
Авторы: Соловйов А.І., Зеленський С.М., ДУ «Інститут фармакології та токсикології АМН України», м. Київ
Рубрики: Семейная медицина/Терапия, Кардиология, Терапия
Версия для печати
Мета роботи полягала у формуванні теоретичної та експериментальної бази для створення принципово нових лікарських засобів та підходів для лікування артеріальної гіпертензії різного генезу.
Артеріальна гіпертензія (АГ) продовжує домінувати серед серцево-судинних захворювань та основних причин смертності і втрати працездатності населення, незважаючи на інтенсивні дослідження патогенезу та створення цілого ряду нових лікарських препаратів (інгібітори ангіотензинперетворюючого ферменту та блокатори симпатичної нервової системи, Са2+-блокатори, діуретики, b-блокатори тощо). Тривалий час основну роль у розвитку генералізованого вазоспазму приписували нейрогенним впливам. На даний час стало зрозумілим, що головна, якщо не вирішальна, роль в його розвитку належить місцевим регуляторним механізмам, локалізованим на рівні ефекторних елементів, тобто ендотелію та гладеньких м’язів (ГМ) судинної стінки.
Довгий час вважалося, що головною умовою для розвитку скорочення як судинних, так і всіх інших гладеньком’язових клітин (ГМК) є зростання концентрації іонів Ca2+ у міоплазмі [Ca2+]i. Однак хоча скорочення судинних ГМК ініціюється Ca2+, його кількість не завжди пропорційна амплітуді тонічного скорочення м’язів, оскільки воно може модифікуватися багатьма іньшими факторами, що регулюють фосфорилювання легких ланцюгів міозину або активність фосфатаз. Це явище опосередковується змінами так званої чутливості (спорідненості) скоротливих та/або регуляторних білків скоротливого апарату до Са2+ або Са2+-чутливістю скоротливого апарату [1–3]. Як з’ясувалося в останні роки, однією із ключових ланок у цих механізмах є регуляторний фермент протеїнкіназа С (ПКС), що має велику кількість білків-мішеней у судинних ГМК, регулюючи чутливість їх скоротливих елементів до Са2+, іонний обмін через сарколему, а також впливаючи на тонус ГМК через зміни фізіологічної активності ендотеліальних клітин [1–6]. Необхідно зауважити, що цей надзвичайно широкий спектр регуляторної дії ПКС на тонус судинної стінки повною мірою проявляється за умов розвитку гіпертензивних станів різного генезу, при яких вона залучена до формування гіпертонусу ГМК. Дослідження в цьому напрямку вважаються перспективними, оскільки наведені результати показують, що зміни активності ПКС можуть бути одним з основних механізмів, відповідальних за розвиток гіпертензії.
Дані клінічних та експериментальних досліджень показують, що іонізуючі впливи викликають значні зміни вазомоторної активності, що спричиняють розвиток складних захворювань, таких як артеріальна гіпертензія, ішемічна хвороба серця та інші. Встановлено, що при дії іонізуючої радіації зменшується ендотелійзалежне розслаблення судинної стінки та збільшується судинний тонус, що пов’язане з пригніченням NO-залежного компоненту вазодилатації та збільшенням чутливості скорочувального апарату гладеньких м’язів судин до кальцію [7–10]. Відомо, що навіть одноразове опромінення щурів викликає значне і тривале підвищення артеріального тиску. Однак клітинні та молекулярні механізми розвитку цього патологічного процесу залишаються не розкритими. Стає зрозумілим, що хоча ендотелій і є найбільш радіочутливим та легко вразливим компонентом судинної стінки, існують і інші механізми радіаційного впливу на судини, що пов’язані з можливістю прямого впливу іонізуючого опромінення на скоротливість гладеньком’язових клітин судин ендотелійнезалежним шляхом [7, 8]. Один із можливих шляхів збільшення судинного тонусу пов’язаний зі змінами трансмембранного потенціалу гладеньких м’язових клітин, у регуляції якого важливу роль відіграють калієві канали, зокрема Са2+-залежні К+-канали великої провідності (ВКСа) [10, 11].
ПКС прямо залучена також до процесу апоптозу гладеньком’язових і ендотеліальних клітин у судинній стінці [12], який, у свою чергу, значною мірою залежить від присутності стовбурових клітин. Мезенхімальні стволові клітини (МСК) — це плюрипотентні клітини, здатні диференціюватися в цілий ряд клітинних популяцій. Вони легко ізолюються і культивуються, переміщаються в місця уражень і мають здатність до артеріогенезу [13]. За всіма цими ознаками вони мають бути альтернативою в лікуванні судинних дисфункцій різного генезу. Водночас немає жодних даних про використання їх для лікування судинних уражень, у тому числі пов’язаних із дією надлишку реактивних форм кисню, зокрема при дії іонізуючої радіації. У даному дослідженні така спроба була зроблена.
Відкриття явища РНК-інтерференції (РНКі) дало надію на створення принципово нових підходів до лікування артеріальної гіпертензії. Технологія РНКі — один із найсучасніших високоспецифічних методів цільової генотерапії, суть якого полягає в пригніченні експресії певного гена на стадії трансляції чи порушенні його транскрипції (посттранскрипційний сайленсинг). Реалізація цього процесу відбувається за допомогою коротких (21–23 нуклеотиди) дволанцюгових інтерферуючих РНК (siRNA), які, маючи комплементарну послідовність до молекули-мішені siRNA мРНК, активують білкові системи клітини (Dicer, RISC), що забезпечують її селективну деградацію.
На сьогодні відома структура генів (відповідно і siRNA) багатьох молекул, які беруть участь у розвитку цілого ряду патологій чи запускають його. Заблокувавши siRNA цих молекул-мішеней за допомогою РНК-інтерференції, можна досягти хоча б ослаблення прогресування захворювання. В останні роки ведуться активні дослідження препаратів на основі siRNA проти ВІЛ, раку підшлункової залози, макулярної дистрофії тощо. І хоча вони навряд чи стануть панацеєю, однак створення дієвого й ефективного лікарського засобу буде досить важливим кроком на шляху розробки методів генної терапії. Головною перепоною при створенні ліків на основі siRNA є проблеми їх адресної доставки в необхідні клітини організму. Одним із перспективних методів вирішення даного питання є використання різних транспортних нанокомплексів (у тому числі ліпосом).
Чи не найважливішою сферою використання властивостей РНК-інтерференції є функціональна геноміка. Важливим завданням, яке постало перед людством у зв’язку з описанням геномів багатьох організмів, є з’ясування ролі кожного гена і, відповідно, ролі різноманітних білкових молекул, що беруть участь у розвитку патологічних станів. Вирішення даної проблеми можливе через «блокування» генів, і якщо раніше на пошук вдалого способу (за допомогою антисмислових олігонуклеотидів, хімічних інгібіторів, шляхом внесення необхідної мутації в зиготу) та його реалізацію потрібен був час від декількох місяців до року, то за допомогою технології РНК-інтерференції практично з будь-яким геном любого організму (послідовність нуклеотидів якого відома) цю процедуру можна здійснити протягом 1–2 тижнів, при цьому значно підвищивши специфічність блокування. Отже, РНК-інтерференція була обрана нами як інструмент для розкриття можливого механізму розвитку артеріальної гіпертензії.
Таким чином, у даному дослідженні ставилося за мету: синтезувати нові сполуки, що здатні розслаблювати гладенькі м’язи судин за відсутності зниження внутрішньоклітинного кальцію, тобто розробити новий клас антигіпертензивних препаратів Са2+-десенситайзерів; розробити методику виділення, культивування дорослих мезенхімальних стовбурових клітин для нормалізування функції ендотелію і гладеньком’язових клітин судин щурів з артеріальною гіпертензією; розробити та застосувати метод блокування «гасіння» експресії генів протеїнкінази С для корекції судинних дисфункцій при артеріальній гіпертензії за допомогою siRNA-індукованого сайленсингу генів дельта-ізоформи протеїнкінази С та встановити його терапевтичну ефективність на щурах з генетично-детермінованою артеріальною гіпертензією.
При проведенні досліджень були використані методи вивчення трансмембранних іонних струмів у гладеньком’язових клітинах судин, одночасної реєстрації скоротливої активності та концентрації іонізованого кальцію [Сa2+]i у міоплазмі ГМК, а також методи вивчення експресії іонних каналів, ферментів та siРНК-індукованого сайленсінгу генів, що кодують експресію іонних каналів та ферментних систем в ГМК.
Са2+-десенситайзери
У ході досліджень було синтезовано та піддано первинному фармакологічному аналізу (вивчення гострої токсичності та фармакодинаміки) групу хімічних сполук, що мають здатність розслаблювати гладенькі м’язи судин без супутнього зниження [Сa2+]i, так звані кальцієві десенситайзери. Встановлено, що такі властивості мають блокатори Rho- та C-кінази. Дослідження проводились зі сполуками з ряду похідних індолізину.
У дослідах використовувався метод, що базується на одночасній реєстрації внутрішньоклітинної концентрації іонів кальцію [Са2+]і та скоротливої активності ГМ сегментів кровоносних судин. На відміну від дослідів на скінованих препаратах він дозволяє спостерігати за кореляцією змін ∆[Са2+]і та скоротливої реакції ГМ судин із цілісною мембраною ГМК, що більш реалістично відображає зміни кальцієвої чутливості скоротливого апарату ГМ судин та/чи регуляторних білків ГМК під впливом синтезованих речовин. Використовувався двохвильовий флуоресцентний метод вимірів концентрації іонів кальцію із застосуванням барвника Fura-2, що базується на співвідношенні, яке пов’язує величину [Са2+]і з відношенням інтенсивності флюоресценції при опроміненні досліджуваного об’єкту ультрафіолетом з довжиною хвилі 340 нм (I340nm) та 380 нм (I380nm) відповідно — Ratio (340/380).
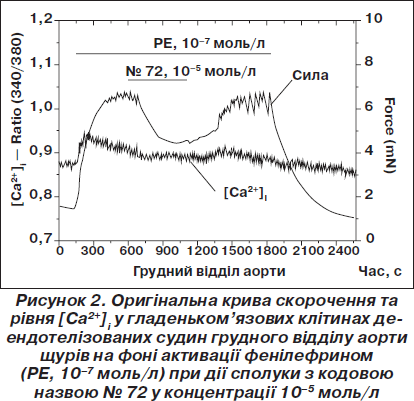
На рис. 1, 2 зображені реакція ГМ сегментів кровоносних судин на два з таких синтезованих десенситайзерів під кодовими назвами № 4 та № 72.
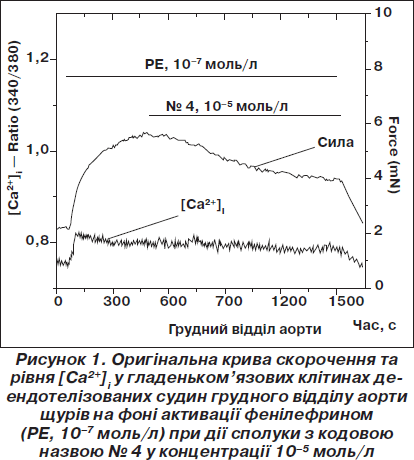
Сполука № 4 викликала розслаблення в середньому на 49,8 ± 5,9 % щодо максимального значення скорочення фенилефрином з одночасним зменшенням рівня [Ca2+]i лише на 24,4 ± 8,0 %. Оскільки таке зменшення рівня [Ca2+]i за час дії сполуки статистично вірогідно не відрізнялось від контрольних записів, це дозволяє зробити висновок, що розслаблююча дія сполуки № 4 обумовлена тільки її Са2+-десенситизуючими властивостями.
Сполука № 72 викликала розслаблення сегментів судин з одночасним підвищенням рівня [Ca2+]i, що свідчить про наявність у неї Са2+-десенситизуючих властивостей.
Для проведення токсикологічних досліджень було обрано три речовини з найбільш вираженою вазодилататорною дією. Гостра токсичність субстанцій була вивчена відповідно до методу up-and-down. У дослідженнях використовувались миші. Для всіх досліджуваних біологічно активних сполук ЛД50 було більше ніж 2000 мг/кг, а отже, за вищевказаним параметром токсичності їх можна віднести до однієї групи — відносно нешкідливих речовин.
Дорослі мезенхімальні стовбурові клітини людини
У даному дослідженні не ставилося завдання надати морфологічні або імуногістохімічні докази участі трансплантованих МСК у процесах диференціації ендотеліальних або гладеньком’язових клітин, тобто їх хоумінгу. З практичної точки зору нам видається більш важливим і переконливішим подати докази здатності МСК реально впливати на ключові параметри функціональної активності ефекторних елементів судинної стінки (тобто ендотеліоцитів і міоцитів) — ендотелійзалежне розслаблення і калієву провідність клітинних мембран, яка є головним шляхом регуляції вазодилататорного потенціалу судинної стінки. Давно відомо, що нормальне функціонування ендотелію є ключовим фактором регуляції кровообігу, а калієва провідність визначає рівень мембранного потенціалу ГМК і, відповідно, рівень їх тонічної напруги.
Дорослі мезенхімальні стовбурові клітини (ДМСК) людини було тестовано на щурах з артеріальною гіпертензією, що індукована дією іонізуючого опромінення (у дозі 6 Грей) [14]. На рис. 3 показано ефект відновної дії трансплантації МСК на прикладі ацетилхолін-індукованого (Ach-індукованного) розслаблення ГМ щурів контрольної групи та опромінених щурів.
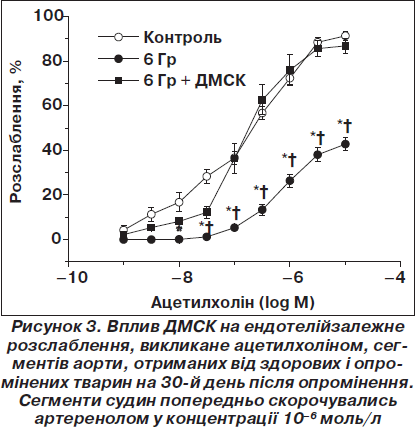
Встановлено, що ДМСК людини, одноразово трансплантовані опроміненим щурам на 7-й день після дії радіації в дозі (16–20) х 106 клітин, не тільки мають яскраво виражену здатність відновлювати ендотелій-залежне Асh-індуковане розслаблення в судинах опромінених щурів, а й можуть нормалізувати калієву провідність у гладеньком’язових клітинах судинної стінки через Са2+-залежні К+-канали великої провідності (рис. 4), тобто нормалізувати вазодилататорний потенціал, порушений унаслідок опромінення, а також нормалізувати підвищений артеріальний тиск.
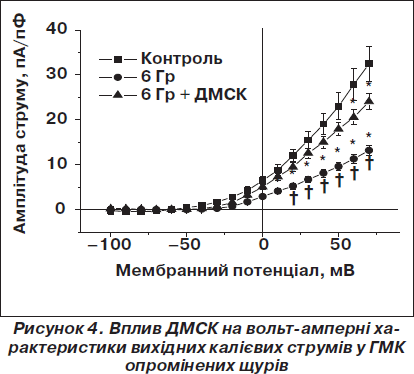
siRNA-індукований сайленсінг генів
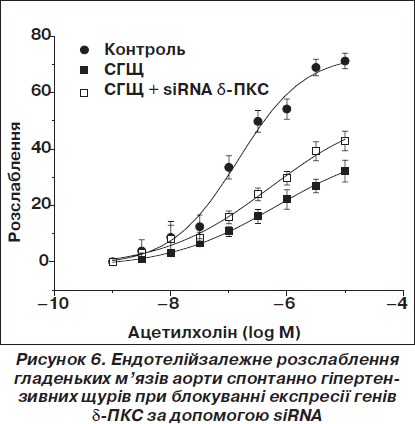
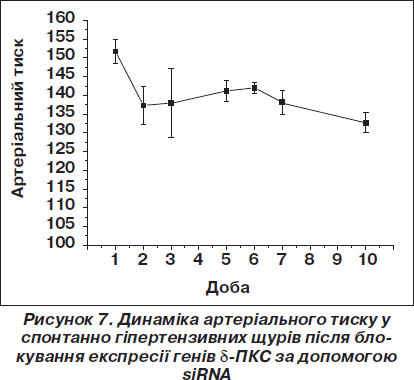
Нами була вперше зроблена спроба використати феномен РНК-інтерференції для зниження артеріального тиску у щурів з генетично детермінованою та індукованою дією опромінення гіпертензією [15, 16]. На рис. 5–7 відображені основні отримані результати впливу siRNA на рівень експресії дельта-ізоформи ПКС (рис. 5), ендотелійзалежне розслаблення (рис. 6) та артеріальний тиск у щурів із генетично детермінованою гіпертензією (рис. 7).
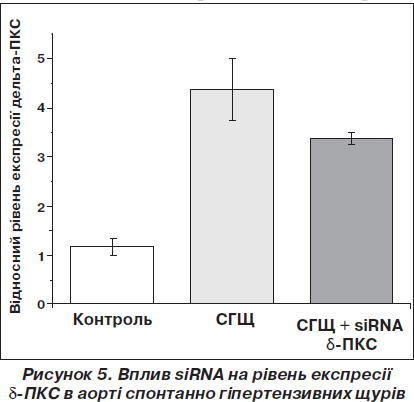
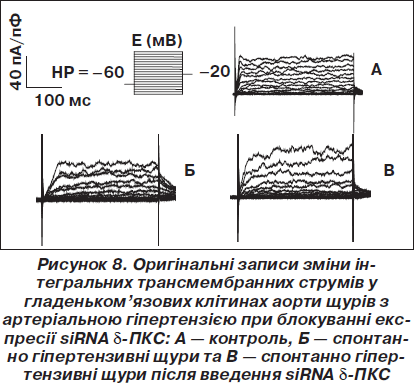
Було вивчено також вплив блокування експресії генів d-ПКС малими інтерферуючими РНК на активність Са2+-залежних К+-каналів великої провідності (ВКСа, maxi-K-канали), які є одними з головних регуляторів гладеньком’язового тонусу судин та кров’яного тиску, що відповідають за дилататорний потенціал ГМ судин.
Відомо, що амплітуда струмів ВКСа-каналів у спонтанно гіпертензивних щурів зменшується, що вказує на зниження вазодилататорного потенціалу гладеньких м’язів. Було встановлено, що амплітуда струмів ВКСа-каналів у спонтанно гіпертензивних щурів, як і у здорових щурів після іонізуючого випромінювання, зменшується, що вказує на зниження вазодилататорного потенціалу гладеньких м’язів. Введення siRNA, специфічних до d-ПКС, призвело до майже повного відновлення функціонування ВКСа-каналів, про що свідчить збільшення амплітуди вихідних струмів ВКСа-каналів у гладеньком’язових клітинах (рис. 8).
Встановлено, що підвищення рівня розслаблення у спонтанно гіпертензивних щурів після введення siRNA d-ПКС свідчить про часткове відновлення механізмів, які відповідають за ендотелійзалежне розслаблення гладеньких м’язів.
Найбільш важливо, що інтегральний показник стану серцево-судинної системи у щурів зі спонтанною гіпертензією — артеріальний тиск — значною мірою знизився після блокування гену d-ПКС малими інтерферуючими РНК, що дає підстави вважати доцільним використання методу блокування генів протеїнкінази С за допомогою малих інтерферуючих РНК з метою корекції судинних дисфункцій при генетично детермінованій артеріальній гіпертензії.
1. Soloviev A., Bershtein S. The сontractile apparatus in vascular smooth muscle cells of spontaneously hypertensive rats possess increased calcium sensitivity: the possible role of protein kinase C // J. Hypertens. — 1992. — 10. — 131-136.
2. Soloviev A., Basilyuk O. Evidence for decrease in myofilament responsiveness to Ca2+ during hypoxia in spontaneously active vascular smooth muscle in rats // Exper. Physiol. — 1993. — Vol. 18. — P. 395-402.
3. Soloviev A., Parshikov A., Stefanov A. et al. Evidence for the involvement of protein kinase C in depression of endothelium-dependent vascular responses in spontaneously hypertensive rats // J. Vasc. Res. — 1998. — 35. — 325-331.
4. Soloviev A., Tiskin S., Parshikov A. et al. Depression of endothelium-dependent relaxation despite normal release of nitric oxide in the aorta of spontaneously hypertensive rats: possible role of protein kinase C // Endothelium-Derived Hyperpolarizations / Ed. by P. Vanhoutte. — Harwood Academic Publishers, 1999. — 289-296.
5. Kizub I., Pavlova A., Soloviev A. Proteine kinase C modulates myofilaments Са2+-sensitivity in vascular smooth muscle: possible role in vasospasm development // J. of Muscle Res. and Cell Motil. — 2005. — Vol. 26, № 1. — P. 70.
6. Kizub I., Pavlova A., Johnson, Soloviev A., Zholos A. Rho kinase and protein kinase C involvement in vascular smooth muscle myofilament calcium sensitization in arteries from diabetic rats // Br. J. Pharmacol. — 2010. — 159. — 1724-1731.
7. Soloviev A., Tishkin S., Zelensky S. et al. Ionizing radiation altersmyofilament calcium sensitivity in vascular smooth muscle: potential role for protein kinase C // Am. J. Physiol. Integr. Comp. Physiol. — 2005. — 289. — R755-R762, 205.
8. Soloviev A., Tishkin, S., Parshikov A., Ivanova I., Goncharov E., Gurney A. Mechanisms of endothelial dysfunction after ionized radiation: selective impairment of the nitric oxide component of endothelium-dependent vasodilation // Br. J. Pharmacol. — 2003. — 138. — P. 837-844.
9. Soloviev A., Stefanov A., Tishkin S. et al. Saline containing phosphatidylcholine liposomes possess the ability to restore endothelial function damaged resulting from gamma-radiation // J. Physiol. Pharmacol. — 2002. — Vol. 53. — P. 707-712.
10. Soloviev A., Tishkin S., Ivanova I. et al. Functional and molecular consequences of ionizing irradiation on large conductance Ca2+ activated K+ channels in rat aorta smooth muscle cells // Life Science. — 2009. — № 84. — P. 164-171.
11. Kizub I., Pavlova A., Ivanova I., Soloviev A. Protein kinase C-dependent inhibition of BKCa current in rat aorta smooth muscle cells following g-irradiation // Int. J. Radiat. Biol. — 2010. — 86. — 291-299.
12. Steinber R., Harari O. et al. A protein kinase C-antiapoptocic kinase signaling complex protects human vascular endothelial cells against apoptosis through induction of Bcl-2 // The J. of Biol. Chem. — 2007. — 282. — 32288-32297.
13. Kinnaird T., Stabile E., Burnett M.S., Lee C.W., Barr S., Fuchs S., Epstein S.E. Marrow-derived stromal cells express genes encoding a broad spectrum of arteriogenic cytokines and promote in vitro and in vivo arteriogenesis through paracrine mechanisms // Circ. Res. — 2004. — 94. — P. 678-685.
14. Soloviev A., Prudnikov I., Tsyvkin V. et al. Electrophysiological and contractile evidence the ability of human mesenchymal stromal stem cells to correct vascular malfunction in rats after ionizing irradiation // The J. of Physiol. Sci. (Japan). — 60. — 2. — 161-172.
15. Soloviev A., Tishkin S., Kyrychenko S. et al. siRNA-targeted to C-kinase gene expression restores BKCa activity and endothelium-dependent relaxation in rats with arterial hypertension. Proced. of The Main Meeting of the Physiol. Soc., PHYSIOLOGY 2010, 30 June — 2 July, University of Manchester, UK. — P. 57.
16. Soloviev A., Kyrychenko S., Novokhatska T. et al. The role of protein kinase C in vascular dysfunction following vascular dysfunction following ionized irradiation and essential hypertension development: pharmacological correction with a target-specific siRNA // Abstr. of the 5th Annual Protein Kinases in Drug Discovery conf., May 27–28, 2010, Boston, USA.
